Tin chuyên ngành
on Monday 22-05-2023 10:31am
Danh mục: Vô sinh & hỗ trợ sinh sản
CN Tăng Lê Thái Ngọc , CN Trần Vĩnh Thiên Ngọc, ThS Phan Thị Kim Anh
IVFMD - Tân Bình
Bệnh viện đa khoa Mỹ Đức
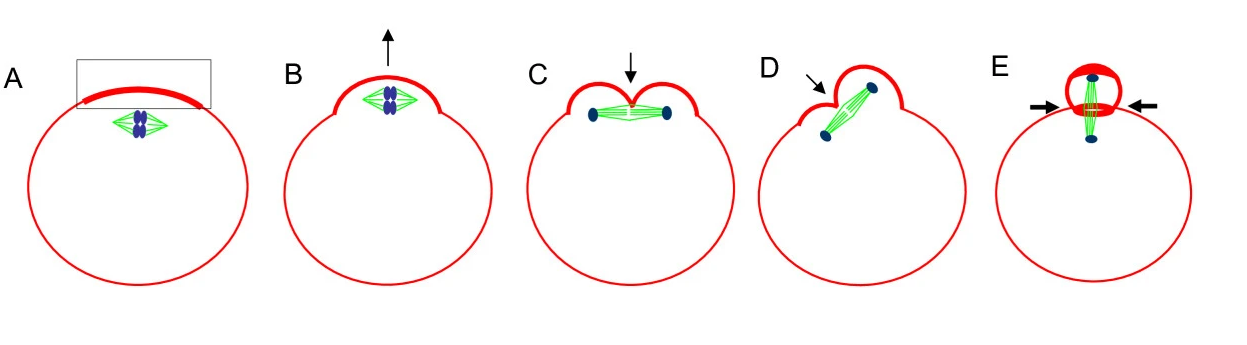
Hình 1. Sự phóng thích thể cực [2]. (A) Các NST cảm ứng hình thành vòng actinomyosin. (B) Hình thành chồi nhú trên màng noãn. (C) Khoảng trống sau khi NST phân ly cảm ứng tạo khe lõm. (D) Hiện tượng xoay thoi vô sắc. (E) Hình thành eo thắt và tống xuất thể cực.
Tại thời điểm quá trình thụ tinh diễn ra, hai bộ NST còn lại trong noãn sẽ tiếp tục phân chia. Một bộ NST đơn được đóng gói trong thể cực thứ hai (PB2) và được tống xuất ra khỏi noãn với cơ chế tương tự quá trình tống xuất PB1. Do đó, cả hai thể cực sẽ chỉ chứa thông tin di truyền đến từ DNA nhân noãn. Tuy nhiên, khác với PB1 có chứa bộ NST lưỡng bội, PB2 chứa bộ NST đơn bội. Các nhiễm sắc tử trong PB2 được bảo vệ bởi một lớp vỏ nhân dày dặn hơn và thông thường, PB2 vẫn có thể được nhận dạng ở những thời điểm muộn hơn trong quá trình phát triển tiền làm tổ của phôi và vẫn đang chứa các protein mới được tổng hợp.
Tuy nhiên, việc phân tích thể cực không phải lúc nào cũng phản ánh đúng tình trạng của noãn và phôi, giá trị của sinh thiết thể cực cho đến nay vẫn còn tranh cãi. Theo Scott và cộng sự (2012) khoảng một nửa số lỗi NST được phát hiện trong PB1 có thể dẫn đến sự phát triển của một phôi bình thường, phôi này có thể bị loại bỏ một cách vô ý. Nghiên cứu trên cũng báo cáo sự ra đời của một trẻ khỏe mạnh từ noãn với các thể cực mang lệch bội do chuyển đoạn tương hỗ [9]. Bên cạnh đó, do số lượng vật chất di truyền từ thể cực bị hạn chế, nếu trường hợp lỗi khuếch đại xảy ra, theo ước tính sẽ có khoảng 10% noãn và hợp tử được xét nghiệm di truyền mà không có kết luận, trong khi tỉ lệ này ở sinh thiết phôi nang chỉ 5% [10]. Điều này cho thấy những khó khăn trong việc giải thích và chẩn đoán kết quả dựa trên sinh thiết thể cực. Hơn nữa, không phải mọi tế bào noãn đều phát triển thành phôi hữu dụng, việc sinh thiết thể cực cho PGT từ ban đầu có thể làm gia tăng chi phí xét nghiệm không cần thiết cho những phôi nang kém chất lượng [10]. Bất chấp những nhược điểm rõ ràng trên, sinh thiết và phân tích di truyền thể cực vẫn được thảo luận trong những năm gần đây như một sự thay thế tiềm năng cho việc sinh thiết phôi nhờ vào tính chất ít xâm lấn và khả năng tránh được dương tính giả do thể khảm. Ở một số quốc gia có hạn chế pháp lý về sinh thiết phôi, việc sinh thiết và sử dụng thông tin di truyền từ thể cực hiện nay vẫn được xem như lựa chọn duy nhất cho các chỉ định PGT-A có nguồn gốc từ mẹ.
Ngược lại với các nghiên cứu đã đề cập ở trên, De Santis và cộng sự (2005) đã đánh giá các thông số về kích thước (bình thường và lớn) và hình dạng (mịn, phân mảnh và thô) của thể cực và xác định không có sự khác biệt đáng kể giữa tỉ lệ thụ tinh hoặc chất lượng phôi với hình thái thể cực [13] . Một tiến cứu của Halvaei và cộng sự (2011) phân tích tiềm năng dự đoán của hình thái thể cực đến tỉ lệ thụ tinh và phát triển của phôi cho thấy sự phân mảnh bất thường của PB1 không dự đoán được tỉ lệ thụ tinh (OR=1,07, 95% KTC, 0,73–1,57) hoặc sự hình thành phôi tốt (OR=1,58, 95% KTC, 0,97– 2,59) [14]. Sự mâu thuẫn giữa các nghiên cứu có thể xuất phát từ sự khác biệt trong tiêu chí và thiết bị kỹ thuật được sử dụng để xác định hình thái thể cực, quy trình điều trị, đặc điểm cỡ mẫu nghiên cứu và thời điểm đánh giá hình thái thể cực. Trong khi khả năng tiên lượng kết quả điều trị của thể cực vẫn chưa được nhất trí, việc đánh giá thể cực vẫn có thể góp phần cung cấp thông tin chi tiết hơn nhằm cải thiện các đánh giá hình thái không xâm lấn hiện có trong thực hành lâm sàng.
Với mục đích trên, kỹ thuật chuyển nhân đã được phát triển và ứng dụng trên nhóm bệnh này. Chuyển nhân được mô tả là phương pháp loại bỏ những ti thể gây bệnh trong tế bào chất bằng cách chuyển vật liệu di truyền từ noãn của bệnh nhân có nhiều ti thể đột biến sang noãn có ti thể khỏe mạnh đã được loại bỏ nhân. Một số phương pháp chuyển nhân đã được thảo luận gần đây bao gồm: chuyển thoi vô sắc, chuyển thể cực và chuyển tiền nhân. Trong đó, chuyển thể cực đang được xem là một phương pháp mới với nhiều tiềm năng phát triển trong tương lai (Hình 2). Khác với các nguồn vật chất di truyền còn lại, thể cực chứa ít ti thể và đã được chứng minh trong nhiều nghiên cứu là có chung bộ gen với noãn. Do đó, việc chuyển thể cực có tiềm năng tối thiểu hóa lượng mtDNA bị đột biến trong các phôi tạo thành, cũng như ở những thế hệ tiếp theo. Bên cạnh đó, bộ gen từ thể cực được bảo vệ trong khối tế bào riêng, PB1 hoặc PB2 được tách ra khỏi noãn và có thể dễ dàng thao tác mà không gây tổn thương đến hệ gen của chúng.
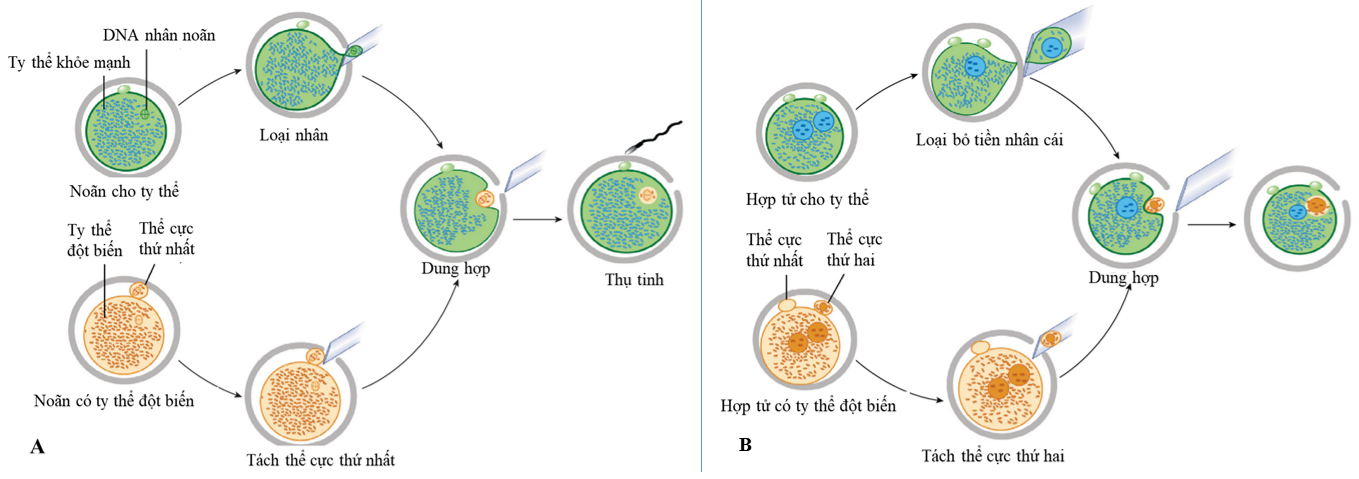
Hình 2. Chuyển thể cực thứ nhất (A) và thứ hai (B) [17].
Bằng chứng thuyết phục nhất về tính toàn vẹn của bộ gen thể cực đến từ các thí nghiệm trên chuột cho thấy chuyển thể cực có thể tái tạo các hợp tử có khả năng phát triển thành một cá thể động vật sinh sống bình thường [18, 19]. Trong nghiên cứu của Wakayama và Yanigamachi (1998), PB1 được chuyển vào các noãn trưởng thành sau khi cấu trúc thoi vô sắc ở noãn đã bị loại bỏ, các NST từ PB1 đã hình thành một cấu trúc thoi vô sắc mới. Sau khi thụ tinh, 30-57% số tế bào noãn đó đã tạo ra những con chuột sinh sống [19]. Tiếp theo đó, nghiên cứu của Wang và cộng sự (2014) so sánh tác động của bốn kiểu chuyển nhân ở chuột: chuyển PB1, chuyển PB2, chuyển thoi vô sắc, và chuyển tiền nhân cho kết quả tỉ lệ sinh sống sau khi thực hiện các kỹ thuật chuyển nhân trên là tương tự nhau (lần lượt, 42,8%, 44,4%, 40% và 53,8%). Kết quả trên cũng tương tự với nhóm đối chứng không chuyển nhân và tất cả các con chuột con được sinh ra đều khỏe mạnh. Ngoài ra phân tích di truyền bằng kỹ thuật Pyrosequencing xác nhận rằng không thể xác định được tỉ lệ không đồng nhất ở thế hệ F1 từ chuyển PB1, trong khi tỉ lệ này ở nhóm chuyển PB2, chuyển thoi vô sắc và chuyển tiền nhân lần lượt 1,7%, 5,5% và 23,7%. Hơn nữa, kiểu gen mtDNA vẫn ổn định ở thế hệ F2 sau khi chuyển PB1 [6]. Điều này đã chứng minh các cá thể sinh ra từ chuyển PB1 sở hữu tỉ lệ di truyền mtDNA từ noãn cho thể cực ở mức tối thiểu so với thế hệ F1 từ các quy trình chuyển nhân khác. Trong nghiên cứu mới nhất về chuyển thể cực của Wang và cộng sự (2020) đã báo cáo trường hợp hai cá thể khỉ khỏe mạnh đã được sinh thành công từ noãn mới được tái tạo bởi kỹ thuật chuyển PB1. Kết quả phân tích bộ gen từ mô tai của hai cá thể trên cho thấy chúng đều thừa hưởng bộ gen từ khỉ mẹ đã cho PB1. Để xác định nguồn gốc của mtDNA ở hai con khỉ, nhóm tác giả đã giải trình tự các vùng D-loop gen ti thể của hai cá thể khỉ con và so sánh với vùng trình tự trên của khỉ mẹ cho PB1 và khỉ hiến noãn. Kết quả cho thấy mtDNA của hai cá thể khỉ trên chủ yếu có nguồn gốc từ khỉ hiến noãn [20]. Những kết quả này chỉ ra rằng việc chuyển thể cực là một phương pháp thay thế ti thể tiềm năng và đầy hứa hẹn để ngăn ngừa các bệnh đột biến mtDNA.
IVFMD - Tân Bình
Bệnh viện đa khoa Mỹ Đức
- GIỚI THIỆU CHUNG
- TỔNG QUAN VỀ THỂ CỰC
- Sự hình thành và tống xuất thể cực.

Hình 1. Sự phóng thích thể cực [2]. (A) Các NST cảm ứng hình thành vòng actinomyosin. (B) Hình thành chồi nhú trên màng noãn. (C) Khoảng trống sau khi NST phân ly cảm ứng tạo khe lõm. (D) Hiện tượng xoay thoi vô sắc. (E) Hình thành eo thắt và tống xuất thể cực.
Tại thời điểm quá trình thụ tinh diễn ra, hai bộ NST còn lại trong noãn sẽ tiếp tục phân chia. Một bộ NST đơn được đóng gói trong thể cực thứ hai (PB2) và được tống xuất ra khỏi noãn với cơ chế tương tự quá trình tống xuất PB1. Do đó, cả hai thể cực sẽ chỉ chứa thông tin di truyền đến từ DNA nhân noãn. Tuy nhiên, khác với PB1 có chứa bộ NST lưỡng bội, PB2 chứa bộ NST đơn bội. Các nhiễm sắc tử trong PB2 được bảo vệ bởi một lớp vỏ nhân dày dặn hơn và thông thường, PB2 vẫn có thể được nhận dạng ở những thời điểm muộn hơn trong quá trình phát triển tiền làm tổ của phôi và vẫn đang chứa các protein mới được tổng hợp.
- Sự khác nhau giữa thông tin di truyền từ thể cực và nhân của noãn
- VAI TRÒ CỦA THỂ CỰC TRONG HỖ TRỢ SINH SẢN
- Sinh thiết thể cực trong xét nghiệm di truyền tiền làm tổ
Tuy nhiên, việc phân tích thể cực không phải lúc nào cũng phản ánh đúng tình trạng của noãn và phôi, giá trị của sinh thiết thể cực cho đến nay vẫn còn tranh cãi. Theo Scott và cộng sự (2012) khoảng một nửa số lỗi NST được phát hiện trong PB1 có thể dẫn đến sự phát triển của một phôi bình thường, phôi này có thể bị loại bỏ một cách vô ý. Nghiên cứu trên cũng báo cáo sự ra đời của một trẻ khỏe mạnh từ noãn với các thể cực mang lệch bội do chuyển đoạn tương hỗ [9]. Bên cạnh đó, do số lượng vật chất di truyền từ thể cực bị hạn chế, nếu trường hợp lỗi khuếch đại xảy ra, theo ước tính sẽ có khoảng 10% noãn và hợp tử được xét nghiệm di truyền mà không có kết luận, trong khi tỉ lệ này ở sinh thiết phôi nang chỉ 5% [10]. Điều này cho thấy những khó khăn trong việc giải thích và chẩn đoán kết quả dựa trên sinh thiết thể cực. Hơn nữa, không phải mọi tế bào noãn đều phát triển thành phôi hữu dụng, việc sinh thiết thể cực cho PGT từ ban đầu có thể làm gia tăng chi phí xét nghiệm không cần thiết cho những phôi nang kém chất lượng [10]. Bất chấp những nhược điểm rõ ràng trên, sinh thiết và phân tích di truyền thể cực vẫn được thảo luận trong những năm gần đây như một sự thay thế tiềm năng cho việc sinh thiết phôi nhờ vào tính chất ít xâm lấn và khả năng tránh được dương tính giả do thể khảm. Ở một số quốc gia có hạn chế pháp lý về sinh thiết phôi, việc sinh thiết và sử dụng thông tin di truyền từ thể cực hiện nay vẫn được xem như lựa chọn duy nhất cho các chỉ định PGT-A có nguồn gốc từ mẹ.
- Hình thái thể cực và mối tương quan đến kết cục điều trị thụ tinh ống nghiệm
Ngược lại với các nghiên cứu đã đề cập ở trên, De Santis và cộng sự (2005) đã đánh giá các thông số về kích thước (bình thường và lớn) và hình dạng (mịn, phân mảnh và thô) của thể cực và xác định không có sự khác biệt đáng kể giữa tỉ lệ thụ tinh hoặc chất lượng phôi với hình thái thể cực [13] . Một tiến cứu của Halvaei và cộng sự (2011) phân tích tiềm năng dự đoán của hình thái thể cực đến tỉ lệ thụ tinh và phát triển của phôi cho thấy sự phân mảnh bất thường của PB1 không dự đoán được tỉ lệ thụ tinh (OR=1,07, 95% KTC, 0,73–1,57) hoặc sự hình thành phôi tốt (OR=1,58, 95% KTC, 0,97– 2,59) [14]. Sự mâu thuẫn giữa các nghiên cứu có thể xuất phát từ sự khác biệt trong tiêu chí và thiết bị kỹ thuật được sử dụng để xác định hình thái thể cực, quy trình điều trị, đặc điểm cỡ mẫu nghiên cứu và thời điểm đánh giá hình thái thể cực. Trong khi khả năng tiên lượng kết quả điều trị của thể cực vẫn chưa được nhất trí, việc đánh giá thể cực vẫn có thể góp phần cung cấp thông tin chi tiết hơn nhằm cải thiện các đánh giá hình thái không xâm lấn hiện có trong thực hành lâm sàng.
- Ứng dụng thể cực trong trường hợp điều trị bệnh liên quan đến mtDNA trong hỗ trợ sinh sản
Với mục đích trên, kỹ thuật chuyển nhân đã được phát triển và ứng dụng trên nhóm bệnh này. Chuyển nhân được mô tả là phương pháp loại bỏ những ti thể gây bệnh trong tế bào chất bằng cách chuyển vật liệu di truyền từ noãn của bệnh nhân có nhiều ti thể đột biến sang noãn có ti thể khỏe mạnh đã được loại bỏ nhân. Một số phương pháp chuyển nhân đã được thảo luận gần đây bao gồm: chuyển thoi vô sắc, chuyển thể cực và chuyển tiền nhân. Trong đó, chuyển thể cực đang được xem là một phương pháp mới với nhiều tiềm năng phát triển trong tương lai (Hình 2). Khác với các nguồn vật chất di truyền còn lại, thể cực chứa ít ti thể và đã được chứng minh trong nhiều nghiên cứu là có chung bộ gen với noãn. Do đó, việc chuyển thể cực có tiềm năng tối thiểu hóa lượng mtDNA bị đột biến trong các phôi tạo thành, cũng như ở những thế hệ tiếp theo. Bên cạnh đó, bộ gen từ thể cực được bảo vệ trong khối tế bào riêng, PB1 hoặc PB2 được tách ra khỏi noãn và có thể dễ dàng thao tác mà không gây tổn thương đến hệ gen của chúng.

Hình 2. Chuyển thể cực thứ nhất (A) và thứ hai (B) [17].
Bằng chứng thuyết phục nhất về tính toàn vẹn của bộ gen thể cực đến từ các thí nghiệm trên chuột cho thấy chuyển thể cực có thể tái tạo các hợp tử có khả năng phát triển thành một cá thể động vật sinh sống bình thường [18, 19]. Trong nghiên cứu của Wakayama và Yanigamachi (1998), PB1 được chuyển vào các noãn trưởng thành sau khi cấu trúc thoi vô sắc ở noãn đã bị loại bỏ, các NST từ PB1 đã hình thành một cấu trúc thoi vô sắc mới. Sau khi thụ tinh, 30-57% số tế bào noãn đó đã tạo ra những con chuột sinh sống [19]. Tiếp theo đó, nghiên cứu của Wang và cộng sự (2014) so sánh tác động của bốn kiểu chuyển nhân ở chuột: chuyển PB1, chuyển PB2, chuyển thoi vô sắc, và chuyển tiền nhân cho kết quả tỉ lệ sinh sống sau khi thực hiện các kỹ thuật chuyển nhân trên là tương tự nhau (lần lượt, 42,8%, 44,4%, 40% và 53,8%). Kết quả trên cũng tương tự với nhóm đối chứng không chuyển nhân và tất cả các con chuột con được sinh ra đều khỏe mạnh. Ngoài ra phân tích di truyền bằng kỹ thuật Pyrosequencing xác nhận rằng không thể xác định được tỉ lệ không đồng nhất ở thế hệ F1 từ chuyển PB1, trong khi tỉ lệ này ở nhóm chuyển PB2, chuyển thoi vô sắc và chuyển tiền nhân lần lượt 1,7%, 5,5% và 23,7%. Hơn nữa, kiểu gen mtDNA vẫn ổn định ở thế hệ F2 sau khi chuyển PB1 [6]. Điều này đã chứng minh các cá thể sinh ra từ chuyển PB1 sở hữu tỉ lệ di truyền mtDNA từ noãn cho thể cực ở mức tối thiểu so với thế hệ F1 từ các quy trình chuyển nhân khác. Trong nghiên cứu mới nhất về chuyển thể cực của Wang và cộng sự (2020) đã báo cáo trường hợp hai cá thể khỉ khỏe mạnh đã được sinh thành công từ noãn mới được tái tạo bởi kỹ thuật chuyển PB1. Kết quả phân tích bộ gen từ mô tai của hai cá thể trên cho thấy chúng đều thừa hưởng bộ gen từ khỉ mẹ đã cho PB1. Để xác định nguồn gốc của mtDNA ở hai con khỉ, nhóm tác giả đã giải trình tự các vùng D-loop gen ti thể của hai cá thể khỉ con và so sánh với vùng trình tự trên của khỉ mẹ cho PB1 và khỉ hiến noãn. Kết quả cho thấy mtDNA của hai cá thể khỉ trên chủ yếu có nguồn gốc từ khỉ hiến noãn [20]. Những kết quả này chỉ ra rằng việc chuyển thể cực là một phương pháp thay thế ti thể tiềm năng và đầy hứa hẹn để ngăn ngừa các bệnh đột biến mtDNA.
- Kết luận
- Tài liệu tham khảo
- Wei, Y., Zhang, T., Wang, Y. P., Schatten, H., & Sun, Q. Y. (2015). Polar bodies in assisted reproductive technology: current progress and future perspectives. Biology of reproduction, 92(1), 19-1.
- Wang, Q., Racowsky, C., & Deng, M. (2011). Mechanism of the chromosome-induced polar body extrusion in mouse eggs. Cell division, 6(1), 1-9.
- Ebner, T., Moser, M., Sommergruber, M., Yaman, C., Pfleger, U., & Tews, G. (2002). First polar body morphology and blastocyst formation rate in ICSI patients. Human Reproduction, 17(9), 2415-2418.
- Christopikou, D., Tsorva, E., Economou, K., Shelley, P., Davies, S., Mastrominas, M., & Handyside, A. H. (2013). Polar body analysis by array comparative genomic hybridization accurately predicts aneuploidies of maternal meiotic origin in cleavage stage embryos of women of advanced maternal age. Human Reproduction, 28(5), 1426-1434.
- Hou, Y., Fan, W., Yan, L., Li, R., Lian, Y., Huang, J., ... & Qiao, J. (2013). Genome analyses of single human oocytes. Cell, 155(7), 1492-1506.
- Wang, T., Sha, H., Ji, D., Zhang, H. L., Chen, D., Cao, Y., & Zhu, J. (2014). Polar body genome transfer for preventing the transmission of inherited mitochondrial diseases. Cell, 157(7), 1591-1604.
- Schenk, M., Groselj-Strele, A., Eberhard, K., Feldmeier, E., Kastelic, D., Cerk, S., & Weiss, G. (2018). Impact of polar body biopsy on embryo morphokinetics—back to the roots in preimplantation genetic testing?. Journal of assisted reproduction and genetics, 35(8), 1521-1528.
- Verpoest, W., Staessen, C., Bossuyt, P. M., Goossens, V., Altarescu, G., Bonduelle, M., ... & Sermon, K. (2018). Preimplantation genetic testing for aneuploidy by microarray analysis of polar bodies in advanced maternal age: a randomized clinical trial. Human reproduction, 33(9), 1767-1776.
- Treff, N. R., Scott, R. T., Su, J., Campos, J., Stevens, J., Schoolcraft, W., & Katz-Jaffe, M. (2012). Polar body morphology is not predictive of its cell division origin. Journal of assisted reproduction and genetics, 29(2), 137-139.
- ESHRE PGT Consortium and SIG-Embryology Biopsy Working Group, Kokkali, G., Coticchio, G., Bronet, F., Celebi, C., Cimadomo, D., ... & De Rycke, M. (2020). ESHRE PGT Consortium and SIG Embryology good practice recommendations for polar body and embryo biopsy for PGT. Human reproduction open, 2020(3), hoaa020.
- Fancsovits, P., Tóthné, Z. G., Murber, A., Takacs, F. Z., Papp, Z., & Urbancsek, J. (2006). Correlation between first polar body morphology and further embryo development. Acta Biologica Hungarica, 57(3), 331-338.
- Zhou, W., Fu, L., Sha, W., Chu, D., & Li, Y. (2016). Relationship of polar bodies morphology to embryo quality and pregnancy outcome. Zygote, 24(3), 401-407.
- De Santis, L., Cino, I., Rabellotti, E., Calzi, F., Persico, P., Borini, A., & Coticchio, G. (2005). Polar body morphology and spindle imaging as predictors of oocyte quality. Reproductive BioMedicine Online, 11(1), 36-42.
- Halvaei, I., Khalili, M. A., Soleimani, M., & Razi, M. H. (2011). Evaluating the role of first polar body morphology on rates of fertilization and embryo development in ICSI cycles. International Journal of Fertility & Sterility, 5(2), 110.
- Brown, D. T., Herbert, M., Lamb, V. K., Chinnery, P. F., Taylor, R. W., Lightowlers, R. N., ... & Turnbull, D. M. (2006). Transmission of mitochondrial DNA disorders: possibilities for the future. The Lancet, 368(9529), 87-89.
- Chinnery, P. F., Elliott, H. R., Hudson, G., Samuels, D. C., & Relton, C. L. (2012). Epigenetics, epidemiology and mitochondrial DNA diseases. International journal of epidemiology, 41(1), 177-187.
- Wolf, D. P., Mitalipov, N., & Mitalipov, S. (2015). Mitochondrial replacement therapy in reproductive medicine. Trends in molecular medicine, 21(2), 68-76.
- Verlinsky, Y., Dozortsev, D., & Evsikov, S. (1994). Visualization and cytogenetic analysis of second polar body chromosomes following its fusion with a one-cell mouse embryo. Journal of assisted reproduction and genetics, 11(3), 123-131.
- Wakayama, T., & Yanagimachi, R. (1998). The first polar body can be used for the production of normal offspring in mice. Biology of reproduction, 59(1), 100-104.
- Wang, Z., Li, Y., Yang, X., Wang, Y., Nie, Y., Xu, Y., ... & Sun, Q. (2021). Mitochondrial replacement in macaque monkey offspring by first polar body transfer. Cell research, 31(2), 233-236.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thành phố Đà Nẵng, thứ sáu và thứ bảy, ngày 6 - 7 . 3 . 2026
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








