Tin chuyên ngành
on Monday 13-03-2023 8:59am
Danh mục: Vô sinh & hỗ trợ sinh sản
CNSH. Nguyễn Thị Minh Phượng, CNSH. Võ Minh Tuấn
IVFMD Tân Bình
1. TỔNG QUAN VỀ VÔ SINH Ở NAM GIỚI
Vô sinh được định nghĩa là tình trạng một cặp vợ chồng không có thai sau 1 năm chung sống, giao hợp bình thường, không sử dụng các biện pháp tránh thai nào. Theo đánh giá, vô sinh ảnh hưởng tới khoảng 15% dân số trên thế giới và có xu hướng tăng mỗi năm (Louis và cs, 2013). Trước đây, vào những năm thập niên 90 người ta cho rằng các nguyên nhân gây nên vô sinh chủ yếu đến từ nữ giới, nhưng hiện nay các bằng chứng đã cho thấy nguyên nhân từ nam giới chiếm khoảng 20-30% số trường hợp vô sinh (Athayde và cs, 2007). Vì lý do này, những nghiên cứu về vô sinh nam đã được phát triển nhằm mục đích tìm hiểu nguyên nhân và phát triển hướng điều trị phù hợp. Các bằng chứng hiện tại đã chỉ ra một số dấu ấn sinh học để giải thích cho tình trạng vô sinh ở nam giới như các gen chịu trách nhiệm cho quá trình sinh tinh, các vấn đề về giải phẫu, nội tiết, … Ngoài ra, lớn tuổi, ô nhiễm môi trường, giảm cân, stress và béo phì cũng có thể là các nguyên nhân làm giảm chất lượng tinh trùng (Louis và cs, 2013). Rất khó để xác định tỷ lệ chính xác trong vô sinh ở nam giới, nhưng hầu hết cho dù là nguyên nhân gì, sự gia tăng các gốc oxy hóa tự do (Reactive oxygen species – ROS) thường được quan sát thấy. Sự dư thừa này có thể dẫn đến mất cân bằng với các chất chống oxy hóa và khi đạt đến mức bệnh lý có thể gây ra các vấn đề về khả năng sinh sản (Bui và cs, 2018). Vô sinh nam do stress oxy hóa đã được đưa vào nghiên cứu trong nhiều năm gần đây giúp cải thiện kết quả lâm sàng ở bệnh nhân.
1.1. Vai trò của gốc oxy hóa tự do (Reactive oxygen species – ROS) đối với chất lượng tinh trùng
Ở điều kiện sinh lý, nồng độ nhất định ROS có nhiều vai trò với tế bào như điều hòa quá trình apoptosis, tham gia vào quá trình viêm nhiễm, kích hoạt các gen mã hóa enzyme chống oxy hóa. Còn đối với tinh trùng, ROS là con đường thông tin thứ cấp và có những vai trò đặc biệt khác. Sau khi được giải phóng khỏi tinh hoàn, tinh trùng trưởng thành di chuyển qua mào tinh và trải qua các quá trình hoạt hóa phức tạp và liên quan đến thay đổi ion, trao đổi chất, việc sản xuất ROS ở nồng độ thấp. Trong quá trình di chuyển qua mào tinh, ROS có vai trò kích hoạt con đường cyclic adenosine monophosphate (cAMP) ở tinh trùng, thúc đẩy phosphoryl hóa tyrosine bằng cách ức chế tyrosine phosphatase. Cơ chế phân tử này giúp tinh trùng kích hoạt các yếu tố phiên mã liên quan tới các tầng tín hiệu nội bào của tinh trùng (Wagner và cs, 2018). Các nghiên cứu cho thấy ROS có vai trò quan trọng giúp quá trình khả năng hóa, tăng động, di động ở tinh trùng hiệu quả hơn. Hơn thế nữa, chúng hoạt hóa, cho phép tinh trùng liên kết với zona pellucida bao quanh noãn và tạo ra phản ứng acrosome. Do đó, tinh trùng có thể xâm nhập, tiếp cận và hợp nhất với noãn (Du và cs, 2017) (Hình 1).
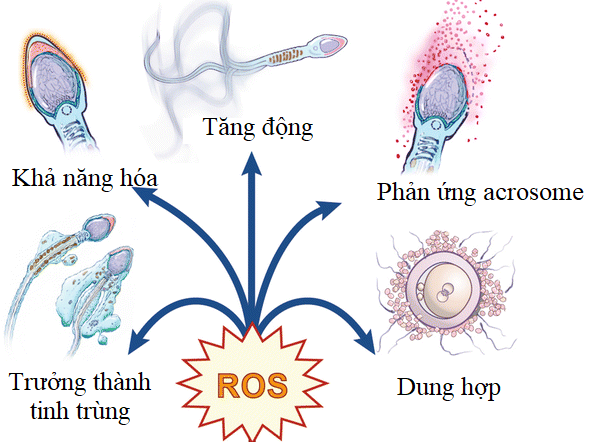
Hình 1. Vai trò của ROS đối với chất lượng tinh trùng
1.2. Nguyên nhân gây mất cân bằng ROS ảnh hưởng đến chất lượng tinh trùng
1.2.1. Yếu tố nội tại tinh hoàn
Các gốc oxy hóa nội sinh có thể được tạo ra như một sản phẩm của quá trình chuyển hóa hoặc hoạt động của enzyme. Cụ thể, hoạt động của ty thể - nằm ở vùng cổ của tinh trùng – kết hợp với quá trình đường phân (glycolysis) cần thiết cho sự di động và khả năng hóa tinh trùng. Năng lượng ATP được tạo ra từ ty thể thông qua phức hợp V (ATP synthase), tuy nhiên các sản phẩm phụ trong quá trình này chủ yếu giải phóng các gốc superoxide (O2•) và hydroxyl (•OH) từ chuỗi truyền điện tử. Các gốc tự do này sau đó được chuyển đổi thành hydro peroxide (H2O2) bởi superoxide dismutase (SOD) (Griveau và cs, 1997). Trong quá trình sinh tinh, một số tinh trùng khiếm khuyết trong quá trình phát triển làm cho tinh trùng vẫn giữ lại phần bào tương cổ hay nói cách khác là tinh trùng chưa trưởng thành. Vùng bào tương này chứa glucose-6-phosphate dehydrogenase (G6PDH) sản xuất β-nicotinamide adenine dinucleotide phosphate (NADPH). NADPH nội bào này sẽ được NADPH oxidase chuyển hóa thành NADP+ và H+. Kết quả của quá trình này là tạo ra electron và proton, electron sau đó được vận chuyển xuyên màng kết hợp với O2 để tạo ion superoxide (Said và cs, 2004). Có thể thấy tinh trùng là một nguồn tạo ra ROS trong tinh dịch, khi tinh trùng chết đi nguồn ROS này sẽ được giải phóng. Trong tinh dịch, tỷ lệ tinh trùng chết tồn tại càng nhiều thì nồng độ ROS sẽ tăng lên, gây ảnh hưởng tới tinh trùng bình thường xung quanh.
1.2.2. Nguồn ROS ngoại sinh
Bên cạnh nguồn ROS nội sinh tại tinh hoàn, ROS còn được tạo ra thông qua một số bệnh lý. Các nghiên cứu về giãn tĩnh mạch thừng tinh cho thấy ở những đối tượng này ROS được tăng lên đáng kể. Giãn tĩnh mạch thừng tinh là tình trạng giãn nở bất thường của đám rối tĩnh mạch nằm trong thừng tinh, tỷ lệ nam giới vô sinh mắc bệnh này khoảng 35-44%, con số này tăng lên tới 45-81% trong trường hợp vô sinh thứ phát (Jensen và cs, 2017). Sự giãn nở tĩnh mạch nhưng kích thước van tĩnh mạch không đổi sẽ gây trào ngược máu và tăng áp lực máu lên thành mạch. Nhiệt độ bình thường của tinh hoàn thường thấp hơn nhiệt độ của cơ thể khoảng 2oC, nhưng trong trường hợp này nhiệt độ bìu tăng dẫn đến sự gia tăng các gốc oxy hóa tự do và mất khả năng chống oxy hóa tạo stress oxy hóa tại tinh hoàn. Sự gia tăng nồng độ ROS cũng được nhận thấy ở bệnh nhân thừa cân – béo phì, do sự gia tăng của các phản ứng viêm trong cơ thể bệnh nhân (Krzysciak và cs, 2011).
Bạch cầu là một nguồn quan trọng của stress oxy hóa, và người ta đã mô tả rằng một bạch cầu tạo ra ROS nhiều hơn 1000 lần so với một tinh trùng đơn lẻ, thông qua việc tăng sản xuất NADPH. Sự gia tăng số lượng bạch cầu thường do nhiễm trùng, cơ thể đáp ứng miễn dịch, thúc đẩy sự xâm nhập của bạch cầu để loại bỏ vùng viêm nhiễm. Nhiều nghiên cứu đã đưa ra các bằng chứng bạch cầu là yếu tố kích thích sản xuất ROS, làm thay đổi nồng độ, khả năng di động và hình thái tinh trùng so với bệnh nhân khỏe mạnh. Các thí nghiệm in vitro cũng cho kết quả tương tự khi ủ tinh trùng với bạch cầu (Saleh và cs, 2002; lobascio và cs, 2015).
Ngoài ra, sự gia tăng ROS có thể do nhiều nguyên nhân: nhiệt độ, môi trường sống, từ trường, phóng xạ, ô nhiễm, thuốc trừ sâu, rượu, thuốc lá, căng thẳng tinh thần, béo phì, chế độ ăn không hợp lý, nhiễm trùng, miễn dịch và các bệnh mãn tính… Việc tạo ra ROS còn có thể kích hoạt quá trình apoptosis ở các tế bào tinh trùng cũng như hủy hoại các protein trên bề mặt của tinh trùng từ đó tạo ra các tinh trùng dị dạng (Tvrdá và cs, 2022; Silva và cs, 2017).
1.3. Ảnh hưởng của ROS lên khả năng sinh sản ở nam giới
Mặc dù ROS có vai trò nhất định, tuy nhiên, nếu nồng độ ROS tạo ra không được kiểm soát hoặc quá mức có thể ảnh hưởng đến chức năng của tinh trùng do stress oxy hóa (oxidative stress – OS) trở thành tác nhân quan trọng liên quan đến nguyên nhân gây vô sinh ở nam giới. Những người đàn ông vô sinh có biểu hiện nồng độ ROS cao hơn và khả năng chống oxy hóa thấp hơn đáng kể so với nam giới bình thường. Khoảng 25 - 40% mẫu tinh dịch ở nam giới vô sinh có nồng độ ROS cao (De Lamirande và cs, 1995). Một số nghiên cứu đã chứng minh sự cảm ứng quá trình peroxid hóa màng tế bào hay sự phân mảnh DNA tinh trùng là hai hậu quả chính gây ra bởi sự tạo ROS quá mức trong quá trình phát triển của tinh trùng. Tinh trùng là tế bào nhỏ nhất trong cơ thể, chứa hàm lượng lớn các acid béo không bão hòa nên làm cho màng tinh trùng lỏng lẻo, dễ nhạy cảm với ROS. DNA tinh trùng được bao bọc bởi các protein bảo vệ, đặc biệt là các chất chống oxi hóa (antioxidants) trong tinh dịch. ROS nồng độ cao có thể phá vỡ các cơ chế bảo vệ này và gây tổn thương DNA tinh trùng. ROS làm đứt gãy các chuỗi DNA đơn và kép, gây đột biến gen. Nếu tổn thương DNA nhẹ, tinh trùng có thể tự phục hồi và bản thân noãn cũng có khả năng chỉnh sửa các tổn thương trên DNA tinh trùng sau thụ tinh. Tuy nhiên, nếu DNA tổn thương nặng, phôi có thể phát triển bất thường hoặc ngưng phát triển. Nhiều nghiên cứu cho thấy nếu tổn thương DNA tinh trùng nhiều sẽ làm giảm khả năng thụ tinh, giảm tỉ lệ phôi phân chia và chất lượng phôi khi thực hiện thụ tinh trong ống nghiệm (TTTON). Tổn thương DNA do ROS còn gây tăng hiện tượng chết theo chương trình (apoptosis) của tinh trùng (Ford và cs, 2004).
2. VAI TRÒ CỦA CHẤT CHỐNG OXY HÓA ĐỐI VỚI CHẤT LƯỢNG TINH TRÙNG
2.1. Enzyme chống oxy hóa
Các bằng chứng hiện tại đã cho thấy ảnh hưởng tiêu cực của ROS lên chất lượng tinh trùng ở nam giới. Hệ thống chống oxy hóa bảo vệ trong tinh dịch được tạo thành từ cả các yếu tố enzyme và không enzyme có khả năng chống oxy hóa, tất cả đều tương tác chặt chẽ với nhau để đảm bảo khả năng bảo vệ tối ưu chống lại ROS. Dường như sự thiếu hụt bất kỳ chất nào trong số chúng đều có thể làm giảm tổng khả năng chống oxy hóa trong huyết tương. Hệ thống enzyme chống oxy hóa chính trong tinh dịch được gọi là bộ ba enzyme bao gồm superoxide dismutase (SOD), catalase (CAT) và glutathione peroxidase (GPX).
Họ SOD được chia thành ba lớp khác nhau tùy theo kim loại xúc tác có mặt tại vị trí hoạt động (Gałecka và cs, 2008). Trong tinh dịch, chức năng chống oxy hóa chủ yếu của SOD liên quan tới SOD-1 (75%) và SOD–3 (25%), có nguồn gốc chủ yếu từ tuyến tiền liệt. Do sự hiện diện của lượng glucose-6-phosphate dehydrogenase (G6PDH) cao hơn, như đã đề cập ở trên sẽ dẫn đến tăng superoxide. Hoạt động của SOD lúc này lại làm tăng H2O2 (ổn định, có thời gian bán hủy từ vài phút đến vài giờ), nguyên nhân tăng ROS trong tinh dịch (Peeker và cs, 1997).
Catalase có cấu trúc là một tetramer của 4 chuỗi polypeptide (mỗi monomer có khối lượng phân tử khoảng 60 kDa) và bốn nhân hem porphyrin (sắt) ở trung tâm giúp cho enzym chuyển hóa hydrogen peroxide, sản phẩm từ hoạt động của enzyme SOD. Xúc tác quá trình thủy phân hydro peroxide thành oxy phân tử và nước. Chức năng của CAT được kích hoạt khi H2O2 được khuyếch tán đến peroxisome, một sự kiện chỉ xảy ra khi có nồng độ cao của ROS này trong tế bào. Ngoài ra, catalase kích hoạt quá trình khả năng hóa tinh trùng gây ra bởi oxit nitric (NO), đây là một cơ chế phức tạp sử dụng hydro peroxide. Tuy nhiên các nghiên cứu gần đây cho thấy rằng CAT chỉ tồn tại một lượng rất nhỏ trong tinh trùng, điều này cho thấy cơ thể vẫn cần phải có các chất chống oxy hóa khác để bảo vệ tinh trùng khỏi ROS (Ścibior và cs, 2006).
Họ glutathione peroxidase (GPX) bao gồm 8 lớp, chia thành 2 nhóm chính: phụ thuộc vào Selen- (Se-) (GPX1 đến 4) và không phụ thuộc vào Se- (GPX5 đến 8), có sự khác biệt giữa các loài. Xúc tác cho phản ứng cần thiết để loại bỏ H2O2 và các hydroperoxide khác bằng cách sử dụng glutathione khử (GSH). Đối với tinh trùng sự hiện diện của selenoprotein phospholipid hydroperoxide GPX4 (còn được gọi là PHGPX), một protein cấu trúc cần thiết cho sự hình thành bình thường của vỏ ty thể và chiếm khoảng 50% hàm lượng protein trung gian của tinh trùng được định vị trong chuỗi xoắn của ty thể (Walczak-Jedrzejowska và cs, 2013).
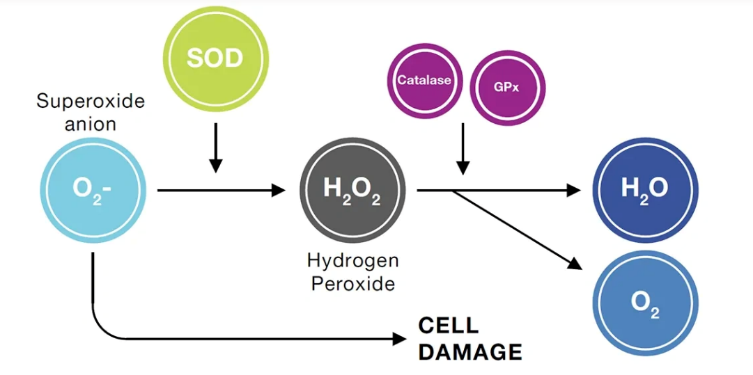
Hình 2. Hoạt động chống oxy hóa của các enzyme trong tinh dịch
2.2. Chất chống oxy hóa không thuộc nhóm enzyme
Bên cạnh việc loại bỏ các gốc tự do của chất chống oxy hóa thuộc nhóm enzyme, còn có một nhóm các chất chống oxy hóa có trọng lượng phân tử thấp – chất chống oxy hóa không thuộc nhóm enzyme cũng có vai trò quan trọng trong việc hỗ trợ cân bằng nồng độ gốc tự do trong cơ thể (Kowalczyk và cs, 2022). Các chất chống oxy hóa không enzyme cũng được chia thành chất chống oxy hóa trao đổi chất và chất chống oxy hóa chất dinh dưỡng. Các chất chống oxy hóa trao đổi chất thuộc các chất chống oxy hoá nội sinh, được tạo ra bởi sự trao đổi chất trong cơ thể, chẳng hạn như lipoic acid, glutathione, L-ariginine, coenzyme Q10, melatonin, acid uric, bilirubin, transferrin,… Trong khi các chất chống oxy hóa dinh dưỡng thuộc các chất chống oxy hóa ngoại sinh, là các hợp chất không thể sinh ra trong cơ thể và phải được cung cấp thông qua thực phẩm hoặc các chất bổ sung như vitamin E, vitamin C, carotenoids, nguyên tố kim loại vi lượng (selen, mangan, kẽm), flavonoid, omega- 3 và axit béo omega-6,…( Willcox và cs, 2004). Trong số đó, đã có một số chất được chứng minh là có vai trò quan trọng trong việc cải thiện chất lượng tinh trùng như Vitamin E, C, Carotenoid, Glutathione, Coenzyme Q10, …
Các chất chống oxy hóa sau khi được dung nạp thông qua đường tiêu hóa, sẽ đi vào máu và di chuyển đến các mô đích (Hình 3). Trong mô/cơ quan đích, các chất chống oxy hóa sẽ phản ứng với các gốc tự do để trung hòa chúng, giúp ngăn chặn tác động của ROS đến tế bào.
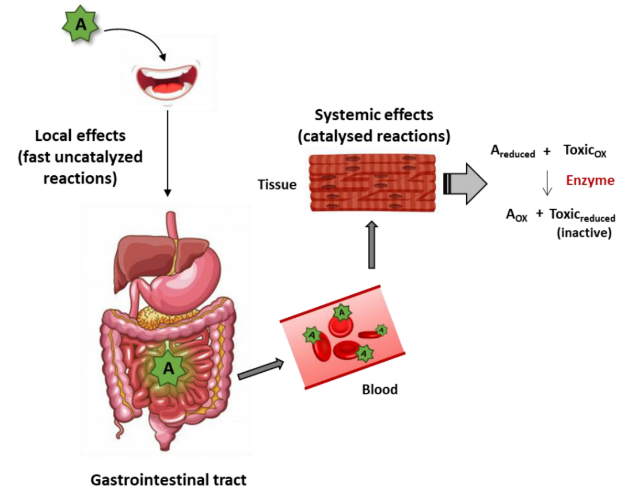
Hình 3. Con đường tác động của các chất chống oxy hóa sau khi dung nạp vào cơ thể
3. ỨNG DỤNG CHẤT CHỐNG OXY HÓA TRONG ĐIỀU TRỊ VÔ SINH NAM NHẰM CẢI THIỆN CHẤT LƯỢNG TINH TRÙNG
Việc sử dụng các chất chống oxy hóa ngoại sinh đã được khám phá trong nhiều thập kỷ và tác dụng của một số chất chống oxy hóa đối với khả năng sinh sản của nam giới đã được báo cáo rộng rãi. Ngay từ năm 1995, một nghiên cứu được thực hiện bởi Lewis và cộng sự cho rằng nồng độ các chất chống oxy hóa không enzyme khác nhau giữa những người nam giới có chức năng sinh sản bình thường và nam giới vô sinh, đặc biệt là sự khác biệt rõ rệt giữa nam giới có tinh trùng bình thường và nam giới có tinh trùng di động kém (asthenozoospermia). Tác giả cho rằng nồng độ các chất oxy hóa thấp có thể làm tăng ROS trong tinh dịch, do đó tinh trùng dễ bị tổn thương do ROS hơn so với bình thường (Lewis và cs, 1995). Trong số các chất chống oxy hóa không enzyme thì vitamin C được coi là chất có khả năng chống oxy hóa mạnh nhất và phổ biến nhất trong tinh dịch. Nhiều nghiên cứu cho thấy những trường hợp asthenozoospermia lại có nồng độ vitamin C trong tinh dịch thấp hơn và có nồng độ ROS cao hơn nhiều so với những người bình thường (Lewis và cs, 1997). Có thể thấy sự hiện diện của các chất chống oxy hóa trong tinh dịch có ảnh hưởng đến khả năng sinh sản của nam giới. Các chất chống oxy hóa như vitamin C, vitamin E, các nguyên tố vi lượng như kẽm, selen hay các enzyme chống oxy hóa là hàng rào phòng thủ đầu tiên chống lại tác động xấu của ROS đến tinh trùng (Gharagozloo và cs, 2011). Điều này chứng tỏ tầm quan trọng của việc loại bỏ gốc tự do giúp cải thiện khả năng sinh sản của nam giới. Tinh trùng được xem là tế bào nhạy cảm nhất trong cơ thể. Các tổn thương di truyền DNA với nhiều mức độ khác nhau có thể dẫn đến bất thường thụ tinh, bất thường phát triển phôi, sẩy thai, dị tật thai, suy giảm khả năng sinh sản của thế hệ sau. Các chất chống oxy hóa (antioxidant) có thể tác động làm sạch và loại trừ tác động của tăng các gốc tự do (hydroxyl, superoxide, hydroperoxyl, …) thông qua việc ức chế sự hình thành và đối kháng với các tác động của các gốc tự do, nhằm cải thiện chất lượng và số lượng tinh trùng, tăng khả năng có con của nam giới. Những thập kỷ gần đây, nhiều nghiên cứu về việc bổ sung kết hợp nhiều chất chống oxy hóa đã được chứng minh là có cải thiện chất lượng tinh trùng và tăng cơ hội có thai cho những trường hợp vô sinh do nam giới (Tremellen và cs, 2007).
3.1. Bằng chứng y văn về hiệu quả của ứng dụng chất chống oxy hóa trong điều trị vô sinh nam
Nhiều nghiên cứu đưa ra các yếu tố giúp cải thiện ROS trong tinh dịch như sử dụng một số chất chống oxy hóa tổng hợp hay tự nhiên như vitamin E, C, glutathione, … Nghiên cứu của Markus Lipovac thực hiện trên 67 bệnh nhân nam bất thường về tinh dịch đồ trong thời gian 2007-2010 tại Trung tâm Hiếm muộn tại Viena (Áo). Tất cả bệnh nhân này được điều trị với hợp chất chống oxy hóa (L-Carnitin, L-Arginin, Coenzyme Q10, Vitamin E, Zinc, Folic acid, Glutathione, Selenium) liên tục trong ba tháng. Kết quả xét nghiệm trước khi điều trị của các bệnh nhân cho thấy chỉ số phân mảnh DNA của tinh trùng cao bất thường, đây có thể là nguyên nhân vô sinh nam ở các bệnh nhân này. Khi điều trị với các chất chống oxy hóa thì chỉ số phân mảnh DNA của tinh trùng được cải thiện, giúp 74,6% bệnh nhân ở nhóm điều trị đã đạt được sự toàn vẹn DNA tinh trùng, chỉ số gắn kết hyalunan tăng 19,7% và tăng tỷ lệ hình thái học bình thường của tinh trùng (Lipovax và cs, 2014).
Showell và cộng sự tổng kết trong thư viện dữ liệu Cochrane với 34 thử nghiệm lâm sàng với 2.876 cặp vợ chồng thụ tinh ống nghiệm – người chồng được bổ sung các chất chống oxy hóa. Đánh giá kết quả với tỷ lệ trẻ sinh sống, tỷ lệ đậu thai, tỷ lệ sẩy thai, cải thiện các chỉ số về tinh trùng (chỉ số phân mảnh tinh trùng, mật độ tinh trùng, hình thái, di động của tinh trùng) đồng thời ghi nhận các tác dụng có hại của thuốc. Tác giả nhận định tỉ lệ có thai - trẻ sinh sống cải thiện có ý nghĩa thống kê khi thực hiện kỹ thuật thụ tinh ống nghiệm nếu người chồng được bổ sung các chất chống oxy hóa.
Safa và cộng sự thực hiện trên 50 nam giới vô sinh oligospermic và asthenospermic. Mẫu tinh dịch được thu nhận để phân tích trước khi nghiên cứu bắt đầu. Sau đó, các bệnh nhân được nhận 30 mg coenzyme Q10, 8 mg kẽm, 100 mg vitamin C, 12 mg vitamin E, 400 mg acid folic để sử dụng trong 3 tháng, sử dụng hàng ngày (mỗi ngày một lần) và 200 mg selen mỗi ngày sau bữa ăn trưa. Sau 3 tháng, một mẫu tinh dịch được thu nhận từ bệnh nhân để phân tích. Sau đó, các thông số tinh trùng được so sánh giữa trước và sau khi sử dụng chất chống oxy hóa. So sánh kết quả trước và sau khi bổ sung các hợp chất cho thấy tất cả các thông số tinh dịch đồ bao gồm thể tích, hình dạng, chuyển động, số lượng và độ di động tiến tới đều gia tăng đáng kể sau điều trị. Hơn nữa, độ pH và mật độ của tinh dịch cũng cải thiện đáng kể.
Hiện tại có rất nhiều nghiên cứu chứng minh tính hiệu quả của các chất chống oxy hóa trong điều trị vô sinh nam, tuy nhiên cần thêm nghiên cứu với cỡ mẫu lớn, đa trung tâm, nghiên cứu mù đôi, ngẫu nhiên trên nhiều đối tượng với những tiêu chí khác nhau về tinh dịch đồ cũng như các chỉ số có thai, tỉ lệ sinh sống… để tăng độ tin cậy trong việc sử dụng chất chống oxy hóa ở bệnh nhân vô sinh nam.
3.2. Khó khăn, cơ hội và thách thức của việc sử dụng chất chống oxy hóa trong điều trị vô sinh nam
Nhiều kết quả từ nhiều nghiên cứu trước đây cho thấy các chế phẩm chống oxy hóa có tác dụng cải thiện các thông số tinh dịch đồ ở nam giới hiếm muộn. Tuy nhiên, đặc điểm chung của các nghiên cứu này là cỡ mẫu nhỏ, sự không đồng nhất ở các nhóm bệnh nhân nghiên cứu, sự đa dạng của các loại chế phẩm chống oxy hóa, và các kết cục không liên quan đến lâm sàng. Thực tế này đòi hỏi cần có 1 nghiên cứu được thiết kế một cách chặt chẽ nhằm thu hẹp các khoảng cách về kiến thức và mang đến chứng cứ y học mạnh hơn về vấn đề này.
Agarwar và cộng sự (2021) thực hiện nghiên cứu phân tích tổng hợp với 1978 bài báo về sử dụng chất oxy hóa trong điều trị vô sinh nam. Dựa vào phân tích thống kê, có hơn 89,6% các nghiên cứu chất lượng thấp cho thấy sự cải thiện đáng kể về thông số tinh trùng ở nam giới vô sinh sau khi điều trị bằng chất chống oxy hóa, trong khi tỉ lệ này chỉ khoảng 58,3% ở các nghiên cứu có chất lượng cao. Tuy nhiên những kết quả này không có ý nghĩa do có một số lượng nhỏ các nghiên cứu báo cáo các thông số tinh dịch (n=20) và những nghiên cứu báo cáo chức năng tinh trùng (n=12) dẫn đến việc phân tích thống kê còn hạn chế. Nghiên cứu còn phân tích SWOT (strength weakness opportunity threat) để đánh giá tiềm năng của ứng dụng chất chống oxy hóa trong điều trị vô sinh nam:
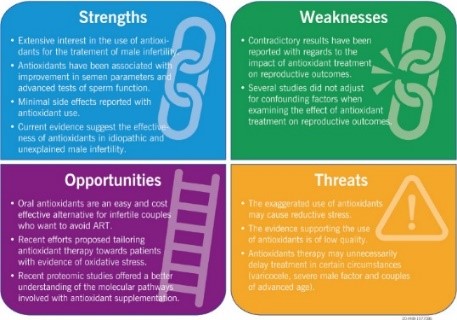
Hình 4. Phân tích SWOT trong việc sử dụng chất chống oxy hóa trong điều trị vô sinh nam
4. KẾT LUẬN
Trong 25 năm qua, đã có nhiều nghiên cứu thực nghiệm và lâm sàng về bệnh lý của ROS và tác động của nó đến chức năng tinh trùng, ảnh hưởng đến khả năng sinh sản ở nam giới. ROS tác động đến chức năng tinh trùng, gây tổn thương cấu trúc DNA và thúc đẩy quá trình apoptosis, dẫn đến giảm tỷ lệ thụ tinh hoặc phôi không có tiềm năng phát triển. Đã có nhiều nghiên cứu in vitro và in vivo chứng minh lợi ích của những chất chống oxy hóa đối với chức năng tinh trùng, giúp cải thiện tỉ lệ thai và kết quả lâm sàng.
Tuy nhiên, vẫn còn ít nghiên cứu có chất lượng cao để khẳng định hiệu quả của các chất chống oxy hóa đối với tinh trùng. Một vấn đề đáng quan tâm khác là liều lượng phù hợp của các chất chống oxy hóa. Có vẻ như trong trường hợp điều trị vô sinh do ROS, liều lượng chất chống oxy hóa nên cao hơn thông thường và nên được sử dụng ít nhất ba tháng dựa vào đặc điểm của quá trình sinh tinh kéo dài từ 68 đến 76 ngày, dẫn đến sự không thống nhất giữa các nghiên cứu. Việc xác định liều lượng cần được nghiên cứu thêm để cung cấp thêm nhiều bằng chứng khẳng định việc sử dụng chất chống oxy hoá trong ứng dụng tiềm năng trong điều trị vô sinh nam giới.
2. Soraggi, S., et al., Evaluating genetic causes of azoospermia: What can we learn from a complex cellular structure and single-cell transcriptomics of the human testis? Human Genetics, 2021. 140(1): p. 183-201.
3. Athayde, K.S., et al., Development of normal reference values for seminal reactive oxygen species and their correlation with leukocytes and semen parameters in a fertile population. Journal of andrology, 2007. 28(4): p. 613-620.
4. Mehra, B.L., et al., Male infertility rate: a retrospective study. Urologia journal, 2018. 85(1): p. 22-24.
5. Wagner, H., J.W. Cheng, and E.Y. Ko, Role of reactive oxygen species in male infertility: An updated review of literature. Arab journal of urology, 2018. 16(1): p. 35-43.
6. Du Plessis, S.S., et al., Physiological roles of reactive oxygen species (ROS) in the reproductive system. Oxidative Stress in Human Reproduction: Shedding Light on a Complicated Phenomenon, 2017: p. 47-64.
7. Ford, W.J.H.r.u., Regulation of sperm function by reactive oxygen species. 2004. 10(5): p. 387-399.
8. Geva, E., et al., The effect of antioxidant treatment on human spermatozoa and fertilization rate in an in vitro fertilization program. 1996. 66(3): p. 430-434.
9. Agarwal, A., et al., Utility of antioxidants in the treatment of male infertility: clinical guidelines based on a systematic review and analysis of evidence. 2021. 39(2): p. 233.
10. Lewis, S.E., et al., Total antioxidant capacity of seminal plasma is different in fertile and infertile men. 1995. 64(4): p. 868-870.
11. Lewis, S.E., et al., Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men. 1997. 67(1): p. 142-147.
12. Gharagozloo, P. and R.J.J.H.r. Aitken, The role of sperm oxidative stress in male infertility and the significance of oral antioxidant therapy. 2011. 26(7): p. 1628-1640.
13. Ross, C., et al., A systematic review of the effect of oral antioxidants on male infertility. 2010. 20(6): p. 711-723.
14. Steiner, A., et al., Antioxidants in the treatment of male factor infertility: Results from the double blind, multi-center, randomized controlled Males, Antioxidants, and Infertility (MOXI) trial. 2018. 33: p. i30.
IVFMD Tân Bình
1. TỔNG QUAN VỀ VÔ SINH Ở NAM GIỚI
Vô sinh được định nghĩa là tình trạng một cặp vợ chồng không có thai sau 1 năm chung sống, giao hợp bình thường, không sử dụng các biện pháp tránh thai nào. Theo đánh giá, vô sinh ảnh hưởng tới khoảng 15% dân số trên thế giới và có xu hướng tăng mỗi năm (Louis và cs, 2013). Trước đây, vào những năm thập niên 90 người ta cho rằng các nguyên nhân gây nên vô sinh chủ yếu đến từ nữ giới, nhưng hiện nay các bằng chứng đã cho thấy nguyên nhân từ nam giới chiếm khoảng 20-30% số trường hợp vô sinh (Athayde và cs, 2007). Vì lý do này, những nghiên cứu về vô sinh nam đã được phát triển nhằm mục đích tìm hiểu nguyên nhân và phát triển hướng điều trị phù hợp. Các bằng chứng hiện tại đã chỉ ra một số dấu ấn sinh học để giải thích cho tình trạng vô sinh ở nam giới như các gen chịu trách nhiệm cho quá trình sinh tinh, các vấn đề về giải phẫu, nội tiết, … Ngoài ra, lớn tuổi, ô nhiễm môi trường, giảm cân, stress và béo phì cũng có thể là các nguyên nhân làm giảm chất lượng tinh trùng (Louis và cs, 2013). Rất khó để xác định tỷ lệ chính xác trong vô sinh ở nam giới, nhưng hầu hết cho dù là nguyên nhân gì, sự gia tăng các gốc oxy hóa tự do (Reactive oxygen species – ROS) thường được quan sát thấy. Sự dư thừa này có thể dẫn đến mất cân bằng với các chất chống oxy hóa và khi đạt đến mức bệnh lý có thể gây ra các vấn đề về khả năng sinh sản (Bui và cs, 2018). Vô sinh nam do stress oxy hóa đã được đưa vào nghiên cứu trong nhiều năm gần đây giúp cải thiện kết quả lâm sàng ở bệnh nhân.
1.1. Vai trò của gốc oxy hóa tự do (Reactive oxygen species – ROS) đối với chất lượng tinh trùng
Ở điều kiện sinh lý, nồng độ nhất định ROS có nhiều vai trò với tế bào như điều hòa quá trình apoptosis, tham gia vào quá trình viêm nhiễm, kích hoạt các gen mã hóa enzyme chống oxy hóa. Còn đối với tinh trùng, ROS là con đường thông tin thứ cấp và có những vai trò đặc biệt khác. Sau khi được giải phóng khỏi tinh hoàn, tinh trùng trưởng thành di chuyển qua mào tinh và trải qua các quá trình hoạt hóa phức tạp và liên quan đến thay đổi ion, trao đổi chất, việc sản xuất ROS ở nồng độ thấp. Trong quá trình di chuyển qua mào tinh, ROS có vai trò kích hoạt con đường cyclic adenosine monophosphate (cAMP) ở tinh trùng, thúc đẩy phosphoryl hóa tyrosine bằng cách ức chế tyrosine phosphatase. Cơ chế phân tử này giúp tinh trùng kích hoạt các yếu tố phiên mã liên quan tới các tầng tín hiệu nội bào của tinh trùng (Wagner và cs, 2018). Các nghiên cứu cho thấy ROS có vai trò quan trọng giúp quá trình khả năng hóa, tăng động, di động ở tinh trùng hiệu quả hơn. Hơn thế nữa, chúng hoạt hóa, cho phép tinh trùng liên kết với zona pellucida bao quanh noãn và tạo ra phản ứng acrosome. Do đó, tinh trùng có thể xâm nhập, tiếp cận và hợp nhất với noãn (Du và cs, 2017) (Hình 1).

Hình 1. Vai trò của ROS đối với chất lượng tinh trùng
1.2. Nguyên nhân gây mất cân bằng ROS ảnh hưởng đến chất lượng tinh trùng
1.2.1. Yếu tố nội tại tinh hoàn
Các gốc oxy hóa nội sinh có thể được tạo ra như một sản phẩm của quá trình chuyển hóa hoặc hoạt động của enzyme. Cụ thể, hoạt động của ty thể - nằm ở vùng cổ của tinh trùng – kết hợp với quá trình đường phân (glycolysis) cần thiết cho sự di động và khả năng hóa tinh trùng. Năng lượng ATP được tạo ra từ ty thể thông qua phức hợp V (ATP synthase), tuy nhiên các sản phẩm phụ trong quá trình này chủ yếu giải phóng các gốc superoxide (O2•) và hydroxyl (•OH) từ chuỗi truyền điện tử. Các gốc tự do này sau đó được chuyển đổi thành hydro peroxide (H2O2) bởi superoxide dismutase (SOD) (Griveau và cs, 1997). Trong quá trình sinh tinh, một số tinh trùng khiếm khuyết trong quá trình phát triển làm cho tinh trùng vẫn giữ lại phần bào tương cổ hay nói cách khác là tinh trùng chưa trưởng thành. Vùng bào tương này chứa glucose-6-phosphate dehydrogenase (G6PDH) sản xuất β-nicotinamide adenine dinucleotide phosphate (NADPH). NADPH nội bào này sẽ được NADPH oxidase chuyển hóa thành NADP+ và H+. Kết quả của quá trình này là tạo ra electron và proton, electron sau đó được vận chuyển xuyên màng kết hợp với O2 để tạo ion superoxide (Said và cs, 2004). Có thể thấy tinh trùng là một nguồn tạo ra ROS trong tinh dịch, khi tinh trùng chết đi nguồn ROS này sẽ được giải phóng. Trong tinh dịch, tỷ lệ tinh trùng chết tồn tại càng nhiều thì nồng độ ROS sẽ tăng lên, gây ảnh hưởng tới tinh trùng bình thường xung quanh.
1.2.2. Nguồn ROS ngoại sinh
Bên cạnh nguồn ROS nội sinh tại tinh hoàn, ROS còn được tạo ra thông qua một số bệnh lý. Các nghiên cứu về giãn tĩnh mạch thừng tinh cho thấy ở những đối tượng này ROS được tăng lên đáng kể. Giãn tĩnh mạch thừng tinh là tình trạng giãn nở bất thường của đám rối tĩnh mạch nằm trong thừng tinh, tỷ lệ nam giới vô sinh mắc bệnh này khoảng 35-44%, con số này tăng lên tới 45-81% trong trường hợp vô sinh thứ phát (Jensen và cs, 2017). Sự giãn nở tĩnh mạch nhưng kích thước van tĩnh mạch không đổi sẽ gây trào ngược máu và tăng áp lực máu lên thành mạch. Nhiệt độ bình thường của tinh hoàn thường thấp hơn nhiệt độ của cơ thể khoảng 2oC, nhưng trong trường hợp này nhiệt độ bìu tăng dẫn đến sự gia tăng các gốc oxy hóa tự do và mất khả năng chống oxy hóa tạo stress oxy hóa tại tinh hoàn. Sự gia tăng nồng độ ROS cũng được nhận thấy ở bệnh nhân thừa cân – béo phì, do sự gia tăng của các phản ứng viêm trong cơ thể bệnh nhân (Krzysciak và cs, 2011).
Bạch cầu là một nguồn quan trọng của stress oxy hóa, và người ta đã mô tả rằng một bạch cầu tạo ra ROS nhiều hơn 1000 lần so với một tinh trùng đơn lẻ, thông qua việc tăng sản xuất NADPH. Sự gia tăng số lượng bạch cầu thường do nhiễm trùng, cơ thể đáp ứng miễn dịch, thúc đẩy sự xâm nhập của bạch cầu để loại bỏ vùng viêm nhiễm. Nhiều nghiên cứu đã đưa ra các bằng chứng bạch cầu là yếu tố kích thích sản xuất ROS, làm thay đổi nồng độ, khả năng di động và hình thái tinh trùng so với bệnh nhân khỏe mạnh. Các thí nghiệm in vitro cũng cho kết quả tương tự khi ủ tinh trùng với bạch cầu (Saleh và cs, 2002; lobascio và cs, 2015).
Ngoài ra, sự gia tăng ROS có thể do nhiều nguyên nhân: nhiệt độ, môi trường sống, từ trường, phóng xạ, ô nhiễm, thuốc trừ sâu, rượu, thuốc lá, căng thẳng tinh thần, béo phì, chế độ ăn không hợp lý, nhiễm trùng, miễn dịch và các bệnh mãn tính… Việc tạo ra ROS còn có thể kích hoạt quá trình apoptosis ở các tế bào tinh trùng cũng như hủy hoại các protein trên bề mặt của tinh trùng từ đó tạo ra các tinh trùng dị dạng (Tvrdá và cs, 2022; Silva và cs, 2017).
1.3. Ảnh hưởng của ROS lên khả năng sinh sản ở nam giới
Mặc dù ROS có vai trò nhất định, tuy nhiên, nếu nồng độ ROS tạo ra không được kiểm soát hoặc quá mức có thể ảnh hưởng đến chức năng của tinh trùng do stress oxy hóa (oxidative stress – OS) trở thành tác nhân quan trọng liên quan đến nguyên nhân gây vô sinh ở nam giới. Những người đàn ông vô sinh có biểu hiện nồng độ ROS cao hơn và khả năng chống oxy hóa thấp hơn đáng kể so với nam giới bình thường. Khoảng 25 - 40% mẫu tinh dịch ở nam giới vô sinh có nồng độ ROS cao (De Lamirande và cs, 1995). Một số nghiên cứu đã chứng minh sự cảm ứng quá trình peroxid hóa màng tế bào hay sự phân mảnh DNA tinh trùng là hai hậu quả chính gây ra bởi sự tạo ROS quá mức trong quá trình phát triển của tinh trùng. Tinh trùng là tế bào nhỏ nhất trong cơ thể, chứa hàm lượng lớn các acid béo không bão hòa nên làm cho màng tinh trùng lỏng lẻo, dễ nhạy cảm với ROS. DNA tinh trùng được bao bọc bởi các protein bảo vệ, đặc biệt là các chất chống oxi hóa (antioxidants) trong tinh dịch. ROS nồng độ cao có thể phá vỡ các cơ chế bảo vệ này và gây tổn thương DNA tinh trùng. ROS làm đứt gãy các chuỗi DNA đơn và kép, gây đột biến gen. Nếu tổn thương DNA nhẹ, tinh trùng có thể tự phục hồi và bản thân noãn cũng có khả năng chỉnh sửa các tổn thương trên DNA tinh trùng sau thụ tinh. Tuy nhiên, nếu DNA tổn thương nặng, phôi có thể phát triển bất thường hoặc ngưng phát triển. Nhiều nghiên cứu cho thấy nếu tổn thương DNA tinh trùng nhiều sẽ làm giảm khả năng thụ tinh, giảm tỉ lệ phôi phân chia và chất lượng phôi khi thực hiện thụ tinh trong ống nghiệm (TTTON). Tổn thương DNA do ROS còn gây tăng hiện tượng chết theo chương trình (apoptosis) của tinh trùng (Ford và cs, 2004).
2. VAI TRÒ CỦA CHẤT CHỐNG OXY HÓA ĐỐI VỚI CHẤT LƯỢNG TINH TRÙNG
2.1. Enzyme chống oxy hóa
Các bằng chứng hiện tại đã cho thấy ảnh hưởng tiêu cực của ROS lên chất lượng tinh trùng ở nam giới. Hệ thống chống oxy hóa bảo vệ trong tinh dịch được tạo thành từ cả các yếu tố enzyme và không enzyme có khả năng chống oxy hóa, tất cả đều tương tác chặt chẽ với nhau để đảm bảo khả năng bảo vệ tối ưu chống lại ROS. Dường như sự thiếu hụt bất kỳ chất nào trong số chúng đều có thể làm giảm tổng khả năng chống oxy hóa trong huyết tương. Hệ thống enzyme chống oxy hóa chính trong tinh dịch được gọi là bộ ba enzyme bao gồm superoxide dismutase (SOD), catalase (CAT) và glutathione peroxidase (GPX).
Họ SOD được chia thành ba lớp khác nhau tùy theo kim loại xúc tác có mặt tại vị trí hoạt động (Gałecka và cs, 2008). Trong tinh dịch, chức năng chống oxy hóa chủ yếu của SOD liên quan tới SOD-1 (75%) và SOD–3 (25%), có nguồn gốc chủ yếu từ tuyến tiền liệt. Do sự hiện diện của lượng glucose-6-phosphate dehydrogenase (G6PDH) cao hơn, như đã đề cập ở trên sẽ dẫn đến tăng superoxide. Hoạt động của SOD lúc này lại làm tăng H2O2 (ổn định, có thời gian bán hủy từ vài phút đến vài giờ), nguyên nhân tăng ROS trong tinh dịch (Peeker và cs, 1997).
Catalase có cấu trúc là một tetramer của 4 chuỗi polypeptide (mỗi monomer có khối lượng phân tử khoảng 60 kDa) và bốn nhân hem porphyrin (sắt) ở trung tâm giúp cho enzym chuyển hóa hydrogen peroxide, sản phẩm từ hoạt động của enzyme SOD. Xúc tác quá trình thủy phân hydro peroxide thành oxy phân tử và nước. Chức năng của CAT được kích hoạt khi H2O2 được khuyếch tán đến peroxisome, một sự kiện chỉ xảy ra khi có nồng độ cao của ROS này trong tế bào. Ngoài ra, catalase kích hoạt quá trình khả năng hóa tinh trùng gây ra bởi oxit nitric (NO), đây là một cơ chế phức tạp sử dụng hydro peroxide. Tuy nhiên các nghiên cứu gần đây cho thấy rằng CAT chỉ tồn tại một lượng rất nhỏ trong tinh trùng, điều này cho thấy cơ thể vẫn cần phải có các chất chống oxy hóa khác để bảo vệ tinh trùng khỏi ROS (Ścibior và cs, 2006).
Họ glutathione peroxidase (GPX) bao gồm 8 lớp, chia thành 2 nhóm chính: phụ thuộc vào Selen- (Se-) (GPX1 đến 4) và không phụ thuộc vào Se- (GPX5 đến 8), có sự khác biệt giữa các loài. Xúc tác cho phản ứng cần thiết để loại bỏ H2O2 và các hydroperoxide khác bằng cách sử dụng glutathione khử (GSH). Đối với tinh trùng sự hiện diện của selenoprotein phospholipid hydroperoxide GPX4 (còn được gọi là PHGPX), một protein cấu trúc cần thiết cho sự hình thành bình thường của vỏ ty thể và chiếm khoảng 50% hàm lượng protein trung gian của tinh trùng được định vị trong chuỗi xoắn của ty thể (Walczak-Jedrzejowska và cs, 2013).

Hình 2. Hoạt động chống oxy hóa của các enzyme trong tinh dịch
2.2. Chất chống oxy hóa không thuộc nhóm enzyme
Bên cạnh việc loại bỏ các gốc tự do của chất chống oxy hóa thuộc nhóm enzyme, còn có một nhóm các chất chống oxy hóa có trọng lượng phân tử thấp – chất chống oxy hóa không thuộc nhóm enzyme cũng có vai trò quan trọng trong việc hỗ trợ cân bằng nồng độ gốc tự do trong cơ thể (Kowalczyk và cs, 2022). Các chất chống oxy hóa không enzyme cũng được chia thành chất chống oxy hóa trao đổi chất và chất chống oxy hóa chất dinh dưỡng. Các chất chống oxy hóa trao đổi chất thuộc các chất chống oxy hoá nội sinh, được tạo ra bởi sự trao đổi chất trong cơ thể, chẳng hạn như lipoic acid, glutathione, L-ariginine, coenzyme Q10, melatonin, acid uric, bilirubin, transferrin,… Trong khi các chất chống oxy hóa dinh dưỡng thuộc các chất chống oxy hóa ngoại sinh, là các hợp chất không thể sinh ra trong cơ thể và phải được cung cấp thông qua thực phẩm hoặc các chất bổ sung như vitamin E, vitamin C, carotenoids, nguyên tố kim loại vi lượng (selen, mangan, kẽm), flavonoid, omega- 3 và axit béo omega-6,…( Willcox và cs, 2004). Trong số đó, đã có một số chất được chứng minh là có vai trò quan trọng trong việc cải thiện chất lượng tinh trùng như Vitamin E, C, Carotenoid, Glutathione, Coenzyme Q10, …
Các chất chống oxy hóa sau khi được dung nạp thông qua đường tiêu hóa, sẽ đi vào máu và di chuyển đến các mô đích (Hình 3). Trong mô/cơ quan đích, các chất chống oxy hóa sẽ phản ứng với các gốc tự do để trung hòa chúng, giúp ngăn chặn tác động của ROS đến tế bào.

Hình 3. Con đường tác động của các chất chống oxy hóa sau khi dung nạp vào cơ thể
3. ỨNG DỤNG CHẤT CHỐNG OXY HÓA TRONG ĐIỀU TRỊ VÔ SINH NAM NHẰM CẢI THIỆN CHẤT LƯỢNG TINH TRÙNG
Việc sử dụng các chất chống oxy hóa ngoại sinh đã được khám phá trong nhiều thập kỷ và tác dụng của một số chất chống oxy hóa đối với khả năng sinh sản của nam giới đã được báo cáo rộng rãi. Ngay từ năm 1995, một nghiên cứu được thực hiện bởi Lewis và cộng sự cho rằng nồng độ các chất chống oxy hóa không enzyme khác nhau giữa những người nam giới có chức năng sinh sản bình thường và nam giới vô sinh, đặc biệt là sự khác biệt rõ rệt giữa nam giới có tinh trùng bình thường và nam giới có tinh trùng di động kém (asthenozoospermia). Tác giả cho rằng nồng độ các chất oxy hóa thấp có thể làm tăng ROS trong tinh dịch, do đó tinh trùng dễ bị tổn thương do ROS hơn so với bình thường (Lewis và cs, 1995). Trong số các chất chống oxy hóa không enzyme thì vitamin C được coi là chất có khả năng chống oxy hóa mạnh nhất và phổ biến nhất trong tinh dịch. Nhiều nghiên cứu cho thấy những trường hợp asthenozoospermia lại có nồng độ vitamin C trong tinh dịch thấp hơn và có nồng độ ROS cao hơn nhiều so với những người bình thường (Lewis và cs, 1997). Có thể thấy sự hiện diện của các chất chống oxy hóa trong tinh dịch có ảnh hưởng đến khả năng sinh sản của nam giới. Các chất chống oxy hóa như vitamin C, vitamin E, các nguyên tố vi lượng như kẽm, selen hay các enzyme chống oxy hóa là hàng rào phòng thủ đầu tiên chống lại tác động xấu của ROS đến tinh trùng (Gharagozloo và cs, 2011). Điều này chứng tỏ tầm quan trọng của việc loại bỏ gốc tự do giúp cải thiện khả năng sinh sản của nam giới. Tinh trùng được xem là tế bào nhạy cảm nhất trong cơ thể. Các tổn thương di truyền DNA với nhiều mức độ khác nhau có thể dẫn đến bất thường thụ tinh, bất thường phát triển phôi, sẩy thai, dị tật thai, suy giảm khả năng sinh sản của thế hệ sau. Các chất chống oxy hóa (antioxidant) có thể tác động làm sạch và loại trừ tác động của tăng các gốc tự do (hydroxyl, superoxide, hydroperoxyl, …) thông qua việc ức chế sự hình thành và đối kháng với các tác động của các gốc tự do, nhằm cải thiện chất lượng và số lượng tinh trùng, tăng khả năng có con của nam giới. Những thập kỷ gần đây, nhiều nghiên cứu về việc bổ sung kết hợp nhiều chất chống oxy hóa đã được chứng minh là có cải thiện chất lượng tinh trùng và tăng cơ hội có thai cho những trường hợp vô sinh do nam giới (Tremellen và cs, 2007).
3.1. Bằng chứng y văn về hiệu quả của ứng dụng chất chống oxy hóa trong điều trị vô sinh nam
Nhiều nghiên cứu đưa ra các yếu tố giúp cải thiện ROS trong tinh dịch như sử dụng một số chất chống oxy hóa tổng hợp hay tự nhiên như vitamin E, C, glutathione, … Nghiên cứu của Markus Lipovac thực hiện trên 67 bệnh nhân nam bất thường về tinh dịch đồ trong thời gian 2007-2010 tại Trung tâm Hiếm muộn tại Viena (Áo). Tất cả bệnh nhân này được điều trị với hợp chất chống oxy hóa (L-Carnitin, L-Arginin, Coenzyme Q10, Vitamin E, Zinc, Folic acid, Glutathione, Selenium) liên tục trong ba tháng. Kết quả xét nghiệm trước khi điều trị của các bệnh nhân cho thấy chỉ số phân mảnh DNA của tinh trùng cao bất thường, đây có thể là nguyên nhân vô sinh nam ở các bệnh nhân này. Khi điều trị với các chất chống oxy hóa thì chỉ số phân mảnh DNA của tinh trùng được cải thiện, giúp 74,6% bệnh nhân ở nhóm điều trị đã đạt được sự toàn vẹn DNA tinh trùng, chỉ số gắn kết hyalunan tăng 19,7% và tăng tỷ lệ hình thái học bình thường của tinh trùng (Lipovax và cs, 2014).
Showell và cộng sự tổng kết trong thư viện dữ liệu Cochrane với 34 thử nghiệm lâm sàng với 2.876 cặp vợ chồng thụ tinh ống nghiệm – người chồng được bổ sung các chất chống oxy hóa. Đánh giá kết quả với tỷ lệ trẻ sinh sống, tỷ lệ đậu thai, tỷ lệ sẩy thai, cải thiện các chỉ số về tinh trùng (chỉ số phân mảnh tinh trùng, mật độ tinh trùng, hình thái, di động của tinh trùng) đồng thời ghi nhận các tác dụng có hại của thuốc. Tác giả nhận định tỉ lệ có thai - trẻ sinh sống cải thiện có ý nghĩa thống kê khi thực hiện kỹ thuật thụ tinh ống nghiệm nếu người chồng được bổ sung các chất chống oxy hóa.
Safa và cộng sự thực hiện trên 50 nam giới vô sinh oligospermic và asthenospermic. Mẫu tinh dịch được thu nhận để phân tích trước khi nghiên cứu bắt đầu. Sau đó, các bệnh nhân được nhận 30 mg coenzyme Q10, 8 mg kẽm, 100 mg vitamin C, 12 mg vitamin E, 400 mg acid folic để sử dụng trong 3 tháng, sử dụng hàng ngày (mỗi ngày một lần) và 200 mg selen mỗi ngày sau bữa ăn trưa. Sau 3 tháng, một mẫu tinh dịch được thu nhận từ bệnh nhân để phân tích. Sau đó, các thông số tinh trùng được so sánh giữa trước và sau khi sử dụng chất chống oxy hóa. So sánh kết quả trước và sau khi bổ sung các hợp chất cho thấy tất cả các thông số tinh dịch đồ bao gồm thể tích, hình dạng, chuyển động, số lượng và độ di động tiến tới đều gia tăng đáng kể sau điều trị. Hơn nữa, độ pH và mật độ của tinh dịch cũng cải thiện đáng kể.
Hiện tại có rất nhiều nghiên cứu chứng minh tính hiệu quả của các chất chống oxy hóa trong điều trị vô sinh nam, tuy nhiên cần thêm nghiên cứu với cỡ mẫu lớn, đa trung tâm, nghiên cứu mù đôi, ngẫu nhiên trên nhiều đối tượng với những tiêu chí khác nhau về tinh dịch đồ cũng như các chỉ số có thai, tỉ lệ sinh sống… để tăng độ tin cậy trong việc sử dụng chất chống oxy hóa ở bệnh nhân vô sinh nam.
3.2. Khó khăn, cơ hội và thách thức của việc sử dụng chất chống oxy hóa trong điều trị vô sinh nam
Nhiều kết quả từ nhiều nghiên cứu trước đây cho thấy các chế phẩm chống oxy hóa có tác dụng cải thiện các thông số tinh dịch đồ ở nam giới hiếm muộn. Tuy nhiên, đặc điểm chung của các nghiên cứu này là cỡ mẫu nhỏ, sự không đồng nhất ở các nhóm bệnh nhân nghiên cứu, sự đa dạng của các loại chế phẩm chống oxy hóa, và các kết cục không liên quan đến lâm sàng. Thực tế này đòi hỏi cần có 1 nghiên cứu được thiết kế một cách chặt chẽ nhằm thu hẹp các khoảng cách về kiến thức và mang đến chứng cứ y học mạnh hơn về vấn đề này.
Agarwar và cộng sự (2021) thực hiện nghiên cứu phân tích tổng hợp với 1978 bài báo về sử dụng chất oxy hóa trong điều trị vô sinh nam. Dựa vào phân tích thống kê, có hơn 89,6% các nghiên cứu chất lượng thấp cho thấy sự cải thiện đáng kể về thông số tinh trùng ở nam giới vô sinh sau khi điều trị bằng chất chống oxy hóa, trong khi tỉ lệ này chỉ khoảng 58,3% ở các nghiên cứu có chất lượng cao. Tuy nhiên những kết quả này không có ý nghĩa do có một số lượng nhỏ các nghiên cứu báo cáo các thông số tinh dịch (n=20) và những nghiên cứu báo cáo chức năng tinh trùng (n=12) dẫn đến việc phân tích thống kê còn hạn chế. Nghiên cứu còn phân tích SWOT (strength weakness opportunity threat) để đánh giá tiềm năng của ứng dụng chất chống oxy hóa trong điều trị vô sinh nam:

Hình 4. Phân tích SWOT trong việc sử dụng chất chống oxy hóa trong điều trị vô sinh nam
- Điểm mạnh (Strength)
- Điểm yếu (Weakness)
- Cơ hội (Opportunity)
- Thách thức – khó khăn (Threats)
4. KẾT LUẬN
Trong 25 năm qua, đã có nhiều nghiên cứu thực nghiệm và lâm sàng về bệnh lý của ROS và tác động của nó đến chức năng tinh trùng, ảnh hưởng đến khả năng sinh sản ở nam giới. ROS tác động đến chức năng tinh trùng, gây tổn thương cấu trúc DNA và thúc đẩy quá trình apoptosis, dẫn đến giảm tỷ lệ thụ tinh hoặc phôi không có tiềm năng phát triển. Đã có nhiều nghiên cứu in vitro và in vivo chứng minh lợi ích của những chất chống oxy hóa đối với chức năng tinh trùng, giúp cải thiện tỉ lệ thai và kết quả lâm sàng.
Tuy nhiên, vẫn còn ít nghiên cứu có chất lượng cao để khẳng định hiệu quả của các chất chống oxy hóa đối với tinh trùng. Một vấn đề đáng quan tâm khác là liều lượng phù hợp của các chất chống oxy hóa. Có vẻ như trong trường hợp điều trị vô sinh do ROS, liều lượng chất chống oxy hóa nên cao hơn thông thường và nên được sử dụng ít nhất ba tháng dựa vào đặc điểm của quá trình sinh tinh kéo dài từ 68 đến 76 ngày, dẫn đến sự không thống nhất giữa các nghiên cứu. Việc xác định liều lượng cần được nghiên cứu thêm để cung cấp thêm nhiều bằng chứng khẳng định việc sử dụng chất chống oxy hoá trong ứng dụng tiềm năng trong điều trị vô sinh nam giới.
TÀI LIỆU THAM KHẢO
1. Louis, J.F., et al., The prevalence of couple infertility in the United States from a male perspective: evidence from a nationally representative sample. Andrology, 2013. 1(5): p. 741-748.2. Soraggi, S., et al., Evaluating genetic causes of azoospermia: What can we learn from a complex cellular structure and single-cell transcriptomics of the human testis? Human Genetics, 2021. 140(1): p. 183-201.
3. Athayde, K.S., et al., Development of normal reference values for seminal reactive oxygen species and their correlation with leukocytes and semen parameters in a fertile population. Journal of andrology, 2007. 28(4): p. 613-620.
4. Mehra, B.L., et al., Male infertility rate: a retrospective study. Urologia journal, 2018. 85(1): p. 22-24.
5. Wagner, H., J.W. Cheng, and E.Y. Ko, Role of reactive oxygen species in male infertility: An updated review of literature. Arab journal of urology, 2018. 16(1): p. 35-43.
6. Du Plessis, S.S., et al., Physiological roles of reactive oxygen species (ROS) in the reproductive system. Oxidative Stress in Human Reproduction: Shedding Light on a Complicated Phenomenon, 2017: p. 47-64.
7. Ford, W.J.H.r.u., Regulation of sperm function by reactive oxygen species. 2004. 10(5): p. 387-399.
8. Geva, E., et al., The effect of antioxidant treatment on human spermatozoa and fertilization rate in an in vitro fertilization program. 1996. 66(3): p. 430-434.
9. Agarwal, A., et al., Utility of antioxidants in the treatment of male infertility: clinical guidelines based on a systematic review and analysis of evidence. 2021. 39(2): p. 233.
10. Lewis, S.E., et al., Total antioxidant capacity of seminal plasma is different in fertile and infertile men. 1995. 64(4): p. 868-870.
11. Lewis, S.E., et al., Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men. 1997. 67(1): p. 142-147.
12. Gharagozloo, P. and R.J.J.H.r. Aitken, The role of sperm oxidative stress in male infertility and the significance of oral antioxidant therapy. 2011. 26(7): p. 1628-1640.
13. Ross, C., et al., A systematic review of the effect of oral antioxidants on male infertility. 2010. 20(6): p. 711-723.
14. Steiner, A., et al., Antioxidants in the treatment of male factor infertility: Results from the double blind, multi-center, randomized controlled Males, Antioxidants, and Infertility (MOXI) trial. 2018. 33: p. i30.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thành phố Đà Nẵng, thứ sáu và thứ bảy, ngày 6 - 7 . 3 . 2026
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








