Tin chuyên ngành
on Wednesday 25-10-2023 10:13pm
Danh mục: Vô sinh & hỗ trợ sinh sản
CN. Nguyễn Thị Vân Anh, ThS. Nguyễn Hữu Duy
IVFMD Vạn Hạnh
GIỚI THIỆU
Ty thể là bào quan siêu nhỏ có trong hầu hết các loại tế bào của con người, tham gia vào quá trình phosphoryl oxy hóa và sản xuất năng lượng dưới dạng adenosine triphosphate (ATP). Vai trò chính của ty thể là cung cấp ATP nội bào cho các hoạt động sinh lý, điều hòa chuyển hóa tế bào và hỗ trợ kiểm soát quá trình chết theo chương trình (apoptosis). Bộ gen di truyền trong ty thể tương đối nhỏ được gọi là mtDNA (Mitochondrial DNA), có dạng sợi đôi, hình tròn, độ dài khoảng 16,6kb. Mỗi tế bào chứa 100 – 10.000 bản sao mtDNA nhưng chỉ chiếm 0,1% bộ gen. MtDNA không có cấu trúc bảo vệ (protein histone) cũng như khả năng tự sửa chữa nên dễ tích lũy đột biến hơn so với DNA trong nhân (Nuclear DNA – nDNA) [1]. MtDNA được di truyền từ mẹ sang con vì khi thụ tinh ty thể của tinh trùng bị thoái hóa và noãn có hàm lượng mtDNA cao đáng kể (200.000 – 300.000 bản sao) [2].
Di truyền ty thể rất phức tạp đòi hỏi sự biểu hiện phối hợp của các gen nằm trong cả nDNA và mtDNA. Trong đó, 15 – 25% các bệnh ty thể là do đột biến mtDNA gây ra [3]. Từ 1988 tới nay, có hơn 150 đột biến liên quan đến mtDNA trên người được phát hiện [2]. Tỷ lệ mang đột biến mtDNA khoảng 1/5.000 người và khoảng 1/10.000 người có biểu hiện lâm sàng [1]. Một số bệnh phổ biến được ghi nhận như: Hội chứng Leigh, MELAS, Alzheimer, ung thư, tiểu đường, động kinh, bệnh Huntington, chậm phát triển tâm thần và bệnh Parkinson [2, 3]. Các bệnh do mtDNA có mức độ từ nhẹ đến nặng, thậm chí gây tử vong. Tuy nhiên, do sự phức tạp của ty thể nên hầu hết các bệnh không thể chữa khỏi và không có phương pháp nào được Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ chấp thuận [1]. Vì không có cách điều trị các rối loạn mtDNA nên ngăn ngừa di truyền từ tế bào mầm là ưu tiên hàng đầu. Trong công nghệ hỗ trợ sinh sản (Assisted reproductive technology – ART), phụ nữ mang mtDNA đột biến gây bệnh có thể phải xin noãn như là một phương pháp an toàn nhưng nhược điểm là trẻ sinh ra chỉ có quan hệ di truyền với bố.
Trong những năm gần đây, kỹ thuật chuyển ty thể bao gồm chuyển ty thể tự thân và chuyển ty thể dị ghép (hay còn được gọi là kỹ thuật thay thế ty thể) nhận được nhiều sự quan tâm [4]. Trong đó, kỹ thuật thay thế ty thể (Mitochondrial replacement techniques – MRT) là một phương pháp hỗ trợ sinh sản đầy hứa hẹn giúp loại bỏ các mtDNA bất thường mang lại những đứa trẻ khỏe mạnh cho các cặp vợ chồng hiếm muộn. Tuy nhiên, vẫn còn nhiều tranh cãi về mặt kỹ thuật và những lo ngại về sức khỏe của trẻ sinh ra nhờ MRT [2]. Bài viết này nhằm mục đích đánh giá chung tính an toàn, hiệu quả và khả năng ứng dụng của kỹ thuật thay thế ty thể trong ART.
KỸ THUẬT THAY THẾ TY THỂ (Mitochondrial replacement techniques – MRT)
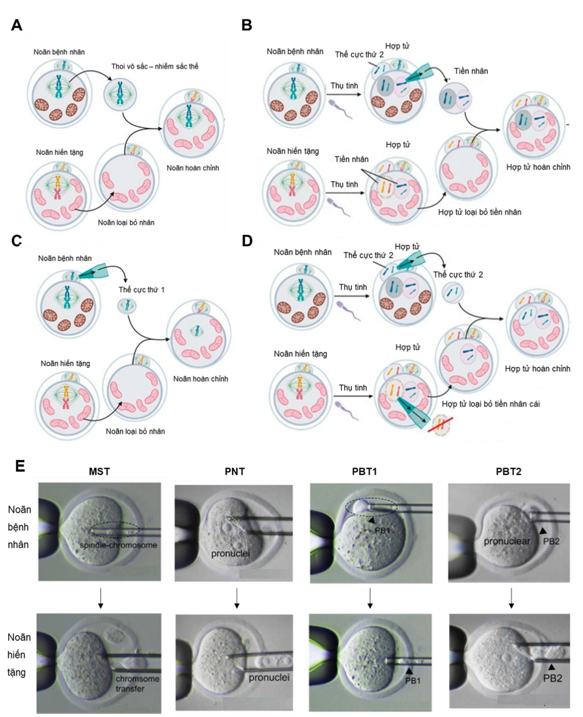
Kỹ thuật thay thế ty thể là một hình thức thụ tinh trong ống nghiệm (In vitro fertilization – IVF) mới liên quan đến việc chuyển nDNA của người mẹ khỏi noãn/hợp tử chứa mtDNA bất thường sang noãn/hợp tử của người hiến tặng đã được loại bỏ nDNA. Kỹ thuật này giúp trẻ sinh ra có di truyền của cả bố và mẹ nhưng không mang mtDNA gây bệnh từ mẹ. Ba kỹ thuật phát triển tiên tiến nhất là: Chuyển thoi vô sắc, chuyển tiền nhân và chuyển thể cực (Hình 1) [1, 4].
HIỆU QUẢ ĐIỀU TRỊ
Hiệu quả của kỹ thuật thay thế ty thể được đánh giá qua khả năng phát triển phôi của noãn/hợp tử sau quá trình vi thao tác. Ngoài ra, nhiễm chéo mtDNA cũng là một yếu tố được quan tâm sau MRT. Nhiễm chéo mtDNA được định nghĩa là mtDNA vô tình được chuyển cùng với nDNA, được tính dựa trên tỷ lệ giữa mtDNA của mẹ so với mtDNA của noãn người hiến tặng. Tỷ lệ di tuyền mtDNA cao hơn 5% làm tăng nguy cơ phát triển bệnh ty thể [5]. Năm 2021, Sendra và cộng sự đã tổng hợp các nghiên cứu MRT trên người (Bảng 1). Trong đó, các nghiên cứu MST và PNT cho tỷ lệ di truyền ty thể rất thấp trong phôi (<1% và <2%). Năm 2017, ca sinh sống đầu tiên từ kỹ thuật MST với tỷ lệ phát triển phôi nang lên tới 80%, mtDNA di truyền <6% [7]. Tuy nhiên, trong quá trình nuôi cấy kéo dài thu được một số dòng tế bào gốc phôi (Embryonic stem cell – ESC) có mức tăng mtDNA từ 1% lên tối đa 53% trong MST và từ 4% lên 60% trong PNT (Bảng 1). Riêng với kỹ thuật PBT1 được đánh giá tiềm năng phát triển phôi là chấp nhận được. Ngược lại, PBT2 cho kết quả khác nhau trong các nghiên cứu, Zhang và cộng sự không thể tạo thành phôi nang còn Wu và cộng sự cho kết quả chuyển PBT1 tương tự PBT2 (Bảng 1).
Tóm lại, MRT cho thấy tính khả thi với sự phát triển phôi và đã tạo ra ca sinh bé khỏe mạnh. Mặc dù tỷ lệ di truyền mtDNA gây bệnh rất thấp nhưng vẫn có nguy cơ mtDNA sẽ tăng lên lại ở thế hệ sau. Do đó, các nghiên cứu trong tương lại cần tập trung vào việc tối ưu hóa MRT, cố gắng giảm thiểu lượng mtDNA di truyền cho thế hệ sau [4].
Bảng 1. Các nghiên cứu thay thế ty thể trên người [5]
(ESC: tế bào gốc phôi, EF: điện dung, HVJ-E: dịch chiết virus Sendai, P: cấy chuyền tế bào, - : không kiểm tra)
TÍNH AN TOÀN CỦA MRT
Năm 2017, Zhang và cộng sự báo cáo trường hợp về em bé đầu tiên ra đời bằng MST từ người mẹ có đột biến di truyền hội chứng Leigh gây 4 lần sẩy thai và 2 đứa trẻ bị tử vong. Em bé được kiểm tra kỹ lưỡng về thể chất và thần kinh từ khi mới sinh, 2 tuần, 4 tuần, 2 tháng, 3 tháng và 4 tháng, tất cả các kết quả đều bình thường. Đây là một bước ngoặt lớn đầu tiên cho thấy tính an toàn của các kỹ thuật MRT [7]. Đến năm 2023, Costa-Borges và cộng sự thực hiện nghiên cứu thí điểm đầu tiên xác nhận tính an toàn và hiệu quả của MST ở 25 cặp vợ chồng thất bại IVF nhiều lần. Kết quả sau 28 chu kỳ MST cho thấy tỷ lệ thụ tinh (75,9%), tỷ lệ phôi nang (62,4%), sau 19 lần chuyển phôi có 7 thai lâm sàng (36,8%) và 6 em bé khỏe mạnh được sinh ra (31,6%). Theo dõi nhi khoa cho trẻ từ 12 – 24 tháng không ghi nhận bất thường. Kỹ thuật in dấu DNA xác nhận DNA của trẻ MST được thừa hưởng từ cả bố mẹ và không có sự đóng góp nào từ người hiến tặng. Trong đó, 5/6 trẻ có mtDNA từ người hiến tặng (>99%), 1 trẻ có tỷ lệ mtDNA của mẹ (0,8%) ở giai đoạn phôi nang và gia tăng 30 – 60% sau khi sinh [8].
Các nghiên cứu về tính an toàn và hiệu quả của MRT sẽ luôn có một số rủi ro và sự không chắc chắn đó cũng là những hạn chế của phương pháp này. Trong đó, cộng đồng khoa học đã đưa ra ba vấn đề tiềm ẩn liên quan đến MRT như sau [5]:
Do những hạn chế của kỹ thuật thay thế ty thể nên có rất ít các nghiên cứu đạt tới được giai đoạn thai lâm sàng nên tính an toàn của phương pháp MRT còn gây nhiều tranh cãi. Cần có các nghiên cứu lớn và dài hạn hơn nữa để xác nhận rằng các kỹ thuật này có thể tạo ra các cá thể khỏe mạnh mà không có bất thường thượng di truyền nào.
TƯƠNG LAI CỦA MRT
Hiện nay, do những hiểu biết chưa rõ ràng và sai lệch về MRT khiến kỹ thuật này bị cấm ở nhiều quốc gia. Báo chí thường sử dụng thuật ngữ “ba bố mẹ” để chỉ những đứa trẻ được sinh ra từ MRT gây hiểu lầm. Mặc dù, những đứa trẻ này chỉ có vật liệu di truyền từ ba người khác nhau nhưng về bản chất sẽ không có mối quan hệ mẹ - con với người hiến noãn. Bên cạnh đó, nhiều người cho rằng MRT liên quan đến sự biến đổi gen ở tế bào mầm (giao tử, hợp tử). Tuy nhiên, “liệu pháp gen” thường được sử dụng để chỉ những thay đổi trong bộ gen (nDNA) không phải trong DNA ty thể. Ngoài ra, mtDNA cấu thành một phần rất nhỏ trong toàn bộ gen của tế bào (0,1%). Đồng thời, nhiều người đặt ra câu hỏi “MRT có hợp đạo đức hay không?”. Bệnh ty thể không có phương pháp điều trị dứt điểm và chỉ giới hạn trong điều trị triệu chứng. Từ góc nhìn của những người phụ nữ mang mtDNA gây bệnh việc áp dụng MRT để ngăn chặn di truyền cho con cái là hợp lý về mặt đạo đức. Điều quan trọng là phụ nữ phải được thông báo đầy đủ về tất cả các lựa chọn thay thế, hỗ trợ sinh sản hiện có trước khi đưa ra quyết định sử dụng MRT [3, 5].
Trong tương lai, MRT có thể mang lại lợi ích cho cả nam và nữ, mặc dù mtDNA đột biến ở nam không di truyền cho con cái nhưng họ phải đối mặt với những nguy cơ bệnh lý do đột biến này gây ra. Một cuộc khảo sát năm 2016 bởi Englestad và cộng sự ghi nhận 95% phụ nữ mắc bệnh ty thể ủng hộ việc thực hiện kỹ thuật này, trong khi 52% phụ nữ coi nó là rất quan trọng và 43% coi nó là một phần quan trọng trên cơ sở mong muốn có một đứa con di truyền. Điều này chứng tỏ nếu MRT được ứng dụng vào lâm sàng sẽ được chấp thuận rộng rãi trong xã hội [3]. Hiện nay, ngoài Anh là quốc gia đầu tiên phê duyệt MRT vào năm 2015, Úc trở thành quốc gia thứ hai có lộ trình quản lý rõ ràng các ứng dụng lâm sàng của kỹ thuật này vào năm 2021 [5].
KẾT LUẬN
Tóm lại, MRT giúp những phụ nữ mang mtDNA gây bệnh có thể có đứa con khỏe mạnh và đúng di truyền. MRT chắc chắn là một bước đột phá trong thế giới khoa học y tế nhưng do những nhược điểm và hiểu sai về tên gọi nên kỹ thuật này bị cấm ở nhiều quốc gia. Hiện nay, không có kỹ thuật thay thế ty thể nào vượt trội rõ ràng và MRT làm giảm nguy cơ di truyền các bệnh ty thể từ mẹ nhưng chúng không ngăn chặn được hoàn toàn. Do đó, trong tương lai cần nhiều thử nghiệm lớn hơn, kéo dài để chứng minh tính hiệu quả và an toàn của kỹ thuật trước khi đưa vào ứng dụng trong lâm sàng.
TÀI LIỆU THAM KHẢO
IVFMD Vạn Hạnh
GIỚI THIỆU
Ty thể là bào quan siêu nhỏ có trong hầu hết các loại tế bào của con người, tham gia vào quá trình phosphoryl oxy hóa và sản xuất năng lượng dưới dạng adenosine triphosphate (ATP). Vai trò chính của ty thể là cung cấp ATP nội bào cho các hoạt động sinh lý, điều hòa chuyển hóa tế bào và hỗ trợ kiểm soát quá trình chết theo chương trình (apoptosis). Bộ gen di truyền trong ty thể tương đối nhỏ được gọi là mtDNA (Mitochondrial DNA), có dạng sợi đôi, hình tròn, độ dài khoảng 16,6kb. Mỗi tế bào chứa 100 – 10.000 bản sao mtDNA nhưng chỉ chiếm 0,1% bộ gen. MtDNA không có cấu trúc bảo vệ (protein histone) cũng như khả năng tự sửa chữa nên dễ tích lũy đột biến hơn so với DNA trong nhân (Nuclear DNA – nDNA) [1]. MtDNA được di truyền từ mẹ sang con vì khi thụ tinh ty thể của tinh trùng bị thoái hóa và noãn có hàm lượng mtDNA cao đáng kể (200.000 – 300.000 bản sao) [2].
Di truyền ty thể rất phức tạp đòi hỏi sự biểu hiện phối hợp của các gen nằm trong cả nDNA và mtDNA. Trong đó, 15 – 25% các bệnh ty thể là do đột biến mtDNA gây ra [3]. Từ 1988 tới nay, có hơn 150 đột biến liên quan đến mtDNA trên người được phát hiện [2]. Tỷ lệ mang đột biến mtDNA khoảng 1/5.000 người và khoảng 1/10.000 người có biểu hiện lâm sàng [1]. Một số bệnh phổ biến được ghi nhận như: Hội chứng Leigh, MELAS, Alzheimer, ung thư, tiểu đường, động kinh, bệnh Huntington, chậm phát triển tâm thần và bệnh Parkinson [2, 3]. Các bệnh do mtDNA có mức độ từ nhẹ đến nặng, thậm chí gây tử vong. Tuy nhiên, do sự phức tạp của ty thể nên hầu hết các bệnh không thể chữa khỏi và không có phương pháp nào được Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ chấp thuận [1]. Vì không có cách điều trị các rối loạn mtDNA nên ngăn ngừa di truyền từ tế bào mầm là ưu tiên hàng đầu. Trong công nghệ hỗ trợ sinh sản (Assisted reproductive technology – ART), phụ nữ mang mtDNA đột biến gây bệnh có thể phải xin noãn như là một phương pháp an toàn nhưng nhược điểm là trẻ sinh ra chỉ có quan hệ di truyền với bố.
Trong những năm gần đây, kỹ thuật chuyển ty thể bao gồm chuyển ty thể tự thân và chuyển ty thể dị ghép (hay còn được gọi là kỹ thuật thay thế ty thể) nhận được nhiều sự quan tâm [4]. Trong đó, kỹ thuật thay thế ty thể (Mitochondrial replacement techniques – MRT) là một phương pháp hỗ trợ sinh sản đầy hứa hẹn giúp loại bỏ các mtDNA bất thường mang lại những đứa trẻ khỏe mạnh cho các cặp vợ chồng hiếm muộn. Tuy nhiên, vẫn còn nhiều tranh cãi về mặt kỹ thuật và những lo ngại về sức khỏe của trẻ sinh ra nhờ MRT [2]. Bài viết này nhằm mục đích đánh giá chung tính an toàn, hiệu quả và khả năng ứng dụng của kỹ thuật thay thế ty thể trong ART.
KỸ THUẬT THAY THẾ TY THỂ (Mitochondrial replacement techniques – MRT)
Kỹ thuật thay thế ty thể là một hình thức thụ tinh trong ống nghiệm (In vitro fertilization – IVF) mới liên quan đến việc chuyển nDNA của người mẹ khỏi noãn/hợp tử chứa mtDNA bất thường sang noãn/hợp tử của người hiến tặng đã được loại bỏ nDNA. Kỹ thuật này giúp trẻ sinh ra có di truyền của cả bố và mẹ nhưng không mang mtDNA gây bệnh từ mẹ. Ba kỹ thuật phát triển tiên tiến nhất là: Chuyển thoi vô sắc, chuyển tiền nhân và chuyển thể cực (Hình 1) [1, 4].
- Chuyển thoi vô sắc (Maternal spindle transfer – MST): Chuyển thoi vô sắc ở kỳ giữa của noãn người mẹ sang noãn của người hiến tặng khỏe mạnh đã được loại bỏ nhân trước đó. Noãn hoàn thiện sẽ được thụ tinh với tinh trùng của người bố. MST có thể được coi là một kỹ thuật hàng đầu của MRT.
- Chuyển tiền nhân (Pronuclear transfer – PNT): Noãn của người mẹ và người hiến tặng sẽ được thụ tinh với tinh trùng tạo thành hợp tử. Sau đó, các tiền nhân của hợp tử tạo ra từ người mẹ sẽ được chuyển vào hợp tử của người hiến tặng không chứa mtDNA gây bệnh đã loại bỏ tiền nhân. Hợp tử hoàn chỉnh được nuôi cấy phát triển thành phôi. Chuyển tiền nhân là một kỹ thuật hiệu quả nhưng đưa ra những lo ngại về đạo đức vì loại bỏ tiền nhân của hợp tử.
- Chuyển thể cực (Polar body transfer – PBT):
- Chuyển thể cực thứ 1 (PBT1): Thể cực thứ nhất là sản phẩm phụ của quá trình giảm phân I chứa nDNA và có rất ít mtDNA. Do đó, thể cực thứ 1 của noãn người mẹ sẽ được chuyển vào noãn của người hiến tặng không chứa mtDNA gây bệnh đã được loại nhân. Sau đó noãn được thụ tinh với tinh trùng của người bố. Đây là kỹ thuật đầy hứa hẹn với kết quả tiền lâm sàng khả quan nhưng cần nghiên cứu sâu hơn trước khi áp dụng.
- Chuyển thể cực thứ 2 (PBT2): Noãn của người mẹ và người hiến tặng có mtDNA không gây bệnh được thụ tinh với tinh trùng tạo thành hợp tử. Thể cực thứ 2 của người mẹ sẽ được chuyển vào hợp tử của người hiến tặng đã loại bỏ tiền nhân cái. Hợp tử hoàn chỉnh được nuôi cấy phát triển thành phôi. Chuyển thể cực thứ hai gây khó khăn không chỉ liên quan đến loại bỏ hợp tử mà còn trong kỹ thuật xác định tiền nhân cái.

Hình 1. Kỹ thuật thay thế ty thể [5, 6]
A. Chuyển thoi vô sắc, B. Chuyển tiền nhân, C. Chuyển thể cực thứ 1, D. Chuyển thể cực thứ 2, E. Các phương pháp chuyển ty thể) HIỆU QUẢ ĐIỀU TRỊ
Hiệu quả của kỹ thuật thay thế ty thể được đánh giá qua khả năng phát triển phôi của noãn/hợp tử sau quá trình vi thao tác. Ngoài ra, nhiễm chéo mtDNA cũng là một yếu tố được quan tâm sau MRT. Nhiễm chéo mtDNA được định nghĩa là mtDNA vô tình được chuyển cùng với nDNA, được tính dựa trên tỷ lệ giữa mtDNA của mẹ so với mtDNA của noãn người hiến tặng. Tỷ lệ di tuyền mtDNA cao hơn 5% làm tăng nguy cơ phát triển bệnh ty thể [5]. Năm 2021, Sendra và cộng sự đã tổng hợp các nghiên cứu MRT trên người (Bảng 1). Trong đó, các nghiên cứu MST và PNT cho tỷ lệ di truyền ty thể rất thấp trong phôi (<1% và <2%). Năm 2017, ca sinh sống đầu tiên từ kỹ thuật MST với tỷ lệ phát triển phôi nang lên tới 80%, mtDNA di truyền <6% [7]. Tuy nhiên, trong quá trình nuôi cấy kéo dài thu được một số dòng tế bào gốc phôi (Embryonic stem cell – ESC) có mức tăng mtDNA từ 1% lên tối đa 53% trong MST và từ 4% lên 60% trong PNT (Bảng 1). Riêng với kỹ thuật PBT1 được đánh giá tiềm năng phát triển phôi là chấp nhận được. Ngược lại, PBT2 cho kết quả khác nhau trong các nghiên cứu, Zhang và cộng sự không thể tạo thành phôi nang còn Wu và cộng sự cho kết quả chuyển PBT1 tương tự PBT2 (Bảng 1).
Tóm lại, MRT cho thấy tính khả thi với sự phát triển phôi và đã tạo ra ca sinh bé khỏe mạnh. Mặc dù tỷ lệ di truyền mtDNA gây bệnh rất thấp nhưng vẫn có nguy cơ mtDNA sẽ tăng lên lại ở thế hệ sau. Do đó, các nghiên cứu trong tương lại cần tập trung vào việc tối ưu hóa MRT, cố gắng giảm thiểu lượng mtDNA di truyền cho thế hệ sau [4].
Bảng 1. Các nghiên cứu thay thế ty thể trên người [5]
| Nghiên cứu | Phương thức | Phát triển phôi nang | Tỷ lệ sinh | Nhiễm chéo mtDNA |
| Chuyển thoi vô sắc | ||||
| Tachibana và cs., 2013 | HVJ-E | 43% (19/44) thấp hơn nhóm đối chứng (52% hợp tử thụ tinh bất thường) | - |
Phôi: 0,5% ± 0,4% ESC: 0,6% ± 0,9% |
| Paull và cs., 2013 |
HVJ-E, EF |
37% (7/18) tương tự nhóm đối chứng (33%) | - |
Phôi: 0,31% ± 0,27% ESC: <0,5%, (ngoại trừ P4-P14 = 2,79%) |
| Yamada và cs., 2016 | - | 32% (noãn tươi và noãn đông lạnh) | - |
Phôi: 0,2% ESC: 0% (7/8 dòng tế bào P6-P30), 0-1% (1/8 dòng tế bào P1 = 1%; P36 = 53%; P59 = 1%) |
| Kang và cs., 2016 | HVJ-E | 62,5% (20/32), mang đột biến 50% (6/12) | - |
Phôi: <1% ESC: <1%(15/18), 100% (3/18) |
| Zhang và cs., 2017 | EF | 80% (4/5) | 100% (1/1) |
Phôi nang: 5,10% ± 1,11% Nước tiểu: 2,36%; Miệng: 5,59%; Bao quy đầu: 9,23%; Màng ối: 6,77% |
| Chuyển tiền nhân | ||||
| Craven và cs., 2010 | HVJ-E | 8,3% (từ phôi thụ tinh bất thường) |
- |
Phôi: 8.1% ± 7.6% Phôi (xét nghiệm RFLP-PCR): 4/9 mtDNA không thể phát hiện được, số phôi còn lại <2%(1,68 ± 1,81%) |
| Hyslop và cs., 2016 | HVJ-E | PNT dị loài: 39% thấp hơn nhóm đối chứng (63%) và PNT tự thân (60%) |
- |
Phôi (công nghệ tối ưu hóa): < 5% (< 2% ở 79%; 2 – 5% ở 21%) ESC: < 2% (4/5), 0 - 60% (1/5) |
| Zhang và cs., 2016 | EF |
Phôi 4 tế bào: 71,4% (5/7) Làm tổ: 60% (3/5) |
0% | Tử vong do sa dây rốn. Kiểm tra mtDNA thai nhi giống mtDNA người hiến tặng, không phát hiện mtDNA gây bệnh |
| Wu và cs., 2017 | HVJ-E | 25,6% (10/39) tương tự nhóm đối chứng |
- |
Tỷ lệ nguyên bội: 66,67% (6/9) Phôi: 1,04% (0,10% - 4,67%) |
| Chuyển thể cực | ||||
| Ma và cs., 2017 | HVJ-E, PBT1 | 32,5% (8/25) thấp hơn đối chứng 71% (12/17) | - | - |
| Zhang và cs., 2017 | HVJ-E, PBT1 | 24,1% (7/29) tương tự đối chứng (PBT1 tươi và bảo quản lạnh) | - | - |
| HVJ-E PBT2 | 0% (0/17) | - | - | |
| Wu và cs., 2017 | HVJ-E, PBT1 | 25,3% (19/75) tương tự đối chứng và PB2T | - |
Phôi: 0,26% (0,07 - 0,5%) ESC: 0,15% |
| HVJ-E, PBT2 | 27,5% (14/51) tương tự đối chứng và PB1T | - |
Phôi: 0,37% (0,06 - 0,7%) ESC: 0,22% |
|
TÍNH AN TOÀN CỦA MRT
Năm 2017, Zhang và cộng sự báo cáo trường hợp về em bé đầu tiên ra đời bằng MST từ người mẹ có đột biến di truyền hội chứng Leigh gây 4 lần sẩy thai và 2 đứa trẻ bị tử vong. Em bé được kiểm tra kỹ lưỡng về thể chất và thần kinh từ khi mới sinh, 2 tuần, 4 tuần, 2 tháng, 3 tháng và 4 tháng, tất cả các kết quả đều bình thường. Đây là một bước ngoặt lớn đầu tiên cho thấy tính an toàn của các kỹ thuật MRT [7]. Đến năm 2023, Costa-Borges và cộng sự thực hiện nghiên cứu thí điểm đầu tiên xác nhận tính an toàn và hiệu quả của MST ở 25 cặp vợ chồng thất bại IVF nhiều lần. Kết quả sau 28 chu kỳ MST cho thấy tỷ lệ thụ tinh (75,9%), tỷ lệ phôi nang (62,4%), sau 19 lần chuyển phôi có 7 thai lâm sàng (36,8%) và 6 em bé khỏe mạnh được sinh ra (31,6%). Theo dõi nhi khoa cho trẻ từ 12 – 24 tháng không ghi nhận bất thường. Kỹ thuật in dấu DNA xác nhận DNA của trẻ MST được thừa hưởng từ cả bố mẹ và không có sự đóng góp nào từ người hiến tặng. Trong đó, 5/6 trẻ có mtDNA từ người hiến tặng (>99%), 1 trẻ có tỷ lệ mtDNA của mẹ (0,8%) ở giai đoạn phôi nang và gia tăng 30 – 60% sau khi sinh [8].
Các nghiên cứu về tính an toàn và hiệu quả của MRT sẽ luôn có một số rủi ro và sự không chắc chắn đó cũng là những hạn chế của phương pháp này. Trong đó, cộng đồng khoa học đã đưa ra ba vấn đề tiềm ẩn liên quan đến MRT như sau [5]:
- Rủi ro bắt nguồn từ thao tác: Việc sử dụng các chiết xuất virus Sendai (HVJ – E), các chất gây rối loạn khung tế bào (cytochalasin B, nocodazole) trong quá trình chuyển nhân tiềm ẩn các nguy cơ chưa được biết đến. Đồng thời các áp lực do dụng cụ lên vật chất di truyền có thể gây tổn thương nhiễm sắc thể và tăng dị tật phôi, tuy nhiên không có thông tin rõ ràng.
- Sự tích lũy mtDNA gây bệnh: Một trong những mối bận tâm chính là một số mtDNA gây bệnh của mẹ có thể còn sót lại. Do đó, sự di truyền mtDNA của mẹ vẫn có thể dẫn đến bệnh tật ở thế hệ sau. MRT có thể làm giảm đáng kể nguy cơ mắc bệnh mtDNA nhưng không thể đảm bảo ngăn chặn hoàn toàn. Vì lý do này, cần theo dõi những trẻ em được sinh ra trong thời gian dài.
- Sự không tương thích nDNA: Khả năng tương thích giữa mtDNA và nDNA khi có nhiều nguồn gốc khác nhau còn gây nhiều tranh cãi. Các nghiên cứu đưa ra kết quả trái ngược nhau, không thống nhất.
Do những hạn chế của kỹ thuật thay thế ty thể nên có rất ít các nghiên cứu đạt tới được giai đoạn thai lâm sàng nên tính an toàn của phương pháp MRT còn gây nhiều tranh cãi. Cần có các nghiên cứu lớn và dài hạn hơn nữa để xác nhận rằng các kỹ thuật này có thể tạo ra các cá thể khỏe mạnh mà không có bất thường thượng di truyền nào.
TƯƠNG LAI CỦA MRT
Hiện nay, do những hiểu biết chưa rõ ràng và sai lệch về MRT khiến kỹ thuật này bị cấm ở nhiều quốc gia. Báo chí thường sử dụng thuật ngữ “ba bố mẹ” để chỉ những đứa trẻ được sinh ra từ MRT gây hiểu lầm. Mặc dù, những đứa trẻ này chỉ có vật liệu di truyền từ ba người khác nhau nhưng về bản chất sẽ không có mối quan hệ mẹ - con với người hiến noãn. Bên cạnh đó, nhiều người cho rằng MRT liên quan đến sự biến đổi gen ở tế bào mầm (giao tử, hợp tử). Tuy nhiên, “liệu pháp gen” thường được sử dụng để chỉ những thay đổi trong bộ gen (nDNA) không phải trong DNA ty thể. Ngoài ra, mtDNA cấu thành một phần rất nhỏ trong toàn bộ gen của tế bào (0,1%). Đồng thời, nhiều người đặt ra câu hỏi “MRT có hợp đạo đức hay không?”. Bệnh ty thể không có phương pháp điều trị dứt điểm và chỉ giới hạn trong điều trị triệu chứng. Từ góc nhìn của những người phụ nữ mang mtDNA gây bệnh việc áp dụng MRT để ngăn chặn di truyền cho con cái là hợp lý về mặt đạo đức. Điều quan trọng là phụ nữ phải được thông báo đầy đủ về tất cả các lựa chọn thay thế, hỗ trợ sinh sản hiện có trước khi đưa ra quyết định sử dụng MRT [3, 5].
Trong tương lai, MRT có thể mang lại lợi ích cho cả nam và nữ, mặc dù mtDNA đột biến ở nam không di truyền cho con cái nhưng họ phải đối mặt với những nguy cơ bệnh lý do đột biến này gây ra. Một cuộc khảo sát năm 2016 bởi Englestad và cộng sự ghi nhận 95% phụ nữ mắc bệnh ty thể ủng hộ việc thực hiện kỹ thuật này, trong khi 52% phụ nữ coi nó là rất quan trọng và 43% coi nó là một phần quan trọng trên cơ sở mong muốn có một đứa con di truyền. Điều này chứng tỏ nếu MRT được ứng dụng vào lâm sàng sẽ được chấp thuận rộng rãi trong xã hội [3]. Hiện nay, ngoài Anh là quốc gia đầu tiên phê duyệt MRT vào năm 2015, Úc trở thành quốc gia thứ hai có lộ trình quản lý rõ ràng các ứng dụng lâm sàng của kỹ thuật này vào năm 2021 [5].
KẾT LUẬN
Tóm lại, MRT giúp những phụ nữ mang mtDNA gây bệnh có thể có đứa con khỏe mạnh và đúng di truyền. MRT chắc chắn là một bước đột phá trong thế giới khoa học y tế nhưng do những nhược điểm và hiểu sai về tên gọi nên kỹ thuật này bị cấm ở nhiều quốc gia. Hiện nay, không có kỹ thuật thay thế ty thể nào vượt trội rõ ràng và MRT làm giảm nguy cơ di truyền các bệnh ty thể từ mẹ nhưng chúng không ngăn chặn được hoàn toàn. Do đó, trong tương lai cần nhiều thử nghiệm lớn hơn, kéo dài để chứng minh tính hiệu quả và an toàn của kỹ thuật trước khi đưa vào ứng dụng trong lâm sàng.
TÀI LIỆU THAM KHẢO
- Claiborne A, English R, Kahn J, (2016). Mitochondrial Replacement Techniques: Ethical, Social, and Policy Considerations. Washington (DC): National Academies Press (US).
- Tachibana M, Kuno T, Yaegashi N, (2018). Mitochondrial replacement therapy and assisted reproductive technology: A paradigm shift toward treatment of genetic diseases in gametes or in early embryos. Reproductive medicine and biology, 17(4), 421–433. Published 2018 Sep 19. doi:10.1002/rmb2.12230
- Sharma H, Singh D, Mahant A, et al (2020) . Development of mitochondrial replacement therapy: A review. Heliyon ;6(9):e04643. Published 2020 Sep 14. doi:10.1016/j.heliyon.2020.e04643
- Rodríguez-Varela C, & Labarta E (2022). Role of Mitochondria Transfer in Infertility: A Commentary. Cells, 11(12), 1867. https://doi.org/10.3390/cells11121867
- Sendra L, García-Mares A, Herrero MJ, et al (2021). Mitochondrial DNA Replacement Techniques to Prevent Human Mitochondrial Diseases. International Journal of Molecular Sciences 22, no. 2: 551. Published 2021 Jan 7. doi:10.3390/ijms22020551
- Wang T, Sha H, Ji D, et al (2014). Polar body genome transfer for preventing the transmission of inherited mitochondrial diseases. Cell;157(7):1591-1604. doi:10.1016/j.cell.2014.04.042
- Zhang J, Liu H, Luo S, et al (2017). Live birth derived from oocyte spindle transfer to prevent mitochondrial disease. Reprod Biomed Online. 2017;34(4):361-368. doi:10.1016/j.rbmo.2017.01.013
- Costa-Borges N, Nikitos E, Späth K, et al (2023). First pilot study of maternal spindle transfer for the treatment of repeated in vitro fertilization failures in couples with idiopathic infertility. Fertility and sterility, 119(6), 964–973. https://doi.org/10.1016/j.fertnstert.2023.02.008
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thành phố Đà Nẵng, thứ sáu và thứ bảy, ngày 6 - 7 . 3 . 2026
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








