Tin chuyên ngành
on Monday 09-05-2022 3:37pm
Danh mục: Vô sinh & hỗ trợ sinh sản
CN. Khổng Tiết Mây Như
IVFMD - Tân Bình; Bệnh viện đa khoa Mỹ Đức
Cả đông lạnh noãn và phôi đều có thể sử dụng cho những phụ nữ dưới 40 tuổi ngoại trừ những bệnh nhân mắc bệnh đông máu nghiêm trọng hoặc nguy cơ nhiễm trùng cao (Cobo và cs, 2018).
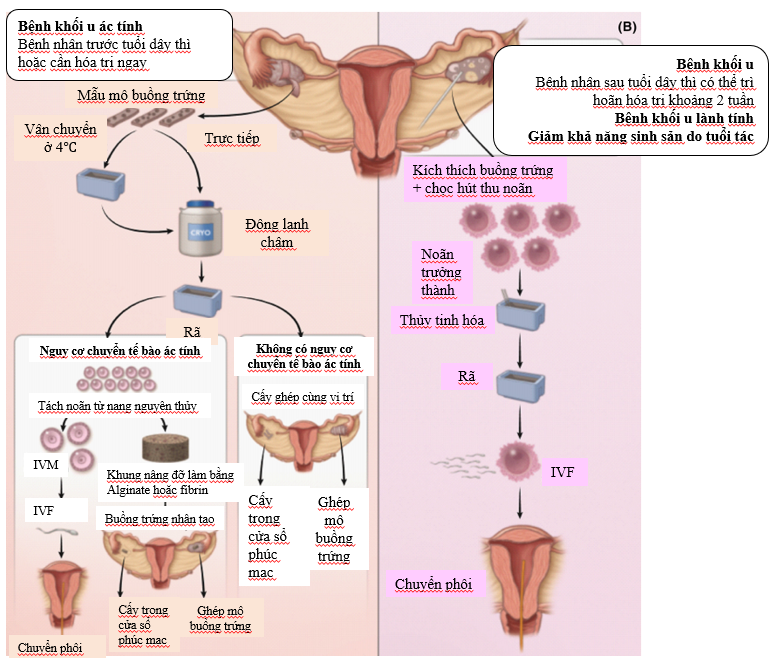
Hình 1. Phương pháp nuôi trưởng thành noãn thu từ mô buồng trứng OTO-IVM(Marie và cs, 2020)
Phương pháp OTC được chỉ định cho người bị hạn chế thời gian do sự tiến triển của khối u hoặc tình trạng sức khỏe của bệnh nhân, tối thiểu là những đối tượng nhỏ hơn 36 tuổi. Việc thu mẫu và cấy ghép mô buồng trứng được thực hiện bằng phương pháp nội soi và rủi ro phẫu thuật rất thấp và hiếm gặp biến chứng, chỉ khoảng 0,2-1,4% (Lambertini và cs, 2020). Đến nay, hơn 300 phụ nữ trên toàn thế giới đã trải qua thủ thuật và việc phục hồi chức năng buồng trứng đạt được ở 95% trường hợp trong vòng 4-9 tháng sau cấy ghép, trong đó khoảng 85% là những bệnh nhân sống sót sau ung thư (Lambertini và cs, 2020).
Với mục đích tối đa hóa các lựa chọn sinh sản trong tương lai cho bệnh nhân được chọn, phương pháp nuôi trưởng thành noãn non thu từ mô buồng trứng (Ovarian tissue oocyte in-vitro maturation - OTO-IVM) đã được nghiên cứu. OTO-IVM là thu nhận noãn chưa trưởng thành từ các nang thứ cấp nhỏ trên mô buồng trứng rồi cấy IVM. Lợi ích của giải pháp này là không phụ thuộc vào giai đoạn chu kỳ kinh nguyệt và không cần sử dụng gonadotropin để kích thích buồng trứng. Đây là lựa chọn duy nhất cho những bệnh nhân có nguy cơ tái phát tế bào ác tính cao khi cấy ghép mô buồng trứng (Ingrid và cs, 2020).
Hiệu quả của các phương pháp hiện nay
Các phương pháp bảo tồn sinh sản được sử dụng thông dụng nhất hiện nay là đông lạnh noãn, phôi và gần đây nhất là OTC. Nhiều báo cáo cho thấy tỉ lệ trẻ sinh ra thấp hơn sau khi đông lạnh noãn bằng thủy tinh hóa ở bệnh nhân sau điều trị ung thư có thể do dự trữ buồng trứng giảm và đáp ứng kém với các kích thích buồng trứng (Cobo và cs, 2018).
Ức chế buồng trứng tạm thời với phác đồ GnRH đồng vận trong quá trình hóa trị liệu nên được xem là một lựa chọn để ngăn chặn những tác động tiêu cực của hóa trị liệu ở bệnh nhân lớn tuổi. Tuy nhiên, các dữ liệu về trường hợp mang thai sau điều trị vẫn còn hạn chế cũng như các tác dụng phụ không mong muốn (khô âm đạo, thay đổi tâm trạng, trầm cảm, vô kinh và có thể gây ảnh hưởng đến phản ứng với điều trị ung thư ở các khối u nhạy cảm với estrogen) nên phác đồ này chưa thể là một biện pháp thay thế duy trì khả năng sinh sản thay cho các phương pháp đông lạnh noãn và mô (Maria và cs, 2021).
Đối với đông lạnh noãn, dữ liệu gần đây cho thấy tỉ lệ trẻ sinh sống tích lũy (cumulative live birth rate – CLBR) là 61,9% ở phụ nữ 35 tuổi và 43,4% ở phụ nữ trên 35 tuổi (Lambertini và cs, 2020). Tỉ lệ sử dụng noãn đông lạnh ở những bệnh nhân sống sót sau ung thư chỉ dưới 10% (Delattre và cs, 2020) và tỉ lệ trẻ sinh ra thấp hơn đáng kể khi sử dụng noãn tự thân so với những phụ nữ khỏe mạnh lần lượt là 24,7% và 47,7% (Luke và cs, 2018). Tỉ lệ trẻ sinh ra ở những người sống sót còn phụ thuộc vào loại ung thư mà họ mắc phải như là ung thư vú (14,3%) và cao nhất ở người có tiền sử ung thư hắc tố da (melanoma cancer) (53,5%). Điều đó cho thấy số lượng noãn được phục hồi ở bệnh nhân nữ bị ung thư làm giảm tỉ lệ thụ tinh và làm tổ, dẫn đến tỉ lệ sinh thấp hơn so với nhóm phụ nữ bình thường (Lambertini và cs, 2020).
Đối với đông lạnh phôi bằng phương pháp thủy tinh hóa, tỉ lệ sống của phôi giai đoạn phân chia sau đông lạnh là 90% và tỉ lệ thai lâm sàng là 25-40%. Đặc biệt ở phôi nang đông lạnh thì hai thông số này cải thiện hơn lần lượt là 96,5% và 46,1%, trong đó tỉ lệ làm tổ của phôi nang là 30,6% (Konc và cs, 2014). Vì vậy, đông lạnh phôi đang là lựa chọn chung của các bác sĩ lâm sàng khi tư vấn bệnh nhân bảo tồn sinh sản trong quá trình điều trị các bệnh lý.
Ở phương pháp OTC, các báo cáo gần đây cho thấy có khoảng 4% bệnh nhân ung thư sau cấy ghép mô buồng trứng bị tái phát bệnh và không liên quan đến quy trình cấy ghép (Gellert và cs, 2018). Một bài nghiên cứu của Ven và cộng sự cho thấy trong các ca cấy ghép đầu tiên ở bệnh nhân bị suy buồng trứng sớm (premature ovarian insufficiency – POI) trước đó, tỉ lệ hoạt động của mô sau cấy là 63%, tỉ lệ mang thai là 28% và trẻ sinh sống là 23% (Ven và cs, 2016). Hiện nay, kỹ thuật này đã cho ra đời hơn 180 trẻ khỏe mạnh với tỉ lệ lên đến 40% (Lambertini và cs, 2020).
Đến năm 2020, Ingrid và cộng sự đã chứng minh được tính hiệu quả của phương pháp OTO-IVM với 16% bệnh nhân sống sót sau ung thư, thể hiện ở tỉ lệ mang thai là 67% và tỉ lệ trẻ sinh ra là 25%. Ngoài ra, tỉ lệ noãn trưởng thành ở nhóm bé gái mắc bệnh ung thư (7-11 tuổi) trải qua OTO-IVM là 22% do buồng trứng của trẻ trước tuổi dậy thì chứa một số lượng lớn các nang bất thường khi so với buồng trứng của người trưởng thành là 42% (Ingrid và cs, 2020). Bên cạnh đó, bài tổng quan gần đây cho thấy tỉ lệ trưởng thành noãn của phương pháp OTO-IVM là 30-40%, tỉ lệ thụ tinh là 35-65% và 5 báo cáo về số trẻ sinh ra (Roo và cs, 2021).
Tuy nhiên, bên cạnh hiệu quả mà các phương pháp bảo tồn sinh sản mang lại thì vẫn có một số ảnh hưởng đặc biệt là các thủ thuật cấy ghép. Tác động gián tiếp của phản ứng stress oxy hóa (reactive oxygen species – ROS) trong mô buồng trứng cấy ghép cũng đã được nghiên cứu rộng rãi khi đánh giá các dấu hiệu tổn thương oxy hóa định lượng bằng phản ứng oxy hóa của mỡ. Việc sản xuất ROS quá mức có thể gây ra các biến đổi protein, lipid và DNA dẫn đến tổn thương tế bào. Bên cạnh đó, sự sống sót của các nang buồng trứng trong mô ghép phụ thuộc vào thời gian và mức độ của yếu tố tăng trưởng proangiogenic được tạo ra và điều phối trong quá trình tái tuần hoàn sau cấy ghép vì sự mất nang xảy ra trước khi tái thông hoàn toàn mô ghép và ảnh hưởng đến 50-90% nguồn dự trữ nang (Marie và cs, 2020). Nang noãn dường như nhạy cảm nhất với tình trạng thiếu oxy trong các giai đoạn phát triển vì nhu cầu trao đổi chất cao hơn trong khi nang nguyên thủy ít bị tổn thương hơn nhờ trạng thái bất hoạt của chúng nhưng sự giảm đáng kể các nang nguyên thủy đã được ghi nhận sau khi cấy ghép do hậu quả của giai đoạn thiếu máu cục bộ hoặc thiếu oxy. Hơn nữa, OTO-IVM là một kỹ thuật tương đối mới nên thiếu dữ liệu kết quả lâm sàng và việc theo dõi lâu dài những đứa trẻ được thụ thai sau phương pháp thử nghiệm này cần được thiết lập (Ingrid và cs, 2020).
Ngoài các biện pháp đông lạnh và cấy ghép thì một chiến lược khác đã được nghiên cứu để tăng cường chức năng buồng trứng là sử dụng nhiều dòng tế bào gốc trưởng thành (adult stem cell lines) như là tế bào gốc trung mô (mesenchymal stem cells – MSCs) từ dây rốn hoặc tủy xương do tác động hệ bài tiết của chúng, các yếu tố tăng trưởng như nội mô mạch máu (vascular endothelial growth factor -VEGF), biến đổi beta (transforming growth factor - TGF-β), nguyên bào sợi (fibroblast growth factor – FGF), insulin yếu tố 1 (insulin growth factor 1 - IGF-1) có thể thúc đẩy sự phát triển của nang noãn (Marie và cs, 2020). Kết quả là sáu trường hợp mang thai đã được báo cáo sau khi truyền MSCs vào bệnh nhân bị POI. Hơn thế nữa, kỹ thuật nuôi trưởng thành noãn non (2 bước IVM) đã được thực hiện ở bé gái 5 tuổi nên có thể là một phương pháp bảo tồn sinh sản ở các bé gái trước tuổi dậy thì. Thế nhưng dữ liệu về giá trị và độ an toàn cùa kỹ thuật này ở bệnh nhân ung thư rất khan hiếm, chưa có thông tin về việc liệu tế bào noãn non trưởng thành trong ống nghiệm có kết quả tỉ lệ mang thai giống như các noãn trưởng thành sau đông lạnh. Vì vậy, đây có thể là một giải pháp thay thế an toàn trong tương lai cho phương pháp đông lạnh mô buồng trứng ở bệnh nhân ung thư buồng trứng hay bạch cầu lympho bào cấp (Maria và cs, 2021).
IVFMD - Tân Bình; Bệnh viện đa khoa Mỹ Đức
- Giới thiệu
- Các phương pháp bảo tồn sinh sản ở phụ nữ hiện nay
- Ức chế buồng trứng (ovarian suppression)
- Đông lạnh noãn (oocyte cryopreservation)
- Đông lạnh phôi (embryo cryopreservation)
Cả đông lạnh noãn và phôi đều có thể sử dụng cho những phụ nữ dưới 40 tuổi ngoại trừ những bệnh nhân mắc bệnh đông máu nghiêm trọng hoặc nguy cơ nhiễm trùng cao (Cobo và cs, 2018).
- Đông lạnh mô buồng trứng (ovarian tissue cryopreservation – OTC)

Hình 1. Phương pháp nuôi trưởng thành noãn thu từ mô buồng trứng OTO-IVM(Marie và cs, 2020)
Phương pháp OTC được chỉ định cho người bị hạn chế thời gian do sự tiến triển của khối u hoặc tình trạng sức khỏe của bệnh nhân, tối thiểu là những đối tượng nhỏ hơn 36 tuổi. Việc thu mẫu và cấy ghép mô buồng trứng được thực hiện bằng phương pháp nội soi và rủi ro phẫu thuật rất thấp và hiếm gặp biến chứng, chỉ khoảng 0,2-1,4% (Lambertini và cs, 2020). Đến nay, hơn 300 phụ nữ trên toàn thế giới đã trải qua thủ thuật và việc phục hồi chức năng buồng trứng đạt được ở 95% trường hợp trong vòng 4-9 tháng sau cấy ghép, trong đó khoảng 85% là những bệnh nhân sống sót sau ung thư (Lambertini và cs, 2020).
Với mục đích tối đa hóa các lựa chọn sinh sản trong tương lai cho bệnh nhân được chọn, phương pháp nuôi trưởng thành noãn non thu từ mô buồng trứng (Ovarian tissue oocyte in-vitro maturation - OTO-IVM) đã được nghiên cứu. OTO-IVM là thu nhận noãn chưa trưởng thành từ các nang thứ cấp nhỏ trên mô buồng trứng rồi cấy IVM. Lợi ích của giải pháp này là không phụ thuộc vào giai đoạn chu kỳ kinh nguyệt và không cần sử dụng gonadotropin để kích thích buồng trứng. Đây là lựa chọn duy nhất cho những bệnh nhân có nguy cơ tái phát tế bào ác tính cao khi cấy ghép mô buồng trứng (Ingrid và cs, 2020).
Hiệu quả của các phương pháp hiện nay
Các phương pháp bảo tồn sinh sản được sử dụng thông dụng nhất hiện nay là đông lạnh noãn, phôi và gần đây nhất là OTC. Nhiều báo cáo cho thấy tỉ lệ trẻ sinh ra thấp hơn sau khi đông lạnh noãn bằng thủy tinh hóa ở bệnh nhân sau điều trị ung thư có thể do dự trữ buồng trứng giảm và đáp ứng kém với các kích thích buồng trứng (Cobo và cs, 2018).
Ức chế buồng trứng tạm thời với phác đồ GnRH đồng vận trong quá trình hóa trị liệu nên được xem là một lựa chọn để ngăn chặn những tác động tiêu cực của hóa trị liệu ở bệnh nhân lớn tuổi. Tuy nhiên, các dữ liệu về trường hợp mang thai sau điều trị vẫn còn hạn chế cũng như các tác dụng phụ không mong muốn (khô âm đạo, thay đổi tâm trạng, trầm cảm, vô kinh và có thể gây ảnh hưởng đến phản ứng với điều trị ung thư ở các khối u nhạy cảm với estrogen) nên phác đồ này chưa thể là một biện pháp thay thế duy trì khả năng sinh sản thay cho các phương pháp đông lạnh noãn và mô (Maria và cs, 2021).
Đối với đông lạnh noãn, dữ liệu gần đây cho thấy tỉ lệ trẻ sinh sống tích lũy (cumulative live birth rate – CLBR) là 61,9% ở phụ nữ 35 tuổi và 43,4% ở phụ nữ trên 35 tuổi (Lambertini và cs, 2020). Tỉ lệ sử dụng noãn đông lạnh ở những bệnh nhân sống sót sau ung thư chỉ dưới 10% (Delattre và cs, 2020) và tỉ lệ trẻ sinh ra thấp hơn đáng kể khi sử dụng noãn tự thân so với những phụ nữ khỏe mạnh lần lượt là 24,7% và 47,7% (Luke và cs, 2018). Tỉ lệ trẻ sinh ra ở những người sống sót còn phụ thuộc vào loại ung thư mà họ mắc phải như là ung thư vú (14,3%) và cao nhất ở người có tiền sử ung thư hắc tố da (melanoma cancer) (53,5%). Điều đó cho thấy số lượng noãn được phục hồi ở bệnh nhân nữ bị ung thư làm giảm tỉ lệ thụ tinh và làm tổ, dẫn đến tỉ lệ sinh thấp hơn so với nhóm phụ nữ bình thường (Lambertini và cs, 2020).
Đối với đông lạnh phôi bằng phương pháp thủy tinh hóa, tỉ lệ sống của phôi giai đoạn phân chia sau đông lạnh là 90% và tỉ lệ thai lâm sàng là 25-40%. Đặc biệt ở phôi nang đông lạnh thì hai thông số này cải thiện hơn lần lượt là 96,5% và 46,1%, trong đó tỉ lệ làm tổ của phôi nang là 30,6% (Konc và cs, 2014). Vì vậy, đông lạnh phôi đang là lựa chọn chung của các bác sĩ lâm sàng khi tư vấn bệnh nhân bảo tồn sinh sản trong quá trình điều trị các bệnh lý.
Ở phương pháp OTC, các báo cáo gần đây cho thấy có khoảng 4% bệnh nhân ung thư sau cấy ghép mô buồng trứng bị tái phát bệnh và không liên quan đến quy trình cấy ghép (Gellert và cs, 2018). Một bài nghiên cứu của Ven và cộng sự cho thấy trong các ca cấy ghép đầu tiên ở bệnh nhân bị suy buồng trứng sớm (premature ovarian insufficiency – POI) trước đó, tỉ lệ hoạt động của mô sau cấy là 63%, tỉ lệ mang thai là 28% và trẻ sinh sống là 23% (Ven và cs, 2016). Hiện nay, kỹ thuật này đã cho ra đời hơn 180 trẻ khỏe mạnh với tỉ lệ lên đến 40% (Lambertini và cs, 2020).
Đến năm 2020, Ingrid và cộng sự đã chứng minh được tính hiệu quả của phương pháp OTO-IVM với 16% bệnh nhân sống sót sau ung thư, thể hiện ở tỉ lệ mang thai là 67% và tỉ lệ trẻ sinh ra là 25%. Ngoài ra, tỉ lệ noãn trưởng thành ở nhóm bé gái mắc bệnh ung thư (7-11 tuổi) trải qua OTO-IVM là 22% do buồng trứng của trẻ trước tuổi dậy thì chứa một số lượng lớn các nang bất thường khi so với buồng trứng của người trưởng thành là 42% (Ingrid và cs, 2020). Bên cạnh đó, bài tổng quan gần đây cho thấy tỉ lệ trưởng thành noãn của phương pháp OTO-IVM là 30-40%, tỉ lệ thụ tinh là 35-65% và 5 báo cáo về số trẻ sinh ra (Roo và cs, 2021).
Tuy nhiên, bên cạnh hiệu quả mà các phương pháp bảo tồn sinh sản mang lại thì vẫn có một số ảnh hưởng đặc biệt là các thủ thuật cấy ghép. Tác động gián tiếp của phản ứng stress oxy hóa (reactive oxygen species – ROS) trong mô buồng trứng cấy ghép cũng đã được nghiên cứu rộng rãi khi đánh giá các dấu hiệu tổn thương oxy hóa định lượng bằng phản ứng oxy hóa của mỡ. Việc sản xuất ROS quá mức có thể gây ra các biến đổi protein, lipid và DNA dẫn đến tổn thương tế bào. Bên cạnh đó, sự sống sót của các nang buồng trứng trong mô ghép phụ thuộc vào thời gian và mức độ của yếu tố tăng trưởng proangiogenic được tạo ra và điều phối trong quá trình tái tuần hoàn sau cấy ghép vì sự mất nang xảy ra trước khi tái thông hoàn toàn mô ghép và ảnh hưởng đến 50-90% nguồn dự trữ nang (Marie và cs, 2020). Nang noãn dường như nhạy cảm nhất với tình trạng thiếu oxy trong các giai đoạn phát triển vì nhu cầu trao đổi chất cao hơn trong khi nang nguyên thủy ít bị tổn thương hơn nhờ trạng thái bất hoạt của chúng nhưng sự giảm đáng kể các nang nguyên thủy đã được ghi nhận sau khi cấy ghép do hậu quả của giai đoạn thiếu máu cục bộ hoặc thiếu oxy. Hơn nữa, OTO-IVM là một kỹ thuật tương đối mới nên thiếu dữ liệu kết quả lâm sàng và việc theo dõi lâu dài những đứa trẻ được thụ thai sau phương pháp thử nghiệm này cần được thiết lập (Ingrid và cs, 2020).
Ngoài các biện pháp đông lạnh và cấy ghép thì một chiến lược khác đã được nghiên cứu để tăng cường chức năng buồng trứng là sử dụng nhiều dòng tế bào gốc trưởng thành (adult stem cell lines) như là tế bào gốc trung mô (mesenchymal stem cells – MSCs) từ dây rốn hoặc tủy xương do tác động hệ bài tiết của chúng, các yếu tố tăng trưởng như nội mô mạch máu (vascular endothelial growth factor -VEGF), biến đổi beta (transforming growth factor - TGF-β), nguyên bào sợi (fibroblast growth factor – FGF), insulin yếu tố 1 (insulin growth factor 1 - IGF-1) có thể thúc đẩy sự phát triển của nang noãn (Marie và cs, 2020). Kết quả là sáu trường hợp mang thai đã được báo cáo sau khi truyền MSCs vào bệnh nhân bị POI. Hơn thế nữa, kỹ thuật nuôi trưởng thành noãn non (2 bước IVM) đã được thực hiện ở bé gái 5 tuổi nên có thể là một phương pháp bảo tồn sinh sản ở các bé gái trước tuổi dậy thì. Thế nhưng dữ liệu về giá trị và độ an toàn cùa kỹ thuật này ở bệnh nhân ung thư rất khan hiếm, chưa có thông tin về việc liệu tế bào noãn non trưởng thành trong ống nghiệm có kết quả tỉ lệ mang thai giống như các noãn trưởng thành sau đông lạnh. Vì vậy, đây có thể là một giải pháp thay thế an toàn trong tương lai cho phương pháp đông lạnh mô buồng trứng ở bệnh nhân ung thư buồng trứng hay bạch cầu lympho bào cấp (Maria và cs, 2021).
- Kết luận
- Tài liệu tham khảo
- Cobo A, Garcia V.J, Domingo J và cộng sự (2018). Elective and Onco-fertility preservation: factors related to IVF outcomes. Human Reproduction.
- Delattre S, Segers I, Van Moer E. và cộng sự (2020). Combining fertility preservation procedures to spread the eggs across different baskets: a feasibility study. European Society of Human Reproduction and Embryology.
- Ingrid S, Erlisa B, Ileana M và cộng sự (2020). Live births following fertility preservation using in-vitro maturation of ovarian tissue oocytes. Human Reproduction.
- Konc J, Kanyo K, Kriston R và cộng sự (2014). Cryopreservation of embryos and oocytes in human assisted reproduction. BioMed Research International.
- Lambertini M, Peccatori F.A, Demeestere I và cộng sự (2020). Fertility preservation and post-treatment pregnancies in post-pubertal cancer patients: ESMO clinical practice guidelines. European Society for Medical Oncology.
- Luke B, Brown MB, Missmer S.A và cộng sự (2016). Assisted reproductive technology use and outcomes among women with a history of cancer. Human Reproduction.
- Marie-M.D, Jacques D. và Luciana C. (2020). Fertility preservation: the challenge of freezing and transplanting ovarian tissue. Reproductive and Sexual health.
- Maria L.S, Ana S.P và Teresa A.S. (2021). Fertility preservation in ovarian cancer patients. Gynecological Endocrinology.
- Roo C.D và Tilleman K. (2021). In vitro maturation of oocytes retrieved from ovarian tissue: outcomes from current approaches and future perspectives. Journal of clinical medicine.
- Ven H.V.D, Liebenthron J, Beckmann M và cộng sự (2016). Ninety-five orthotopic transplantations in 74 women of ovarian tissue after cytotoxic treatment in a fertility preservation network: tissue activity, pregnancy and delivery rates. Human Reproduction.
- Xueqi G, Hemei L và Yiqing Z. (2021). The improvement and clinical application of human oocyte in vitro maturation (IVM). Reproductive Sciences.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thành phố Đà Nẵng, thứ sáu và thứ bảy, ngày 6 - 7 . 3 . 2026
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








