Tin chuyên ngành
on Wednesday 09-02-2022 9:30am
Danh mục: Vô sinh & hỗ trợ sinh sản
BS Trần Trung Đức, BS Hồ Ngọc Anh Vũ
1. Al-Zubaidi, U., Adhikari, D., Cinar, O., Zhang, Q.-H., Yuen, W. S., Murphy, M. P., Rombauts, L., Robker, R. L., & Carroll, J. (2021). Mitochondria-targeted therapeutics, MitoQ and BGP-15, reverse aging-associated meiotic spindle defects in mouse and human oocytes. Human Reproduction, 36(3), 771–784. https://doi.org/10.1093/humrep/deaa300
2. Cozzolino, M., & Seli, E. (2020). Mitochondrial function in women with polycystic ovary syndrome. Current Opinion in Obstetrics & Gynecology, 32(3), 205–212. https://doi.org/10.1097/GCO.0000000000000619
3. Hardy, M. L. M., Day, M. L., & Morris, M. B. (2021). Redox Regulation and Oxidative Stress in Mammalian Oocytes and Embryos Developed In Vivo and In Vitro. International Journal of Environmental Research and Public Health, 18(21), 11374. https://doi.org/10.3390/ijerph182111374
4. Louwers, Y. V., Stolk, L., Uitterlinden, A. G., & Laven, J. S. E. (2013). Cross-ethnic meta-analysis of genetic variants for polycystic ovary syndrome. The Journal of Clinical Endocrinology and Metabolism, 98(12), E2006-2012. https://doi.org/10.1210/jc.2013-2495
5. Wang, L., Tang, J., Wang, L., Tan, F., Song, H., Zhou, J., & Li, F. (2021). Oxidative stress in oocyte aging and female reproduction. Journal of Cellular Physiology, 236(12), 7966–7983. https://doi.org/10.1002/jcp.30468
6. Zeng, X., Huang, Q., Long, S. lian, Zhong, Q., & Mo, Z. (2020). Mitochondrial Dysfunction in Polycystic Ovary Syndrome. DNA and Cell Biology, 39(8), 1401–1409. https://doi.org/10.1089/dna.2019.5172
7. Zhang, J., Bao, Y., Zhou, X., & Zheng, L. (2019). Polycystic ovary syndrome and mitochondrial dysfunction. Reproductive Biology and Endocrinology, 17(1), 67. https://doi.org/10.1186/s12958-019-0509-4
Đại học Y dược TP HCM
Phần 1 - Mối liên quan giữa HCBTĐN và chức năng ty thể.
TỔNG QUAN
Hội chứng buồng trứng đa nang (HCBTĐN) là một tình trạng rối loạn thần kinh, nội tiết, chuyển hoá toàn thân, ảnh hưởng đến khoảng 6 – 10% phụ nữ trong độ tuổi sinh sản (Louwers và cs., 2013).
Phụ nữ HCBTĐN có nhiều nguy cơ mắc đái tháo đường type 2, hội chứng chuyển hóa; các biến cố tim mạch: tăng huyết áp, rối loạn lipid máu; các bệnh phụ khoa: hiếm muộn, loạn sản nội mạc tử cung, ung thư nội mạc tử cung, các khối u ác tính ở buồng trứng; các biến chứng thai kỳ: sinh non, nhẹ cân và sản giật (Zhang và cs., 2019).
Tế bào noãn trưởng thành đòi hỏi số lượng bản sao DNA ty thể vô cùng lớn, khoảng 150.000 bản sao, đáp ứng với nhu cầu năng lượng dồi dào cho quá trình phát triển và trưởng thành. Bất thường về ty thể ảnh hưởng đến tổn thương DNA của noãn, giảm tỷ lệ thụ tinh và giảm chất lượng phôi.
QUÁ TRÌNH SẢN XUẤT CÁC GỐC OXY HÓA TỰ DO TRONG TY THỂ
Ở các tế bào nhân thực, ty thể là một bào quan chuyên sản xuất năng lượng trong điều kiện có oxy, quá trình này gọi là sự phosphoryl oxy hóa (Oxidative phosphorylation, OXPHOS). OXPHOS xảy ra thông qua một loạt chuỗi chuyền điện tử, các phản ứng oxy hóa khử và được xúc tác bởi các phức hợp protein ở màng trong ty thể. Chuỗi truyền điện tử rất phức tạp, bởi vì nó tạo ra các chất oxy hóa phản ứng (reactive oxygen species, ROS) như superoxide và hydrogen peroxide, các chất oxy hóa phản ứng này không ổn định và có khả năng gây độc cho tế bào. Tuy nhiên, ty thể vẫn có các cơ chế bảo vệ cơ thể, bằng cách kích hoạt một số chất chống oxy hóa.
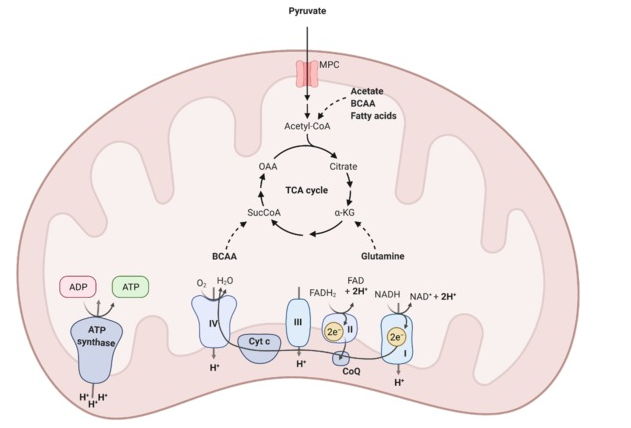
Các từ viết tắt: MPC: chất mang pyruvate của ty thể, SucCoa: succinyl-CoA, OAA: oxaloacetate, α-KG: alpha-ketoglutarate, CoQ: coenzyme Q, Cyt c: cytochrome c.
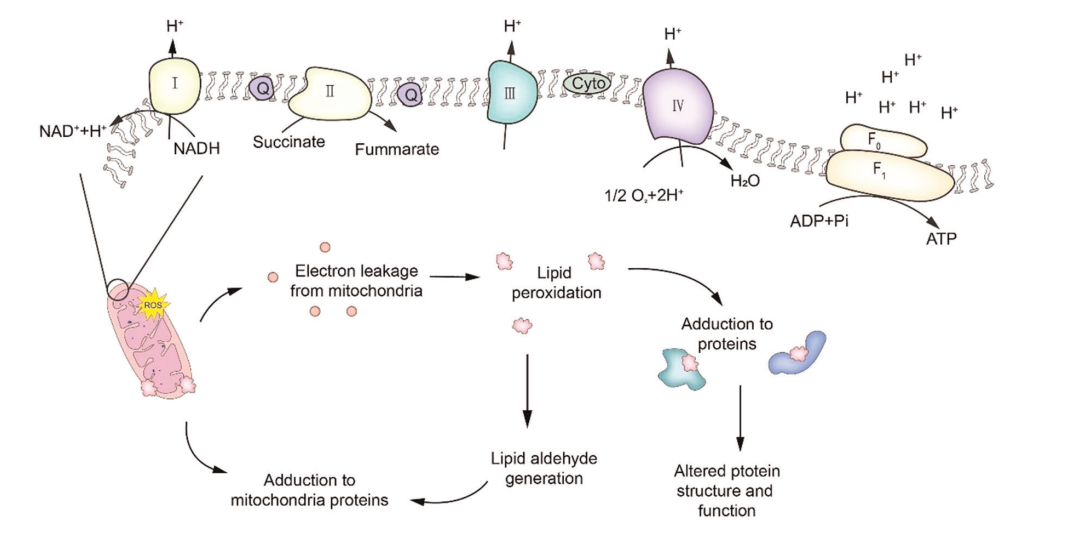
Hình 2: Chuỗi vận chuyển điện tử tham gia quá trình phosphoryl oxy hóa trong ti thể
Nhà máy thực hiện quá trình phosphoryl oxy hóa của màng trong ty thể được cấu tạo bởi năm enzym (phức hợp I–V; F0/F1).
BẤT THƯỜNG CHỨC NĂNG TY THỂ VÀ STRESS OXY HÓA
Các chất chống oxy hóa được phối hợp với nhau đáp ứng với sự thay đổi nồng độ các chất oxy hóa phản ứng. Có thể thấy, ở nồng độ thấp, ROS hoạt động như các phân tử tín hiệu liên quan đến các quá trình: tăng sinh tế bào, biệt hóa và tồn tại của tế bào. Ngược lại, ở nồng độ cao, ROS có thể phá hỏng, làm tổn thương vật chất di truyền tế bào (deoxyribonucleic acid: DNA), lipid và protein của tế bào. Từ đó, ROS kích hoạt các cơ chế chết theo chương trình (apoptosis). Ở buồng trứng, ROS đóng vai trò chính như là các phân tử tín hiệu, không chỉ cho quá trình mất các nang noãn sinh lý, mà còn liên quan đến sự phát triển các nang noãn và trưởng thành của các tế bào noãn. Tuy nhiên sự cân bằng giữa các chất oxy hóa phản ứng và các chất chống oxy hóa là vô cùng phức tạp. Có thể thấy những đợt tăng nồng độ ROS cấp tính giúp kích thích sự tăng trưởng tế bào hạt, trong khi đó, sự thay đổi đáng kể nồng độ chất chống oxy hóa cũng cần thiết để bảo vệ sự trưởng thành cuối cùng của tế bào noãn.
Bất thường hoạt động của ty thể khiến cho nồng độ các chất oxy hóa tăng cao, nồng độ các chất chống oxy hóa giảm, từ đó làm mất sự cân bằng giữa chất oxy hóa và chất chống oxy hóa, hoặc tạo ra các môi trường tiền viêm mãn tính có thể làm tăng nguy cơ hiếm muộn. Stress oxy hóa có thể gây ra rất nhiều hậu quả: Tổn thương DNA, protein và lipid trong ty thể (do tiếp xúc thường xuyên với các chất oxy hóa phản ứng, thiếu các histone bảo vệ và các cơ chế sửa chữa DNA), gây ra quá trình chết theo chương trình của tế bào, các nhiễm sắc thể không liên kết với nhau, thất bại trong quá trình thụ tinh và giảm chất lượng phôi (Wang và cs., 2021).
Stress oxy hóa gây phát triển nang noãn bất thường
Stres oxy hóa có thể là một trong các yếu tố khởi đầu cho quá trình chọn lọc nang noãn. Việc xóa các gene qui định chất chống oxy hóa ở buồng trứng có thể khiến cho quá trình phát triển nang noãn bất thường. Ví dụ: SOD1 hiện diện ở một nồng độ nhất định trong các giai đoạn trưởng thành của nang noãn. Phân tích mô học ở buồng trứng của những con chuột bị thiếu SOD1 thường thấy rất nhiều nang noãn sơ cấp, nhiều nang noãn kích thước nhỏ và rất ít nang noãn trưởng thành.
Stress oxy hóa ảnh hưởng lên giảm phân của noãn
Quá trình giảm phân của noãn dừng lại ở giảm phân 1 và sẽ tiếp tục sau khi có đỉnh LH. Tế bào noãn duy trì hình thái này trong nhiều tháng, thậm chí nhiều năm tùy theo loài. Yếu tố thúc đẩy trưởng thành (maturation promoting factor, MPF), một yếu tố quan trọng trong chu kỳ tế bào đảm nhận quá trình kiểm soát giảm phân của tế bào noãn. Kết quả cuối cùng của stress oxy hóa trong tế bào noãn có thể là sự tăng lên quá mức của MPF, cuối cùng dẫn đến bất thường giảm phân của tế bào noãn.
Nhiều nghiên cứu cho thấy tác động của nồng độ ROS cao trong các tế bào noãn còn ảnh hưởng đến nhiễm sắc thể. ROS còn tác động trên các vi ống, làm cho chúng gắn vào dị nhiễm sắc không chính xác, dẫn đến đột biến lệch bội nhiễm sắc thể, phân cực nhiễm sắc thể bất thường.
Stress oxy hóa làm ngắn dần các telomeres
Stress oxy hóa ảnh hưởng đến sự trưởng thành và chất lượng của tế bào noãn thông qua quá trình làm ngắn dần các telomeres. Telomeres là phức hợp protein – DNA đóng vai trò bảo vệ đầu mút nhiễm sắc thể. Nhiều nghiên cứu cho thấy tiếp xúc với các chất oxy hóa trong thời gian dài khiến cho tốc độ rút ngắn telomeres tăng cao, ngoài ra viêm mãn tính ở chuột cũng dẫn đến rối loạn chức năng của telomeres và lão hóa sớm. Đo chiều dài telomeres trong từng tế bào noãn và phôi, bằng cách định lượng huỳnh quang lai tai chỗ (Q-FISH) chứng tỏ rằng rối loạn chức năng ty thể gây tích tụ ROS và làm ngắn dần telomeres, cuối cùng ảnh hưởng đến nhiễm sắc thể và chết tế bào.
Stress oxy hóa gây lão hóa noãn sau phóng noãn
Một số nhóm nghiên cứu đã chứng minh rằng ROS – đặc biệt là hydrogen peroxide (H2O2), anion superoxide (O2-) và peroxynitrite (ONOO-) tích lũy trong tế bào noãn sau phóng noãn với nồng độ ngày càng tăng theo thời gian trong cả in vitro và in vivo. ROS được sản xuất trong quá trình giảm phân II của tế bào noãn, có thể xảy ra như một sản phẩm phụ của quá trình phosphoryl oxy hóa. Ngoài ra, các yếu tố môi trường mà tế bào noãn phải chịu đựng (ví dụ: tiếp xúc với ánh sáng, thiếu chất chống oxy hóa, tăng các stress oxy hóa, …) cũng được cho là tạo điều kiện thuận lợi cho việc sản xuất ROS (Hardy và cs., 2021).
Ảnh hưởng của ROS đến chức năng tế bào
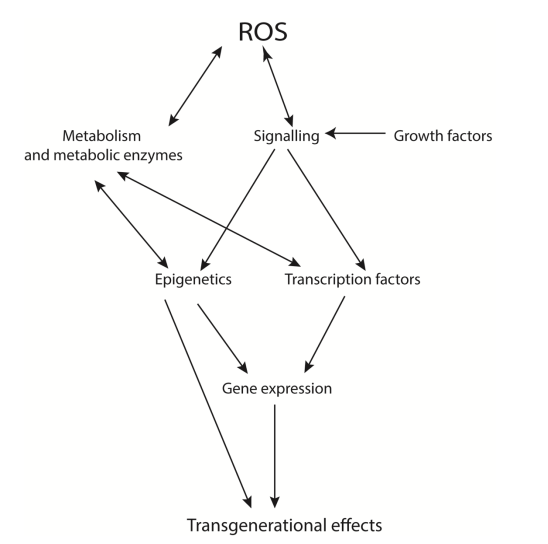
Quá trình sản xuất ROS có vô số tác dụng, có thể có lợi hoặc có hại. ROS được sản xuất dưới dạng “sản phẩm phụ” của quá trình phosphoryl oxy hóa (nguồn gốc từ quá trình chuyển hóa tế bào) và là kết quả của các con đường truyền tín hiệu tế bào khác nhau, bao gồm nhiều con đường được kích hoạt bởi các yếu tố tăng trưởng. Chúng cũng có thể ảnh hưởng trực tiếp đến hoạt động của các thành phần trong lộ trình tín hiệu, các enzyme chuyển hóa, dẫn đến những thay đổi trong quá trình trao đổi chất của tế bào và sử dụng năng lượng. Khi đó, những thay đổi trong quá trình trao đổi chất và tín hiệu có thể dẫn đến những thay đổi trong biểu hiện gene, yếu tố phiên mã, dịch mã.
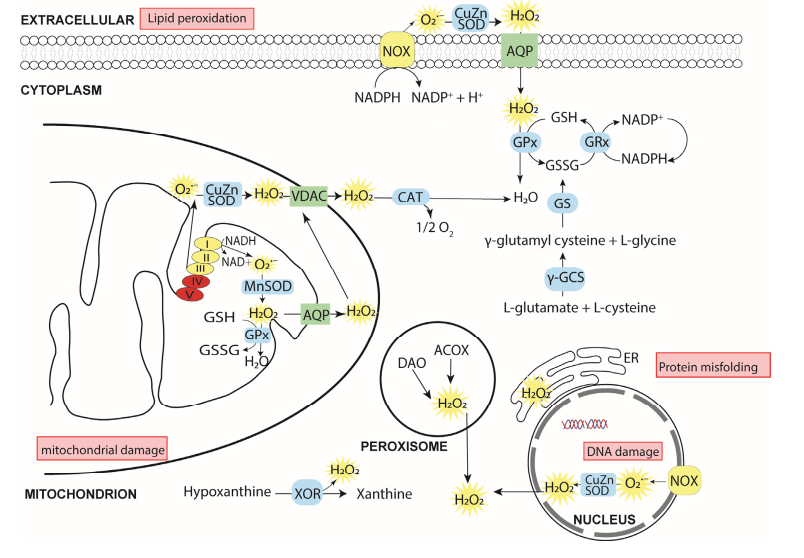
Hình 4: Nguồn gốc ROS trong tế bào và các chất chống oxy hóa
Nhiều enzyme trong tế bào (các đĩa màu vàng) tạo ra ROS (các mặt trời màu vàng), có nồng độ được kiểm soát bởi một hệ thống các chất chống oxy hóa (chỉ đề cập tới GSH) và các enzyme chống oxy hóa (các đĩa màu xanh lam). Nguồn chính là NOX, phức hợp I-III của chuỗi vận chuyển điện tử trong ty thể và các enzyme khác (không được trình bày) chẳng hạn như proline oxidase được kết hợp với phức hợp II. Tín hiệu ROS chính là phân tử H2O2 (nồng độ sinh lý khoảng 1-10 nM). Sự suy giảm oxy hóa xảy ra khi hệ thống chống oxy hóa không thể duy trì nồng độ nội môi của ROS, có thể dẫn đến các rối loạn chức năng tế bào: ngừng tăng trưởng và chết theo chương trình.
Các từ viết tắt: ACOX: acyl coenzym A oxidase; AQP: aquaporin; CAT: catalase, CuZnSOD: đồng-kẽm superoxide dismutase; DAO: diamine oxidase; γ-GCS: γ-glutamyl cysteine synthetase; GPx: glutathione peroxidase; GRx: glutathione reductase; GS: glutathione synthetase; MnSOD: mangan superoxide dismutase; NOX: NADPH oxidase; VDAC: kênh anion phụ thuộc điện áp; XOR: xanthine oxidoreductase.
Mối liên quan giữa ROS và ion Ca2+
ROS và Ca2+ có mối quan hệ với nhau. Ca2+ chủ yếu được lưu trữ trong các tế bào ở mạng lưới nội sinh chất (endoplasmic reticulum, ER) và giải phóng Ca2+ vào tế bào chất tham gia vào nhiều hoạt động của tế bào. Sự giải phóng Ca2+ trong tế bào chất cũng ảnh hưởng trực tiếp đến nồng độ Ca2+ trong ty thể, do sự tương hợp cả về hình thái và chức năng của các kênh Ca2+ trong ER và ty thể (ví dụ: IP3R và VDAC). Sự gia tăng Ca2+ trong tế bào do giải phóng qua IP3R gây tăng Ca2+ trong ty thể, kích hoạt quá trình OXPHOS và do đó ROS được sản xuất. Ca2+ cũng kích hoạt MnSOD, giúp giảm thiểu sự tích tụ ROS quá mức và duy trì cân bằng nội môi ROS. Tuy nhiên, sự gia tăng bền vững của Ca2+ trong tế bào do ROS gây ra có thể làm rối loạn việc chuyển Ca2+ từ ER đến ty thể, gây ra rối loạn chức năng ty thể và quá trình apoptosis xảy ra. Ngoài ra, quá trình oxy hóa gây ra các sửa chữa sau dịch mã của các protein chịu trách nhiệm cho tín hiệu Ca2+. Ví dụ, chất oxy hóa Thiol và ROS có thể ức chế hoạt động của lưới nội sinh chất Ca2+- transport ATPase (SERCA), ngăn cản sự hấp thu Ca2+ vào ER và phục hồi nồng độ Ca2+ trong tế bào.
Stress oxy hóa ảnh hưởng sự trưởng thành, thụ tinh và phát triển phôi
Sự trưởng thành của tế bào noãn, sự thụ tinh và sự phát triển của phôi trong hệ thống sinh sản diễn ra trong một môi trường rất phức tạp bao gồm các yếu tố từ mẹ, từ chính tế bào noãn và phôi. Trong quá trình hình thành nang noãn, có sự suy giảm mức độ stress oxy hóa trong dịch nang. Vào khoảng thời gian phóng noãn, lưu lượng máu đến buồng trứng giảm, do đó làm cho tế bào noãn giảm mức độ stress oxy hóa từ giai đoạn nang noãn sơ cấp đến thời điểm phóng noãn. Cũng có sự giảm stress oxy hóa từ đoạn bóng của ống dẫn trứng (~ 8%)- nơi diễn ra quá trình thụ tinh, đến tử cung (~ 2%) - vị trí làm tổ (Hình 3). ROS được tạo theo những tình trạng này, đôi khi trong những đợt bùng phát cấp tính cần thiết cho sự tiến triển của tế bào noãn, nói chung, nồng độ ROS thường được duy trì trong mức độ hằng định (Hardy và cs., 2021).
Insulin là chất điều hòa chính của quá trình phosphoryl oxy hóa, có thể ảnh hưởng trực tiếp đến chức năng của ty thể. Ngược lại, ty thể đóng một vai trò quan trọng trong chức năng bình thường của insulin. Hiệu quả giảm của insulin bắt nguồn từ việc tăng ROS, có thể gây ra sự kích hoạt bất thường của các con đường tín hiệu serine/threonine kinase, tăng phosphoryl hóa của các thụ thể insulin và protein cơ chất của thụ thể insulin (IRS). Theo đó, suy giảm chức năng ty thể có thể là lý do chính gây ra các biến chứng liên quan đến IR và HCBTĐN (Cozzolino & Seli, 2020).
Cường androgen (Hyperandrogenism, HA)
Cường androgen và chức năng ty thể bất thường có sự tương tác với nhau. Tiếp xúc quá mức với androgen gây ra IR ở chuột cái bằng cách gây ra hiện tượng tăng stress oxy hóa và suy tế bào beta tuyến tụy và có thể là nguyên nhân dẫn đến sự xuất hiện nhiều IR ở bệnh nhân HCBTĐN. Androgen có thể gây ra rối loạn chức năng ty thể trong ống nghiệm và gây ra suy tế bào beta bằng cách phụ thuộc vào thụ thể androgen (Cozzolino & Seli, 2020).
Rối loạn chuyển hóa lipid và tình trạng thừa cân - béo phì
Khoảng 50% bệnh nhân HCBTĐN bị thừa cân hoặc béo phì. Béo phì có tác động tiêu cực đến khả năng sinh sản của phụ nữ, làm tăng đề kháng insulin, cường androgen, ảnh hưởng phóng noãn, gây sẩy thai và một số biến chứng thai kỳ. Tăng stress oxy hóa có thể gây béo phì bằng cách thúc đẩy tăng sinh tiền tế bào mỡ và biệt hóa tế bào mỡ, kích thích tế bào thần kinh vùng hạ đồi để giảm cảm giác no và tăng cảm giác đói. Trong điều kiện béo phì, sự tích tụ ngày càng tăng của lipid và axit béo trong buồng trứng, tế bào noãn và các tế bào xung quanh làm rối loạn trao đổi chất, cản trở chức năng của ty thể và giảm chất lượng tế bào noãn (Zeng và cs., 2020).
Giảm cân có thể đảo ngược tình trạng rối loạn chức năng ty thể. Giảm cân là phương pháp điều trị đầu tiên được khuyến nghị cho bệnh nhân béo phì với HCBTĐN. Sự cải thiện mạnh mẽ các triệu chứng HCBTĐN sau khi giảm cân một phần có thể xuất phát từ việc giảm sản xuất ROS và nâng cao mức độ chống oxy hóa.
TÀI LIỆU THAM KHẢOPhần 1 - Mối liên quan giữa HCBTĐN và chức năng ty thể.
TỔNG QUAN
Hội chứng buồng trứng đa nang (HCBTĐN) là một tình trạng rối loạn thần kinh, nội tiết, chuyển hoá toàn thân, ảnh hưởng đến khoảng 6 – 10% phụ nữ trong độ tuổi sinh sản (Louwers và cs., 2013).
Phụ nữ HCBTĐN có nhiều nguy cơ mắc đái tháo đường type 2, hội chứng chuyển hóa; các biến cố tim mạch: tăng huyết áp, rối loạn lipid máu; các bệnh phụ khoa: hiếm muộn, loạn sản nội mạc tử cung, ung thư nội mạc tử cung, các khối u ác tính ở buồng trứng; các biến chứng thai kỳ: sinh non, nhẹ cân và sản giật (Zhang và cs., 2019).
Tế bào noãn trưởng thành đòi hỏi số lượng bản sao DNA ty thể vô cùng lớn, khoảng 150.000 bản sao, đáp ứng với nhu cầu năng lượng dồi dào cho quá trình phát triển và trưởng thành. Bất thường về ty thể ảnh hưởng đến tổn thương DNA của noãn, giảm tỷ lệ thụ tinh và giảm chất lượng phôi.
QUÁ TRÌNH SẢN XUẤT CÁC GỐC OXY HÓA TỰ DO TRONG TY THỂ
Ở các tế bào nhân thực, ty thể là một bào quan chuyên sản xuất năng lượng trong điều kiện có oxy, quá trình này gọi là sự phosphoryl oxy hóa (Oxidative phosphorylation, OXPHOS). OXPHOS xảy ra thông qua một loạt chuỗi chuyền điện tử, các phản ứng oxy hóa khử và được xúc tác bởi các phức hợp protein ở màng trong ty thể. Chuỗi truyền điện tử rất phức tạp, bởi vì nó tạo ra các chất oxy hóa phản ứng (reactive oxygen species, ROS) như superoxide và hydrogen peroxide, các chất oxy hóa phản ứng này không ổn định và có khả năng gây độc cho tế bào. Tuy nhiên, ty thể vẫn có các cơ chế bảo vệ cơ thể, bằng cách kích hoạt một số chất chống oxy hóa.

Hình 1: Ty thể: Chu trình Tricarboxylic Acid (TCA) và chuỗi truyền điện tử
Pyruvate được tạo ra trong quá trình đường phân được đưa vào ty thể và tiếp tục bị oxy hóa trong chu trình TCA để tạo ra các chất mang điện tử NADH và FADH2.Các từ viết tắt: MPC: chất mang pyruvate của ty thể, SucCoa: succinyl-CoA, OAA: oxaloacetate, α-KG: alpha-ketoglutarate, CoQ: coenzyme Q, Cyt c: cytochrome c.

Hình 2: Chuỗi vận chuyển điện tử tham gia quá trình phosphoryl oxy hóa trong ti thể
BẤT THƯỜNG CHỨC NĂNG TY THỂ VÀ STRESS OXY HÓA
Các chất chống oxy hóa được phối hợp với nhau đáp ứng với sự thay đổi nồng độ các chất oxy hóa phản ứng. Có thể thấy, ở nồng độ thấp, ROS hoạt động như các phân tử tín hiệu liên quan đến các quá trình: tăng sinh tế bào, biệt hóa và tồn tại của tế bào. Ngược lại, ở nồng độ cao, ROS có thể phá hỏng, làm tổn thương vật chất di truyền tế bào (deoxyribonucleic acid: DNA), lipid và protein của tế bào. Từ đó, ROS kích hoạt các cơ chế chết theo chương trình (apoptosis). Ở buồng trứng, ROS đóng vai trò chính như là các phân tử tín hiệu, không chỉ cho quá trình mất các nang noãn sinh lý, mà còn liên quan đến sự phát triển các nang noãn và trưởng thành của các tế bào noãn. Tuy nhiên sự cân bằng giữa các chất oxy hóa phản ứng và các chất chống oxy hóa là vô cùng phức tạp. Có thể thấy những đợt tăng nồng độ ROS cấp tính giúp kích thích sự tăng trưởng tế bào hạt, trong khi đó, sự thay đổi đáng kể nồng độ chất chống oxy hóa cũng cần thiết để bảo vệ sự trưởng thành cuối cùng của tế bào noãn.
Bất thường hoạt động của ty thể khiến cho nồng độ các chất oxy hóa tăng cao, nồng độ các chất chống oxy hóa giảm, từ đó làm mất sự cân bằng giữa chất oxy hóa và chất chống oxy hóa, hoặc tạo ra các môi trường tiền viêm mãn tính có thể làm tăng nguy cơ hiếm muộn. Stress oxy hóa có thể gây ra rất nhiều hậu quả: Tổn thương DNA, protein và lipid trong ty thể (do tiếp xúc thường xuyên với các chất oxy hóa phản ứng, thiếu các histone bảo vệ và các cơ chế sửa chữa DNA), gây ra quá trình chết theo chương trình của tế bào, các nhiễm sắc thể không liên kết với nhau, thất bại trong quá trình thụ tinh và giảm chất lượng phôi (Wang và cs., 2021).
Stress oxy hóa gây phát triển nang noãn bất thường
Stres oxy hóa có thể là một trong các yếu tố khởi đầu cho quá trình chọn lọc nang noãn. Việc xóa các gene qui định chất chống oxy hóa ở buồng trứng có thể khiến cho quá trình phát triển nang noãn bất thường. Ví dụ: SOD1 hiện diện ở một nồng độ nhất định trong các giai đoạn trưởng thành của nang noãn. Phân tích mô học ở buồng trứng của những con chuột bị thiếu SOD1 thường thấy rất nhiều nang noãn sơ cấp, nhiều nang noãn kích thước nhỏ và rất ít nang noãn trưởng thành.
Stress oxy hóa ảnh hưởng lên giảm phân của noãn
Quá trình giảm phân của noãn dừng lại ở giảm phân 1 và sẽ tiếp tục sau khi có đỉnh LH. Tế bào noãn duy trì hình thái này trong nhiều tháng, thậm chí nhiều năm tùy theo loài. Yếu tố thúc đẩy trưởng thành (maturation promoting factor, MPF), một yếu tố quan trọng trong chu kỳ tế bào đảm nhận quá trình kiểm soát giảm phân của tế bào noãn. Kết quả cuối cùng của stress oxy hóa trong tế bào noãn có thể là sự tăng lên quá mức của MPF, cuối cùng dẫn đến bất thường giảm phân của tế bào noãn.
Nhiều nghiên cứu cho thấy tác động của nồng độ ROS cao trong các tế bào noãn còn ảnh hưởng đến nhiễm sắc thể. ROS còn tác động trên các vi ống, làm cho chúng gắn vào dị nhiễm sắc không chính xác, dẫn đến đột biến lệch bội nhiễm sắc thể, phân cực nhiễm sắc thể bất thường.
Stress oxy hóa làm ngắn dần các telomeres
Stress oxy hóa ảnh hưởng đến sự trưởng thành và chất lượng của tế bào noãn thông qua quá trình làm ngắn dần các telomeres. Telomeres là phức hợp protein – DNA đóng vai trò bảo vệ đầu mút nhiễm sắc thể. Nhiều nghiên cứu cho thấy tiếp xúc với các chất oxy hóa trong thời gian dài khiến cho tốc độ rút ngắn telomeres tăng cao, ngoài ra viêm mãn tính ở chuột cũng dẫn đến rối loạn chức năng của telomeres và lão hóa sớm. Đo chiều dài telomeres trong từng tế bào noãn và phôi, bằng cách định lượng huỳnh quang lai tai chỗ (Q-FISH) chứng tỏ rằng rối loạn chức năng ty thể gây tích tụ ROS và làm ngắn dần telomeres, cuối cùng ảnh hưởng đến nhiễm sắc thể và chết tế bào.
Stress oxy hóa gây lão hóa noãn sau phóng noãn
Một số nhóm nghiên cứu đã chứng minh rằng ROS – đặc biệt là hydrogen peroxide (H2O2), anion superoxide (O2-) và peroxynitrite (ONOO-) tích lũy trong tế bào noãn sau phóng noãn với nồng độ ngày càng tăng theo thời gian trong cả in vitro và in vivo. ROS được sản xuất trong quá trình giảm phân II của tế bào noãn, có thể xảy ra như một sản phẩm phụ của quá trình phosphoryl oxy hóa. Ngoài ra, các yếu tố môi trường mà tế bào noãn phải chịu đựng (ví dụ: tiếp xúc với ánh sáng, thiếu chất chống oxy hóa, tăng các stress oxy hóa, …) cũng được cho là tạo điều kiện thuận lợi cho việc sản xuất ROS (Hardy và cs., 2021).
Ảnh hưởng của ROS đến chức năng tế bào

Hình 3: Ảnh hưởng của ROS đến chức năng tế bào
Quá trình sản xuất ROS có vô số tác dụng, có thể có lợi hoặc có hại. ROS được sản xuất dưới dạng “sản phẩm phụ” của quá trình phosphoryl oxy hóa (nguồn gốc từ quá trình chuyển hóa tế bào) và là kết quả của các con đường truyền tín hiệu tế bào khác nhau, bao gồm nhiều con đường được kích hoạt bởi các yếu tố tăng trưởng. Chúng cũng có thể ảnh hưởng trực tiếp đến hoạt động của các thành phần trong lộ trình tín hiệu, các enzyme chuyển hóa, dẫn đến những thay đổi trong quá trình trao đổi chất của tế bào và sử dụng năng lượng. Khi đó, những thay đổi trong quá trình trao đổi chất và tín hiệu có thể dẫn đến những thay đổi trong biểu hiện gene, yếu tố phiên mã, dịch mã.

Hình 4: Nguồn gốc ROS trong tế bào và các chất chống oxy hóa
Nhiều enzyme trong tế bào (các đĩa màu vàng) tạo ra ROS (các mặt trời màu vàng), có nồng độ được kiểm soát bởi một hệ thống các chất chống oxy hóa (chỉ đề cập tới GSH) và các enzyme chống oxy hóa (các đĩa màu xanh lam). Nguồn chính là NOX, phức hợp I-III của chuỗi vận chuyển điện tử trong ty thể và các enzyme khác (không được trình bày) chẳng hạn như proline oxidase được kết hợp với phức hợp II. Tín hiệu ROS chính là phân tử H2O2 (nồng độ sinh lý khoảng 1-10 nM). Sự suy giảm oxy hóa xảy ra khi hệ thống chống oxy hóa không thể duy trì nồng độ nội môi của ROS, có thể dẫn đến các rối loạn chức năng tế bào: ngừng tăng trưởng và chết theo chương trình.
Các từ viết tắt: ACOX: acyl coenzym A oxidase; AQP: aquaporin; CAT: catalase, CuZnSOD: đồng-kẽm superoxide dismutase; DAO: diamine oxidase; γ-GCS: γ-glutamyl cysteine synthetase; GPx: glutathione peroxidase; GRx: glutathione reductase; GS: glutathione synthetase; MnSOD: mangan superoxide dismutase; NOX: NADPH oxidase; VDAC: kênh anion phụ thuộc điện áp; XOR: xanthine oxidoreductase.
Mối liên quan giữa ROS và ion Ca2+
ROS và Ca2+ có mối quan hệ với nhau. Ca2+ chủ yếu được lưu trữ trong các tế bào ở mạng lưới nội sinh chất (endoplasmic reticulum, ER) và giải phóng Ca2+ vào tế bào chất tham gia vào nhiều hoạt động của tế bào. Sự giải phóng Ca2+ trong tế bào chất cũng ảnh hưởng trực tiếp đến nồng độ Ca2+ trong ty thể, do sự tương hợp cả về hình thái và chức năng của các kênh Ca2+ trong ER và ty thể (ví dụ: IP3R và VDAC). Sự gia tăng Ca2+ trong tế bào do giải phóng qua IP3R gây tăng Ca2+ trong ty thể, kích hoạt quá trình OXPHOS và do đó ROS được sản xuất. Ca2+ cũng kích hoạt MnSOD, giúp giảm thiểu sự tích tụ ROS quá mức và duy trì cân bằng nội môi ROS. Tuy nhiên, sự gia tăng bền vững của Ca2+ trong tế bào do ROS gây ra có thể làm rối loạn việc chuyển Ca2+ từ ER đến ty thể, gây ra rối loạn chức năng ty thể và quá trình apoptosis xảy ra. Ngoài ra, quá trình oxy hóa gây ra các sửa chữa sau dịch mã của các protein chịu trách nhiệm cho tín hiệu Ca2+. Ví dụ, chất oxy hóa Thiol và ROS có thể ức chế hoạt động của lưới nội sinh chất Ca2+- transport ATPase (SERCA), ngăn cản sự hấp thu Ca2+ vào ER và phục hồi nồng độ Ca2+ trong tế bào.

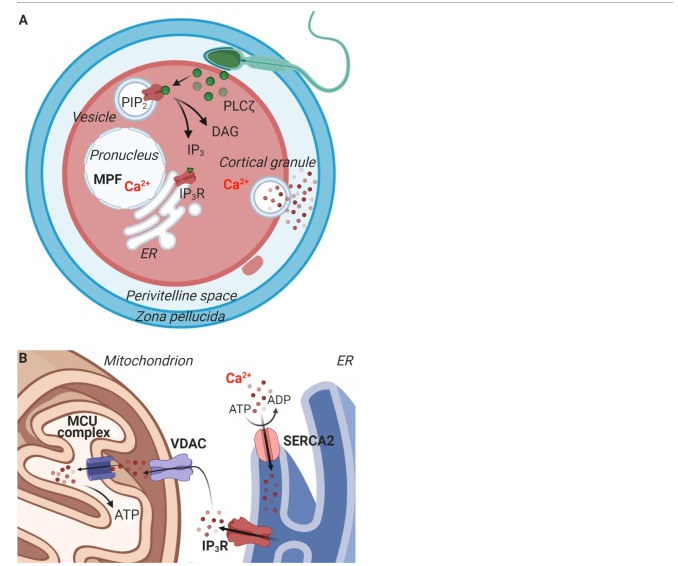
Hình 6: Sơ đồ quá trình giải phóng và hấp thụ Ca2+
A. Thể hiện quá trình giải phóng Ca2+ và hoạt hóa tế bào noãn ở thời điểm thụ tinh. PLCζ được phóng thích từ tinh trùng vào tế bào chất sau khi hợp nhất giữa màng tế bào của tinh trùng và tế bào noãn. Các túi mang PIP2 có trong tế bào chất và PLCζ thủy phân PIP2 thành các sản phẩm là DAG và IP3. IP3 liên kết với IP3-R trong màng của ER. Các ion Ca2+ đóng vai trò thiết yếu trong hoạt hóa tế bào noãn. Hơn nữa, các ion Ca2+ rất quan trọng đối với việc phục hồi giảm phân khi các yếu tố MPF không hoạt động. Người ta đã báo cáo rằng các tế bào noãn già có nồng độ Ca2+ dự trữ trong ER thấp hơn.
B. Sơ đồ về sự hấp thu Ca2+ tại vị trí tiếp xúc giữa ti thể và ER.
Từ viết tắt: PLCζ = phospholipase C zeta, PIP2 = phosphatidylinositol 4,5-bisphosphate, IP3 = inositol1,4,5-trisphosphate, DAG = diacylglycerol, IP3-R = inositol 1,4,5-trisphosphate receptor, Ca2+ = calcium ion, ER = lưới nội sinh chất, MPF: yếu tố kích thích phát triển.A. Thể hiện quá trình giải phóng Ca2+ và hoạt hóa tế bào noãn ở thời điểm thụ tinh. PLCζ được phóng thích từ tinh trùng vào tế bào chất sau khi hợp nhất giữa màng tế bào của tinh trùng và tế bào noãn. Các túi mang PIP2 có trong tế bào chất và PLCζ thủy phân PIP2 thành các sản phẩm là DAG và IP3. IP3 liên kết với IP3-R trong màng của ER. Các ion Ca2+ đóng vai trò thiết yếu trong hoạt hóa tế bào noãn. Hơn nữa, các ion Ca2+ rất quan trọng đối với việc phục hồi giảm phân khi các yếu tố MPF không hoạt động. Người ta đã báo cáo rằng các tế bào noãn già có nồng độ Ca2+ dự trữ trong ER thấp hơn.
B. Sơ đồ về sự hấp thu Ca2+ tại vị trí tiếp xúc giữa ti thể và ER.
Stress oxy hóa ảnh hưởng sự trưởng thành, thụ tinh và phát triển phôi
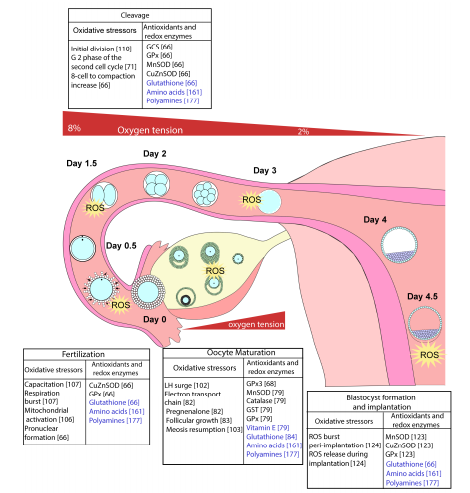
Sự trưởng thành của tế bào noãn, sự thụ tinh và sự phát triển của phôi trong hệ thống sinh sản diễn ra trong một môi trường rất phức tạp bao gồm các yếu tố từ mẹ, từ chính tế bào noãn và phôi. Trong quá trình hình thành nang noãn, có sự suy giảm mức độ stress oxy hóa trong dịch nang. Vào khoảng thời gian phóng noãn, lưu lượng máu đến buồng trứng giảm, do đó làm cho tế bào noãn giảm mức độ stress oxy hóa từ giai đoạn nang noãn sơ cấp đến thời điểm phóng noãn. Cũng có sự giảm stress oxy hóa từ đoạn bóng của ống dẫn trứng (~ 8%)- nơi diễn ra quá trình thụ tinh, đến tử cung (~ 2%) - vị trí làm tổ (Hình 3). ROS được tạo theo những tình trạng này, đôi khi trong những đợt bùng phát cấp tính cần thiết cho sự tiến triển của tế bào noãn, nói chung, nồng độ ROS thường được duy trì trong mức độ hằng định (Hardy và cs., 2021).

Hình 7: Nguồn cung cấp ROS và các chất chống oxy hóa của quá trình
phát triển phôi trong ống nghiệm
BẤT THƯỜNG CHỨC NĂNG TY THỂ VÀ RỐI LOẠN CHUYỂN HOÁ
Đề kháng insulin (insulin resistance, IR)phát triển phôi trong ống nghiệm
BẤT THƯỜNG CHỨC NĂNG TY THỂ VÀ RỐI LOẠN CHUYỂN HOÁ
Insulin là chất điều hòa chính của quá trình phosphoryl oxy hóa, có thể ảnh hưởng trực tiếp đến chức năng của ty thể. Ngược lại, ty thể đóng một vai trò quan trọng trong chức năng bình thường của insulin. Hiệu quả giảm của insulin bắt nguồn từ việc tăng ROS, có thể gây ra sự kích hoạt bất thường của các con đường tín hiệu serine/threonine kinase, tăng phosphoryl hóa của các thụ thể insulin và protein cơ chất của thụ thể insulin (IRS). Theo đó, suy giảm chức năng ty thể có thể là lý do chính gây ra các biến chứng liên quan đến IR và HCBTĐN (Cozzolino & Seli, 2020).
Cường androgen (Hyperandrogenism, HA)
Cường androgen và chức năng ty thể bất thường có sự tương tác với nhau. Tiếp xúc quá mức với androgen gây ra IR ở chuột cái bằng cách gây ra hiện tượng tăng stress oxy hóa và suy tế bào beta tuyến tụy và có thể là nguyên nhân dẫn đến sự xuất hiện nhiều IR ở bệnh nhân HCBTĐN. Androgen có thể gây ra rối loạn chức năng ty thể trong ống nghiệm và gây ra suy tế bào beta bằng cách phụ thuộc vào thụ thể androgen (Cozzolino & Seli, 2020).
Rối loạn chuyển hóa lipid và tình trạng thừa cân - béo phì
Khoảng 50% bệnh nhân HCBTĐN bị thừa cân hoặc béo phì. Béo phì có tác động tiêu cực đến khả năng sinh sản của phụ nữ, làm tăng đề kháng insulin, cường androgen, ảnh hưởng phóng noãn, gây sẩy thai và một số biến chứng thai kỳ. Tăng stress oxy hóa có thể gây béo phì bằng cách thúc đẩy tăng sinh tiền tế bào mỡ và biệt hóa tế bào mỡ, kích thích tế bào thần kinh vùng hạ đồi để giảm cảm giác no và tăng cảm giác đói. Trong điều kiện béo phì, sự tích tụ ngày càng tăng của lipid và axit béo trong buồng trứng, tế bào noãn và các tế bào xung quanh làm rối loạn trao đổi chất, cản trở chức năng của ty thể và giảm chất lượng tế bào noãn (Zeng và cs., 2020).
Giảm cân có thể đảo ngược tình trạng rối loạn chức năng ty thể. Giảm cân là phương pháp điều trị đầu tiên được khuyến nghị cho bệnh nhân béo phì với HCBTĐN. Sự cải thiện mạnh mẽ các triệu chứng HCBTĐN sau khi giảm cân một phần có thể xuất phát từ việc giảm sản xuất ROS và nâng cao mức độ chống oxy hóa.
1. Al-Zubaidi, U., Adhikari, D., Cinar, O., Zhang, Q.-H., Yuen, W. S., Murphy, M. P., Rombauts, L., Robker, R. L., & Carroll, J. (2021). Mitochondria-targeted therapeutics, MitoQ and BGP-15, reverse aging-associated meiotic spindle defects in mouse and human oocytes. Human Reproduction, 36(3), 771–784. https://doi.org/10.1093/humrep/deaa300
2. Cozzolino, M., & Seli, E. (2020). Mitochondrial function in women with polycystic ovary syndrome. Current Opinion in Obstetrics & Gynecology, 32(3), 205–212. https://doi.org/10.1097/GCO.0000000000000619
3. Hardy, M. L. M., Day, M. L., & Morris, M. B. (2021). Redox Regulation and Oxidative Stress in Mammalian Oocytes and Embryos Developed In Vivo and In Vitro. International Journal of Environmental Research and Public Health, 18(21), 11374. https://doi.org/10.3390/ijerph182111374
4. Louwers, Y. V., Stolk, L., Uitterlinden, A. G., & Laven, J. S. E. (2013). Cross-ethnic meta-analysis of genetic variants for polycystic ovary syndrome. The Journal of Clinical Endocrinology and Metabolism, 98(12), E2006-2012. https://doi.org/10.1210/jc.2013-2495
5. Wang, L., Tang, J., Wang, L., Tan, F., Song, H., Zhou, J., & Li, F. (2021). Oxidative stress in oocyte aging and female reproduction. Journal of Cellular Physiology, 236(12), 7966–7983. https://doi.org/10.1002/jcp.30468
6. Zeng, X., Huang, Q., Long, S. lian, Zhong, Q., & Mo, Z. (2020). Mitochondrial Dysfunction in Polycystic Ovary Syndrome. DNA and Cell Biology, 39(8), 1401–1409. https://doi.org/10.1089/dna.2019.5172
7. Zhang, J., Bao, Y., Zhou, X., & Zheng, L. (2019). Polycystic ovary syndrome and mitochondrial dysfunction. Reproductive Biology and Endocrinology, 17(1), 67. https://doi.org/10.1186/s12958-019-0509-4
Xem tiếp Phần 2 - Điều trị nhắm trúng đích ty thể và sử dụng các chất chống oxy hóa (TẠI ĐÂY)
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thành phố Đà Nẵng, thứ sáu và thứ bảy, ngày 6 - 7 . 3 . 2026
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








