Đặng Huệ Anh, Hồ Mạnh Tường
ĐẶT VẤN ĐỀ
Những nguyên nhân phổ biến gây vô sinh ở nam giới là do bất thường quá trình sản xuất tinh trùng, chức năng tinh trùng hay tắc nghẽn ống dẫn tinh. Thêm vào đó, các tác động của thuốc lá, marijuana, rượu bia và các chất kích thích… chủ yếu ở nam giới luôn là mối đe doạ trong hiếm muộn. Từ khi ra đời năm 1992, kỹ thuật tiêm tinh trùng vào bào tương noãn là phương pháp hiệu quả nhất trong điều trị hiếm muộn do nam giới.
Xét nhiệm tinh dịch đồ là một trong những bước đầu tiên quan trọng của tất cả các phương pháp điều trị, đặc biệt là ICSI. Những yếu tố như mật độ tinh trùng phản ánh quá trình sinh tinh của tinh hoàn và hệ thống ống dẫn tinh, tỉ lệ sống chết, tỉ lệ di động và hình dạng tinh trùng… phản ánh chức năng tinh trùng, sẽ được thể hiện đầy đủ trên một tinh dịch đồ hoàn chỉnh. Theo tiêu chuẩn WHO phiên bản lần V (2010) về đánh giá và thao tác trên tinh dịch, ngưỡng tỉ lệ hình dạng tinh trùng bình thường của người đàn ông có khả năng sinh sản bình thường là 4%. Hình dạng tinh trùng được xem là dấu hiệu chính xác nhất tính cho đến thời điểm này để dự đoán kết quả thụ thai tự nhiên hay theo phương pháp IUI và ICSI (Oehninger and Kruger, 1995).
Tinh trùng có hình dạng kém gây giảm tỉ lệ thụ tinh, chất lượng phôi chuyển thấp, cũng như ảnh hưởng đến xác xuất thành công của toàn bộ quá trình ICSI. Hiện nay, hơn 50% bệnh nhân vô sinh nam đến các trung tâm điều trị hiếm muộn đều có tỉ lệ hình dạng tinh trùng bình thường thấp hơn 4%. Tuy nhiên, do kỹ thuật nhuộm tinh trùng và đánh giá hình dạng tinh trùng đều đòi hỏi rất nhiều ở chuyên môn và kinh nghiệm của kỹ thuật viên, hay nói cách khác, tính chủ quan của phương pháp đánh giá này là rất cao. Vì thế, xu hướng của hầu hết các trung tâm điều trị vô sinh trên toàn thế giới ngày nay là tìm ra một yếu tố khác, không bị phụ thuộc quá nhiều vào các nguyên nhân chủ quan, đồng thời giúp dự đoán chính xác mức độ thành công của phương pháp điều trị, đặc biệt là ICSI, để thay thế tỉ lệ hình dạng bình thường của tinh trùng trong khảo sát tinh dịch.
Lopes và cộng sự (1998) đã nghiên cứu thành công mối tương quan nghịch, có ý nghĩa giữa tỉ lệ phân mảnh DNA và tỉ lệ thụ tinh sau khi tiêm tinh trùng vào trứng. Sau đó, Benchaib và công sự (2003) đã nghiên cứu thành công mối tương quan nghịch giữa tỉ lệ phân mảnh DNA và tỉ lệ mang thai. Đồng thời, tỉ lệ phân mảnh DNA tăng là một trong những nguyên nhân chính dẫn đến chất lượng kém của phôi và hư thai tự nhiên theo Evenson và cộng sự (1999), Tesarik và công sự (2004), Borini và công sự (2006). Tuy nhiên, vẫn còn một số nghiên cứu cho thấy chưa có mối tương quan nào rõ ràng giữa tỉ lệ phân mảnh DNA và tỉ lệ thành công của ICSI (Gandini và cs., 2004; Bungum và cs., 2007, Nicopoullos và cs., 2008). Theo Avendano và cộng sự (2009), tinh trùng di động tốt và có tỉ lệ hình dạng bình thường cao theo tiêu chuẩn đánh giá nghiêm ngặt của Kruger, vẫn có khả năng bị phân mảnh DNA cao. Đến năm 2010, Avendano và cộng sự đã chứng minh được mối tương quan nghịch, có ý nghĩa rất lớn trong y học, giữa những tinh trùng hình dạng bình thường nhưng bị phân mảnh DNA và chất lượng phôi lẫn kết quả thụ thai sau ICSI. Hiện tại, trong ICSI, quá trình chọn lọc tinh trùng tốt nhất để bơm vào trứng được quyết định dựa trên tiêu chí độ di động tốt và hình dạng bình thường cao, tuy nhiên, tỉ lệ phân mảnh DNA trong những tinh trùng đó cao hay thấp mới thực sự là một trong những yếu tố quan trọng ảnh hưởng đến thành công cuối cùng của ICSI.
TỔNG QUAN NGHIÊN CỨU
Theo báo cáo về những đặc tính của tinh dịch bao gồm: độ oxy hóa và tỉ lệ phân mảnh DNA của tinh trùng, độ oxy hóa tinh dịch tăng 25% sẽ dẫn đến tỉ lệ phân mảnh DNA của tinh trùng tăng 10%. Độ di động và hình dạng bình thường của tinh trùng bị ảnh hưởng bởi nồng độ ROS trong tinh dịch và tỉ lệ phân mảnh DNA. Nồng độ ROS và độ phân mảnh DNA của tinh trùng DFI trong tinh dịch tương quan nghịch với tỉ lệ hình dạng bình thường của tinh trùng, hay nói cách khác, tinh dịch càng chứa nhiều tinh trùng bị biến dạng phần đầu, tổn thương acrosome, trung thể, tế bào chất hay phần đuôi sẽ dẫn đến chỉ số phân mảnh DNA và độ oxy hóa cao.
Nhiều nghiên cứu cho thấy những chứng cứ trái chiều về sự phân mảnh DNA của tinh trùng trong tinh dịch của các bệnh nhân vô sinh nam, tuy nhiên cho đến nay, người ta đã có thể khẳng định sự phân mảnh DNA sẽ gây ảnh hưởng nghiêm trọng đến khả năng sinh sản. Hiện nay, người ta sử dụng 3 phương pháp chính để lọc rửa và ly tâm tinh trùng trong tinh dịch để đo độ phân mảnh DNA bao gồm: (1) phương pháp Comet, (2) phương pháp ISNT-decondensed, (3) phương pháp ISNT-condensed. Nghiên cứu so sánh giữa nhóm bệnh nhân vô sinh và nhóm tự nguyện cho thấy nhóm bệnh nhân vô sinh nam có tỉ lệ phân mảnh DNA cao hơn nhóm bình thường, đồng thời chất lượng tinh trùng của nhóm bệnh nhân vô sinh càng thấp thì độ phân mảnh DNA càng cao và ngược lại đối với nhóm tự nguyện. Bên cạnh đó, nhiều nghiên cứu cho thấy độ phân mảnh DNA tỉ lệ nghịch với mật độ tinh trùng trong tinh dịch.
Dựa vào một số nghiên cứu về hình dạng tinh trùng liên quan đến biến đổi gen hay chất lượng phôi và tỉ lệ phân mảnh DNA (Nars-Esfahani và cs., 2008), các kỹ thuật viên thường chọn tinh trùng tốt nhất để tiêm vào bào tương noãn bằng cách đánh giá hình dạng tinh trùng dưới quan trường 100-400X của kính hiển vi quang học. Tuy nhiên, theo Avendano và cộng sự (2009), tinh trùng di động tốt và có tỉ lệ hình dạng bình thường cao theo tiêu chuẩn đánh giá nghiêm ngặt của Kruger, vẫn có khả năng bị phân mảnh DNA cao. Với 11 bài báo cáo và 1.549 ca thụ tinh nhân tạo, Zini và cộng sự (2003) đã chứng minh biến đổi gen và tỉ lệ phân mảnh DNA có liên quan đến sự sẩy thai hay giảm tỉ lệ thu thai (r=2,48; P=0,0001, sig. 2 tailed 1,52-4,04). Do đó, việc lựa chọn những tinh trùng trưởng thành, có khả năng thụ tinh với trứng, không bị biến đổi gen và phân mảnh DNA, sau quá trình lọc rửa tinh trùng để thực hiện tiêm tinh trùng vào bào tương noãn là cực kỳ quan trọng, ảnh hưởng trực tiếp đến thành công cuối cùng của ICSI. Nhưng trên thực tế, những tinh trùng có hình dạng và di động tốt được ưu tiên chọn một cách ngẫu nhiên để tiêm vào bào tương noãn, thế nên tính chủ quan của quá trình này là rất cao.
Từ đó đến nay, rất nhiều nghiên cứu được thực hiện nhằm cải thiện chất lượng tinh trùng được chọn để tiêm vào bào tương noãn sau quá trình lọc rửa tinh trùng trong ICSI, thế nhưng vẫn chưa có bất kỳ nghiên cứu nào về mối tương quan giữa tỉ lệ hình dạng bình thường của tinh trùng với ROS và DFI trong ICSI.
MỤC TIÊU NGHIÊN CỨU
Tìm mối tương quan giữa hàm lượng ROS tinh dịch, chỉ số DFI của tinh trùng và tỉ lệ hình dạng bình thường của tinh trùng trên bệnh nhân điều trị hiếm muộn với kỹ thuật ICSI.
ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Đối tượng nghiên cứu
Chọn liên tiếp 60 mẫu tinh dịch của các bệnh nhân đến điều trị bằng phương pháp ICSI tại Đơn vị Hỗ trợ sinh sản (IVFAS), Bệnh viện An Sinh.
Tiêu chuẩn nhận
- Tỉ lệ hình dạng bình thường của tinh trùng trong tinh dịch đồ <4%.
- Mẫu tinh dịch có thể tích ≥1,5ml.
- Số lượng tinh trùng trong tinh dịch >1.000.000 tinh trùng/ml tinh dịch.
- Có ít nhất 10% tinh trùng di động .
- Mẫu tinh dịch “tươi” (tối đa 2 tiếng sau khi thu mẫu).
Tiêu chuẩn loại
Các trường hợp tinh trùng trữ lạnh và các trường hợp có hồ sơ bệnh án không đầy đủ thông tin.
Tiến hành nghiên cứu
Thiết kế nghiên cứu: khảo sát cắt ngang.
Thu nhận mẫu tinh dịch từ bệnh nhân thỏa tiêu chuẩn nhận, loại trên dựa trên kết quả tinh dịch đồ và tự nguyện với nghiên cứu. Giai đoạn thu nhận và chuẩn bị mẫu được tiến hành dựa theo qui trình chuẩn của WHO (2010) về thu nhận mẫu tinh trùng cho ICSI.
Đánh giá tỉ lệ tinh trùng hình dạng bình thường trước lọc rửa cho quá trình điều trị ICSI bằng phương pháp nhuộm Papanicolaou, dựa theo tiêu chuẩn WHO (2010).
Xác định độ oxy hóa của tinh trùng
Chuẩn bị hóa chất
- Luminol trữ (100mM): cân 177,09mg luminol rồi pha loãng với 10mL dung dịch DMSO. Luminol trữ phải được gói bằng giấy bạc và cất giữ trong môi trường tối, ở nhiệt độ phòng và có thể sử dụng nhiều lần cho đến khi hết hạn sử dụng qui định.
- Luminol thí nghiệm (5mM ): pha 20mL luminol trữ với 380mL DMSO. Luminol thí nghiệm chỉ được sử dụng cho từng thí nghiệm riêng biệt và hoàn toàn thao tác trong bóng tối, những nơi tránh ánh sáng.
Đo ROS
- Hóa lỏng tinh dịch trong lồng ấp 370C, 300 x trong vòng 20 phút, thu kết tủa.
- Tinh trùng kết tủa được pha loãng trong 3mL dung dịch Dulbecco’s PBS (Irvine Scientific, Santa Ana, CA) và rửa lại lần nữa bằng lồng ấp 370C, 300 x trong vòng 7 phút.
- ROS được đo theo nguyên lý Chemiluminescence, bằng máy Luminometer DTX 880 ở 370C trong vòng 15 phút sau khi cho luminol vào. Độ oxy hóa của tinh trùng được tính bằng số photon phát ra trong một phút (cpm) / mật độ tinh trùng của mẫu.
Công thức tính độ oxy hóa
- Lấy chỉ số photon trung bình phát ra của các tube chuẩn (x106 counted photons per minute / 20 milllion sperm/ml) (cpm / 20 milllion sperm/ml).
- Lấy chỉ số photon trung bình phát ra của các tube mẫu (x106 counted photons per minute / 20 milllion sperm/ml) (cpm / 20 milllion sperm/ml).
- ROS = chỉ số photon phát ra trung bình của tube mẫu / mật độ tinh trùng của mẫu.
Đo chỉ số phân mảnh DNA bằng Halosperm kit
Dựa theo hướng dẫn đính kèm trong bộ kit Halosperm G2, tiến hành chuẩn hóa qui trình đo DFI. Sau đó, áp dụng qui trình chuẩn đó để đo DFI và thu thập dữ liệu cho nghiên cứu.
Phương pháp SCD dùng đo độ phân mảnh DNA của tinh trùng được thể hiện qua bộ kit Halosperm (Halosperm USA), với một số chi tiết được cải tiến nhằm phù hợp với môi trường áp dụng tại Việt Nam.
- Đặt ống agarose trong nước ấm nhiệt độ 95-1000C trong 5 phút hoặc lò vi sóng trong 2 phút, hóa lỏng 10 ống agarose, mỗi ống 100ml được sử dụng đo DNA phân mảnh cho mỗi mẫu tinh trùng.
- Chai solution 1 và solution 2 được bảo quản ở nhiệt độ phòng 220C trong suốt thời gian diễn ra nghiên cứu.
- Pha loãng mẫu tinh trùng trong dung dịch PBS sao cho nồng độ tối đa 20 triệu tinh trùng/ml tinh dịch.
- Đặt ống agarose trong nước ấm nhiệt độ 95-1000C trong 5 phút hoặc ngâm cho đến khi agarose nóng chảy hoàn toàn. Giữ ống ở nhiệt độ bể 370C trong vòng 5 phút đến khi nhiệt độ được cân bằng.
- Chuyển 50ml tinh dịch vào ống 100ml agarose và trộn đều bằng pipette. Giữ ống ở nhiệt độ phòng 370C và nhanh chóng thực hiện bước kế tiếp, tránh agarose bị đông.
- Nhỏ một giọt 8ml tinh dịch pha loãng lên trung tâm của đĩa mẫu, phủ coverslip, ấn nhẹ, tránh bọt khí xuất hiện. Lame được đặt nằm ngang trong suốt quá trình thao tác, sử dụng giếng khác để quan sát mẫu control.
- Đặt mẫu vào tủ lạnh 40C, trong 5 phút để agarose đông lại.
- Lấy mẫu ra khỏi tủ lạnh, bỏ coverslip bằng cách trượt nhẹ ra. Mọi thao tác phải được thực hiện ở nhiệt độ phòng 220C.
- Đặt lame nằm ngang trên đĩa Petri, nhỏ solution 1 vào giếng sao cho mẫu tinh dịch được phủ đầy solution 1, ủ trong vòng 7 phút. Đổ phần dung dịch dư sau thời gian ủ và đặt mẫu nằm ngang.
- Nhỏ solution 2 vào giếng sao cho mẫu ngập đầy trong solution 2, ủ trong 20 phút. Đổ phần dung dịch dư sau thời gian ủ và đặt mẫu nằm ngang.
- Rửa mẫu với nước cất trong vòng 5 phút bằng pipette đã được chưng cất, đổ phần dung dịch dư ra và đặt mẫu nằm ngang, tiếp tục rửa bằng cồn 70% trong vòng 2 phút. Đổ phần cồn dư và tiếp tục rửa bằng cồn nguyên chất 100% trong vòng 2 phút. Sau khi để khô, mẫu có thể được bảo quản trong hộp kín ở nhiệt độ phòng trong vài tháng. Lưu ý bảo quản trong môi trường khô thoáng và hạn chế ánh sáng.
- Đặt mẫu nằm ngang trên đĩa Petri, nhỏ dung dịch 3 vào giếng sao cho mẫu ngập trong dung dịch, ủ trong vòng 7 phút. Đổ phần dung dịch dư sau thời gian ủ và đặt mẫu nằm ngang. Nhỏ dung dịch 4 vào giếng sao cho mẫu ngập trong dung dịch, ủ trong vòng 7 phút. Đổ phần dung dịch dư sau thời gian ủ và bảo quản trong nhiệt độ phòng.
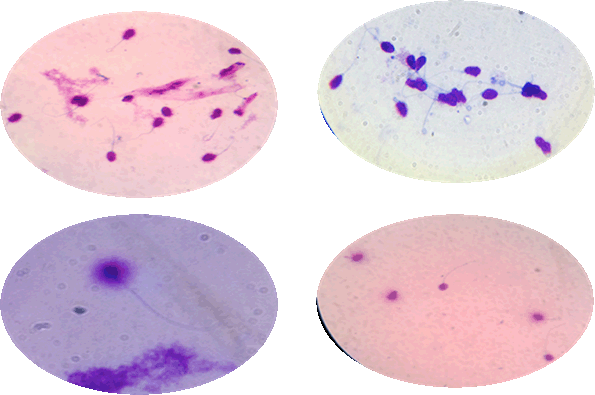
- Quan sát mẫu dưới kính hiển vi quang học, nếu độ nhuộm mẫu quá dày đặc, rửa mẫu bằng nước máy. Nếu độ nhuộm mẫu quá yếu, ngâm lame trong cồn nguyên chất 100%, để khô và tiếp tục nhuộm bằng những bước trên. Kỹ thuật viên đếm khoảng 500 tinh trùng trong tinh dịch để xác định độ phân mảnh của tinh dịch. Độ phân mảnh tinh trùng được xác định bằng vòng halo của tinh trùng theo Fernandez và cộng sự.
- Vòng halo lớn: vòng halo có bề rộng bằng hoặc lớn hơn bán kính lõi.
- Vòng halo trung: vòng halo có bề rộng nằm giữa vòng cỡ lớn và vòng cỡ nhỏ.
- Vòng halo nhỏ: vòng halo có bề rộng bằng hoặc nhỏ hơn 1/3 bán kính của lõi.
- Không có vòng halo hoặc phân mảnh.
|
|
|
Hình 1 |
- Tính phần trăm tinh trùng bị phân mảnh DNA = tổng số lượng tinh trùng có vòng halo nhỏ hoặc không có vòng halo hoặc tinh trùng phân mảnh / tổng số tinh trùng đếm được. Số lượng tinh trùng đếm mỗi lần khoảng 100 tinh trùng và lặp lại 3 lần. Ngưỡng độ phân mảnh tinh trùng được xác định liên quan đến tỉ lệ vô sinh là 27% theo nghiên cứu của Evenson và cộng sự.
1. Lưu đầy đủ thông tin của bệnh nhân, kết quả tinh dịch đồ,2. Phân tích dữ liệu và so sánh tỉ lệ hình dạng tinh trùng bình thường với ROS và DFI của tinh trùng mẫu cho ICSI bằng phần mềm SPSS phiên bản 16.0. Công thức t-test trong phần mềm này sẽ hỗ trợ so sánh các biến số trên với xác suất P<0,05 được cho là chỉ số đáng tin cậy.
KẾT QUẢ và BÀN LUẬN
|
Biểu đồ 1 |
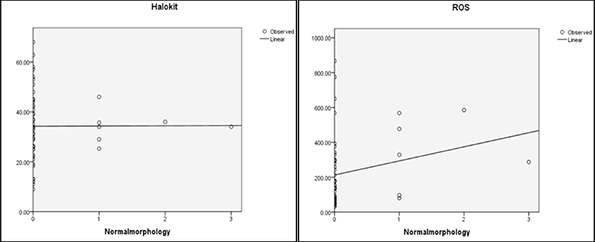
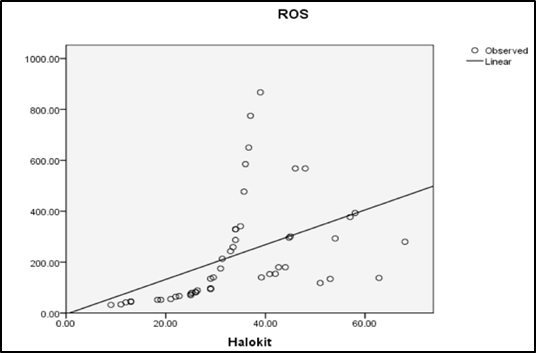
Phương trình tương quan giữa độ oxy hóa và tỉ lệ phân mảnh DNA:
Y = 0,033X + 27.200
Ngày nay, tinh trùng được chọn lọc để thực hiện tiêm vào bào tương noãn một cách bất kỳ, phụ thuộc nhiều vào cảm quan và kinh nghiệm của kỹ thuật viên. Tinh trùng với hình dạng bình thường quan sát dưới kính hiển vi quang học sẽ được chọn lọc, bởi có rất nhiều nghiên cứu về hình dạng tinh trùng bất thường có liên quan mật thiết đến bất thường di truyền hay chất lượng của phôi và tỉ lệ phân mảnh DNA (Nars-Esfahani và cs., 2008). Nghiên cứu của Coetzee và cộng sự (1998) đã chứng minh nhóm bệnh nhân có hình dạng tinh trùng bình thường thấp hơn 4%, chiếm tỉ lệ thụ tinh thấp (59,3%) và tỉ lệ mang thai kém (15,2%), trong khi đó, nhóm bệnh nhân có hình dạng tinh trùng bình thường cao hơn 4% chiếm tỉ lệ thụ tinh cao (77,6%) và tỉ lệ mang thai tốt (26%). Tuy nhiên, câu hỏi được đặt ra là “tinh trùng với hình dạng bình thường có bị phân mảnh DNA hay không?”.
Trên thực tế, tỉ lệ hình dạng bình thường của tinh trùng đã trở thành một trong những chỉ số có độ tin cậy kém đến tỉ lệ thành công của IVF, đặc biệt ICSI. Trong khi đó, bất thường di truyền và tỉ lệ DNA phân mảnh dẫn đến khả năng thất bại trong quá trình thụ tinh, sẩy thai... được chứng minh từ 11 nghiên cứu khác nhau của Zini và cộng sự (2003). Do đó, ngoài tiêu chí lựa chọn tinh trùng trưởng thành có hình dạng bình thường, có khả năng thụ tinh thì những tiêu chí về di truyền bình thường cũng được đánh giá rất cao, ảnh hưởng đến kết quả cuối cùng của ICSI.
Mặt khác, vai trò của độ oxy hóa tinh dịch đối với vô sinh nam ngày càng được thể hiện rõ rệt qua nhiều nghiên cứu (Aitken và Clark-son, 1987; Iwasaki và Gagnon, 1992; Aitken và Fisher, 1994; Sikka và cs., 1995; Sharma và Agarwal, 1996; Gri-veau và de Lennou, 1997; Ochsendorf, 1999). Theo nghiên cứu của Sharma và cộng sự (1999) thì độ oxy hóa tinh dịch tăng 25% dẫn đến tỉ lệ phân mảnh DNA tăng 10%. Nếu tỉ lệ hình dạng bình thường tinh trùng tăng, độ oxy hóa tinh dịch và tỉ lệ phân mảnh DNA tinh trùng giảm, cơ hội chọn được tinh trùng tốt nhất để thực hiện bơm tinh trùng vào bào tương noãn sẽ càng cao.
Độ oxy hóa ROS và tỉ lệ phân mảnh DNA của tinh trùng tăng, có thể sẽ làm tỉ lệ thành công trong ICSI giảm; tuy nhiên, tỉ lệ này lại đang được đánh giá chủ yếu bởi những chỉ số khác trong tinh dịch đồ như hình dạng tinh trùng, mật độ, độ di động… ở hầu hết các bệnh viện và trung tâm hỗ trợ sinh sản tại Việt Nam. Điều đó lý giải vì sao bệnh nhân với kết quả tinh dịch đồ tốt ở tất cả các chỉ số, vẫn có khả năng vô sinh cao và tỉ lệ có thai khi điều trị thấp.
Định lượng ROS tinh dịch và đo DFI tinh trùng là những xét nghiệm hoàn toàn có thể thực hiện được trong điều kiện Việt Nam hiện nay với chi phí thấp. Việc triển khai các kỹ thuật chẩn đoán này trong tương lai có thể cung cấp thêm nhiều thông tin cho các nhà lâm sàng trong chẩn đoán, tiên lượng và điều trị vô sinh nam giới.
Đây chỉ là một nghiên cứu nhỏ bước đầu về vấn đề này, cần có thêm nghiên cứu mối tương quan giữa ROS tinh dịch và DFI tinh trùng trước ICSI với các chỉ số điều trị của kỹ thuật ICSI như: tỉ lệ thụ tinh, tỉ lệ phôi chất lượng tốt, tỉ lệ làm tổ, tỉ lệ thai lâm sàng, tỉ lệ sẩy thai… Từ đó có thể nghiên cứu áp dụng định lượng ROS và DFI trong chẩn đoán, theo dõi và điều trị nhằm cải thiện tỉ lệ thành công của kỹ thuật ICSI.
KẾT LUẬN
Kết quả của nghiên cứu cho thấy mối tương quan có ý nghĩa thống kê giữa độ oxy hóa ROS và tỉ lệ phân mảnh DFI trong phương pháp tiêm tinh trùng vào bào tương noãn (ICSI). Mối tương quan được thể hiện với phương trình Y = 0,033X + 27.200; trong đó, X là hàm lượng ROS trong tinh dịch và Y là chỉ số DFI của tinh trùng trước khi ICSI.
ROS tinh dịch và DFI tinh trùng có thể là những chỉ số quan trong giúp tiên lượng khả năng thành công của kỹ thuật ICSI. Cần có thêm nhiều nghiên cứu với cỡ mẫu lớn hơn về vấn đề này.
TÀI LIỆU THAM KHẢO
1. Agarwal A, Said TM (2003). Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod Update; 9:331-345.
2. Ahmadi A, Ng SC (1999). Fertilizing ability of DNA-damaged spermatozoa. J Exp Zool; 284:696-704.3. Aitken R, Krausz C (2001). Oxidative stress, DNA damage and the Y chromosome. Reproduction; 122:497-506.
4. Aitken RJ (1999). The Amoroso lecture. The human spermatozoa-a cell in crisis. J Reprod Fertil; 115:1-7.
5. Aitken RJ, Clarkson JS (1988). Significance of reactive oxygen species and antioxidants in defining the efficacy of sperm preparation techniques. J Androl; 9:367-376.
6. Altman SA, Zastawny TH, Randers-Eichhorn L, Cacciuttolo MA, Akman SA, Dizdaroglu M et al. (1995). Formation of DNA-protein cross- links in cultured mammalian cells upon treatment with iron ions. Free Radic Biol Med; 19:897-902.7. Balhorn R (1982). A model for the structure of chromatin in mammalian sperm. J Cell Biol; 93:298-305.
8. Barroso G, Morshedi M, Oehninger S (2000). Analysis of DNA fragmentation, plasma membrane translocation of phosphati-dylserine and oxidative stress in human spermatozoa. Hum Reprod; 15:1338-1344.9. Benchaib M, Braun V, Lornage J, Hadj S, Salle B, Lejeune H et al. (2003). Sperm DNA fragmentation decreases the pregnancy rate in an assisted reproductive technique. Hum Reprod; 18:1023-1028.
10. Bianchi PG, Manicardi GC, Urner F, Campana A, Sakkas D (1996). Chromatin packaging and morphology in ejaculated human spermatozoa: evidence of hidden anomalies in normal spermatozoa. Mol Hum Reprod; 2:139-144.
11. Chiu SM, Xue LY, Friedman LR, Oleinick NL (1995). Differential dependence on chromatin structure for copper and iron ion induction of DNA double-strand breaks. Biochemistry; 34:2653-2661.12. Cummins JM, Jequire AM, Kan R (1994). Molecular biology of human male infertility: links with aging, mitochondrial genetics, and oxidative stress? Mol Reprod Dev; 37:345-632.
13. Danan C, Sternberg D, Van Steirteghem A, Cazeneuve C, Duquesnoy P, Besmond C et al. (1999). Evaluation of parental mitochondrial inheritance in neonates born after intracytoplasmic sperm injection. Am J Hum Genet; 65:463-473.
14. Dizdaroglu M (1992). Oxidative damage to DNA in mammalian chromatin. Mutat Res; 275: 331-342.15. Donnelly E, McClure N, Lewis S (1999). The effect of ascorbate and alpha-tocopherol supplementation in vitro on DNA integrity and hydrogen peroxide-induced DNA damage in human spermatozoa. Mutagenesis; 14:505-512.
16. Donnelly ET, McClure N, Lewis SE (2001). Cryopreservation of human semen and prepared sperm: effects on motility parameters and DNA integrity. Fertil Steril; 76:892-900.17. Donnelly ET, O’Connell M, McClure N, Lewis S (2000). Differences in nuclear DNA fragmentation and mitochondrial integrity of semen and prepared human spermatozoa. Hum Reprod; 15:1552-1561.
18. Duran EH, Morshedi M, Taylor S, Oehringer S (2002). Sperm DNA quality predicts intrauterine insemination, outcome: a prospective cohort study. Hum Reprod; 12:3122-3128.19. Duty SM, Singh NP, Ryan L, Chen Z, Lewis C, Hunag T et al. (2002). Reliability of the comet assay in cryopreserved human sperm. Hum Reprod; 17:1274-1280.
20. Edwards RG, Beard HK (1999). Is the success of human IVF more a matter of genetics and evolution than growing blastocysts? Hum Reprod; 14:1-4.21. Eiliani S, Van den Bergh M, Vannin AS, Biramane J, Verdoodt M, Englert Y (2001). Evidence of reduced single-stranded testicular sperm DNA from obstructive azoospermic men after 3 days of in-vitro culture. Hum Reprod; 16:1200-1203.
22. Erenpreisa J, Erenpreiss J, Freivalds T, Slaidina M, Krampe R, Butikova J et al. (2003). Toluidine blue test for sperm DNA integrity and elaboration of image cytometry algorithm. Cytometry; 52:19-27.23. Esfahani MH, Razavi S, Vahdali AA, Fathi F, Tavalaee M (2008). Evaluation sperm selection procedure based on hyaluronic acid binding ability on ICSI outcome.
24. Evenson D, Jost L (1994). Sperm chromatin structure assay: DNA denaturability. Methods Cell Biol; 42:159-176.
25. Evenson DP, Jost LK, Baer RK, Turner TW, Schrader SM (1991). Individuality of DNA denaturation patterns in human sperm as measured by the sperm chromatin structure assay. Reprod Toxicol; 5:115-125.
26. Evenson DP, Jost LK, Corzett M, Balhorn R (2000). Characteristics of human sperm chromatin structure following an episode of influenza and high fever: a case study. J Androl; 21: 739-746.27. Evenson DP, Jost LK, Marshall D, Zinaman MJ, Clegg E, Purvis K et al. (1999). Utility of sperm chromatin structure assay as a diagnostic and prognostic tool in the human fertility clinic. Hum Reprod; 14:1039-1049.
28. Evenson DP, Larson KL, Jost LK (2002). Sperm chromatin structure assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Androl; 23:25-43.
29. Evenson and Wixon (2006). Meta-analysis of sperm DNA fragmentation using the sperm chromatin structure assay. Reprod Biomed Online; 12:466-472.30. Fernandez JL, Gazalvez J (2002). Application of FISH to detect DNA damage: DNA breakage detection-FISH(DBD-FISH). Methods Mol Biol; 203:203-216.
31. Fernandez JL, Muriel L, Rivero MT, Goyanes V, Vazquez R, Alvarez JG (2003). The sperm chromatin dispersion test: a simple method for the determination of sperm DNA fragmentation. J Androl; 24:59-66.
32. Genesca A, Caballin MR, Miro R, Benet J, Germa JR, Egozcue J (1992). Repair of human sperm chromosome aberrations in the hamster egg. Hum Genet; 89:181-186.33. Golan R, Shochat L, Weissenberg R, Soffer Y, Marcus Z, Oschry Y et al. (1997). Evaluation of chromatin condensation in human spermatozoa: a flow cytometric assay using acridine orange staining. Mol Hum Reprod; 3:47-54.
34. Gorczyca W, Gong J, Darzynkiewicz Z (1993). Detection of DNA strand breaks in individual apoptotic cells by the in situ terminal deoxynucleotidyl transferase and nick translation assays. Cancer Res; 53:1945-1951.
35. Hồ Mạnh Tường (2001). Tiêm tinh trùng vào bào tương trứng. Tạp chí thông tin Y Dược; (06):17-19.36. Host E, Lindenberg S, Smidt-Jensen S (2000). The role of DNA strand breaks in human spermatozoa used for IVF and ICSI. Acta Obstet Gynecol Scand; 79:559-563.
37. Hughes CM, Lewis SE, McKelvey-Martin VJ, Thompson W (1996). A comparison of baseline and induced DNA damage in human spermatozoa from fertile and infertile men, using a modified comet assay. Mol Hum Reprod; 2:613-619.
38. Hughes CM, Lewis SE, McKelvey-Martin VJ, Thompson W (1998). The effects of antioxidant supplementation during Percoll preparation on human sperm DNA integrity. Hum Reprod; 13:1240-1247.39. Huszar G, Sbracia M, Vigue L, Miller DJ, Shur BD (1997). Sperm plasma membrane remodeling during spermiogenetic maturation in men: relationship among plasma membrane beta 1,4-galactosyltransferase, cytoplasmic creatine phosphokinase, and creatine phosphokinase isoform ratios. Biol Reprod; 56:1020-1024.
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Khách sạn Equatorial, chủ nhật ngày 23 . 11 . 2025

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...