Tin chuyên ngành
on Friday 13-03-2015 5:37pm
Danh mục: Nam khoa
ThS. Phùng Ngọc Thùy Linh và cộng sự
TÓM TẮT
Mục tiêu: tối ưu qui trình kỹ thuật CMA3 (chromomycin A3) và SCD (sperm chromatin dispersion). Xác định mối liên hệ giữa các xét nghiệm CMA3, SCD và các thông số tinh dịch đồ ở 49 mẫu tinh dịch người (được đánh giá theo tiêu chuẩn WHO, 2010). So sánh kết quả xét nghiệm CMA3 và SCD với kết quả xét nghiệm sử dụng kit Halosperm.
Phương pháp: thu thập, phân tích dữ liệu tham khảo và làm thực nghiệm để tối ưu các qui trình kỹ thuật CMA3, SCD. Sử dụng các xét nghiệm đã tối ưu để phát hiện các bất thường về sự trưởng thành chưa hoàn toàn của nhân tinh trùng và sự phân mảnh DNA tinh trùng trong 49 mẫu tinh dịch người, phân tích thống kê cùng với dữ liệu tinh dịch đồ.
Kết quả: đã xây dựng 2 qui trình CMA3 và SCD tối ưu, có khả năng phát hiện các bất thường trong vật liệu di truyền của tinh trùng ở mức độ tế bào. Mật độ tinh trùng có liên quan với kết quả nhóm SCD, tinh trùng bất động có liên quan với kết quả nhóm CMA3. Ngoài ra, không có mối liên quan nào giữa các xét nghiệm CMA3 và SCD với các đặc điểm khác như: độ tuổi, mật độ tinh trùng, khả năng di động, hình dạng, hàm lượng ROS. Không có sự tương quan giữa kết quả xét nghiệm CMA3, SCD với kết quả xét nghiệm sử dụng kit Halosperm đồng thời.
Kết luận: qui trình CMA3 và SCD là 2 qui trình kỹ thuật khá đơn giản, dễ thực hiện, chi phí thấp, có khả năng phát hiện các bất thường trong vật liệu di truyền của tinh trùng ở mức độ tế bào. Tuy nhiên, cần có thêm các nghiên cứu bổ sung nhằm xác định ý nghĩa của các qui trình này trong các liệu pháp hỗ trợ sinh sản.
TỔNG QUAN
Theo PGS. TS. Nguyễn Viết Tiến và các cộng sự điều tra năm 2009 trên 8 vùng sinh thái trong cả nước Việt Nam thì tỉ lệ vô sinh của cộng đồng là 7,7% các cặp vợ chồng đang trong độ tuổi sinh đẻ (Nguyễn Viết Tiến và cs., 2009). Số liệu này cho thấy tại Việt Nam có đến hàng triệu cặp vợ chồng có nhu cầu điều trị vô sinh và hỗ trợ sinh sản. Do đó, việc phát triển các phương pháp hỗ trợ sinh sản giúp mang lại cơ hội được làm cha mẹ cho các cặp vợ chồng hiếm muộn và được xem là một nhiệm vụ rất cần thiết, mang tính nhân văn và tính xã hội cao của ngành y tế nói riêng và của toàn xã hội nói chung. Tuy nhiên hiện nay, các biện pháp hỗ trợ sinh sản vẫn chưa phát huy hết hiệu quả của nó do khả năng phát hiện và việc khắc phục các nguyên nhân gây vô sinh vẫn còn hạn chế. Hiện nay, các bất thường về tinh trùng chỉ được đánh giá chủ yếu dựa theo các tiêu chuẩn về hình thái, khả năng di động, mật độ tinh trùng, số lượng tinh trùng, khả năng sống của tinh trùng… trong tinh dịch đồ theo khuyến cáo của WHO, 2010 (Trevor và cs., 2010). Tuy nhiên, khi các thông số này cho kết quả bình thường cũng không đảm bảo chắc chắn khả năng thụ thai thành công của người nam (Ramadan và cs., 2002); mà chất lượng tinh trùng còn có thể bị ảnh hưởng bởi các yếu tố khác như ROS (reactive oxygen species), tính toàn vẹn vật liệu di truyền của tinh trùng... Hiện nay, trên thế giới đã phát triển các công cụ xét nghiệm để đánh giá mức độ toàn vẹn DNA của tinh trùng bằng nhiều phương pháp khác nhau như: nhuộm acid aniline, nhuộm xanh toluidine, nhuộm chromomycin A3 (CMA3), sự phân tán nhiễm sắc thể (sperm chromatin dispersion – SCD), Comet, lai mẫu dò phát huỳnh quang (fluorescence in situ hybridization – FISH), TUNEL… (Agarwal và Allamaneni, 2004), trong đó, CMA3 và SCD là các kỹ thuật đơn giản, dễ thực hiện, cho độ nhạy cao (Agarwal và Allamaneni, 2004), đòi hỏi thiết bị không quá đắt, chi phí hóa chất thấp, dễ áp dụng trong điều kiện ở Việt Nam.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Mẫu tinh trùng
50 mẫu tinh dịch được lấy từ người nam kiêng quan hệ trước 48-72 giờ, có các thông tin tinh dịch đồ (số lượng tinh trùng, khả năng di động, tỉ lệ sống, hình thái, hàm lượng bạch cầu…). Thu thập các dữ liệu mẫu (tinh dịch đồ…).
Protocol tham khảo
Qui trình CMA3 (Agarwal và Allamaneni, 2004)
Cho khoảng 10.000 tinh trùng vào 200ml dung dịch Carnoy (methanol:acid acetic = 3:1), ủ 5-15 phút trong tối ở nhiệt độ 40C. Ly tâm 1.200 vòng trong 5 phút, hút bỏ dịch nổi, để lại phần cặn. Pipet đều phần tinh trùng với lượng nhỏ dung dịch Carnoy còn lại, nhỏ lên lame kính, để khô tự nhiên trong 20 phút để cố định tế bào tinh trùng trên lame. Nhỏ 100ml dung dịch CMA3 0,25 mg/ml, ủ 20 phút trong tối ở nhiệt độ 40C. Rửa lame bằng dung dịch đệm CMA3, tránh sáng. Nhỏ 20ml dung dịch glycerol, đậy cover slip, ủ qua đêm trong tối ở nhiệt độ 40C. Đọc kính huỳnh quang có filter 460-470nm.
Qui trình SCD (Agarwal và Allamaneni, 2004)
Chuẩn bị gel LMA: làm tan hoàn toàn 100ml gel LMA 1% trong lò viba, ủ trong bồn ủ nhiệt nước ở 370C trong vòng 30 phút. Chọn các mẫu tinh dịch có nồng độ tinh trùng 5-10 triệu/ml. Cho tinh trùng vào 100ml gel LMA 1% để đạt được hỗn hợp gel chứa 0,7% LMA ở 370C và trộn đều. Nhỏ 50ml gel đã trộn tinh trùng cho lên lame, lập tức đậy lamen lên để trải gel dàn đều trên lame, tránh bọt khí. Làm đông gel bằng cách cho lame mẫu vào tủ lạnh 40C trong 2-5 phút. Sau đó, nhẹ nhàng tháo bỏ lamen. Lập tức cho lame mẫu vào khay chứa khoảng 10ml dung dịch HCl 0,08N lạnh, ủ tối ở 220C trong 7 phút. Tiếp tục lấy lame mẫu ra, cho vào dung dịch lysis SC04 trong 10 phút ở nhiệt độ phòng. Sau đó, cho tiếp lame mẫu vào dung dịch lysis SC05 trong 5 phút ở nhiệt độ phòng. Rửa lame mẫu trong 10ml nước cất hay TBE 1X trong 2-5 phút. Lần lượt rửa lame mẫu trong EtOH 70%, 90% và 100% trong 2 phút/lần rửa. Để lame mẫu ráo nước (khoảng 5 phút ở nhiệt độ phòng), trải đều 100ml DAPI 1mg/ml, ủ tối trong vòng 15-20 phút. Lắc rửa lame mẫu trong 10ml nước cất hay TBE 1X, để khô tự nhiên khoảng 20 phút trong tối. Đọc lame mẫu, 50-500 tế bào.
Cách đánh giá kết quả nghiên cứu
Đánh giá DFI trong qui trình CMA3
Đọc kết quả của 200 tế bào bằng chương trình phân tích hình ảnh ImageJ, đánh giá độ bắt màu vàng của tinh trùng. Cách tính tỉ lệ DFI (%) = Số lượng tế bào vàng sáng / Tổng số tế bào x 100%.
Đánh giá DFI trong qui trình SCD
Phân tích kết quả của 200 tế bào bằng chương trình phân tích hình ảnh ImageJ, đo độ rộng vòng sáng quanh đầu tinh trùng (h) và đường kính nhỏ nhất của đầu tinh trùng (d).
Bảng 1. Nguyên tắc xếp nhóm các tế bào tinh trùng dựa vào tỉ lệ h/d của test SCD
| STT | Xếp nhóm tinh trùng | Đặc điểm |
| 1 | L: Quầng sáng lớn | h³d |
| 2 | V: Quầng sáng vừa | 1/3d<h<d |
| 3 | N: Quầng sáng nhỏ | h£1/3d |
| 4 | K: Không có quầng sáng | h=0 |
| 5 | M: Mảnh vỡ tinh trùng | Tế bào bị phân rã hoặc bắt màu bất thường |
Cách tính tỉ lệ DFI (%) = (Tổng tế bào N + K + M) / Tổng số tế bào x 100%
KẾT QUẢ VÀ BIỆN LUẬN
Tối ưu hóa các qui trình kỹ thuật chromomycin A3, SCD
Qui trình CMA3
Thực hiện qui trình kỹ thuật nhuộm CMA3 tham khảo từ các bài báo quốc tế, hình ảnh tinh trùng nhuộm CMA3 được ghi nhận khá phân biệt giữa các dạng tinh trùng có màu vàng sáng và màu vàng mờ (Hình 1). Do qui trình này được thực hiện khá đơn giản và thuận tiện, khó thể tối ưu được thêm nữa nên chúng tôi không tiến hành các thí nghiệm so sánh khác để đưa ra qui trình mới tối ưu hơn.
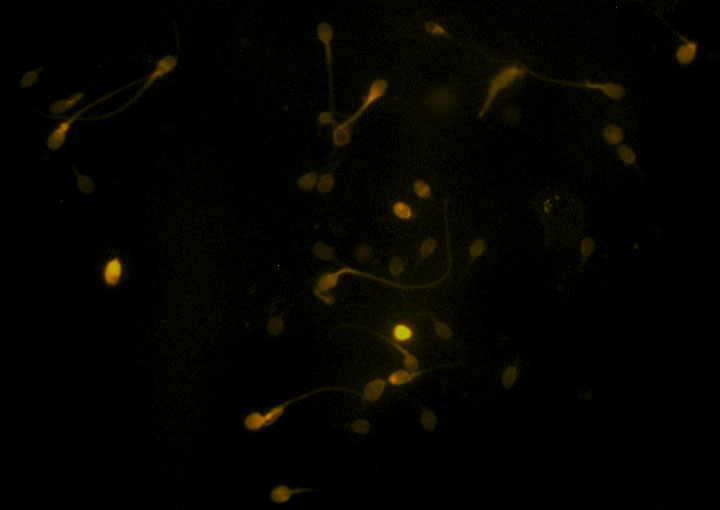 |
| Hình 1. Kết quả hình ảnh tinh trùng khi được nhuộm CMA3 (x20) |
Qui trình SCD
Khảo sát dung dịch lysis
Trên cùng 1 mẫu tinh trùng, thực hiện 2 qui trình song song với các dung dịch lysis khác nhau để phân giải màng tế bào và phân giải một phần protein trong nhân tinh trùng. Qui trình 1 sử dụng hai dung dịch lysis SC04 và SC05 trong thời gian khoảng 15 phút (Agarwal và Allamaneni, 2004). Qui trình 2 sử dụng chỉ một dung dịch lysis SC11 trong khoảng 15 phút (Gutierrez và cs., 2007), các bước còn lại thực hiện theo protocol tham khảo (Agarwal và Allamaneni, 2004). Kết quả SCD cho thấy hình ảnh tinh trùng ở qui trình sử dụng một dung dịch lysis SC11 (Hình B) có nhân tròn trịa, sáng rõ, quầng sáng halo khá phân biệt với độ sáng nhân và độ tối của nền lame mẫu hơn. Trong khi đó, hình ảnh nhân của tinh trùng được phân giải lần lượt bằng hai dung dịch SC04 và SC05 không tròn trịa và sáng rõ, dù quầng sáng halo quanh nhân cũng cho tín hiệu khá ổn (Hình A). Do đó, chúng tôi chọn dung dịch SC11 là dung dịch lysis tối ưu cho qui trình SCD.
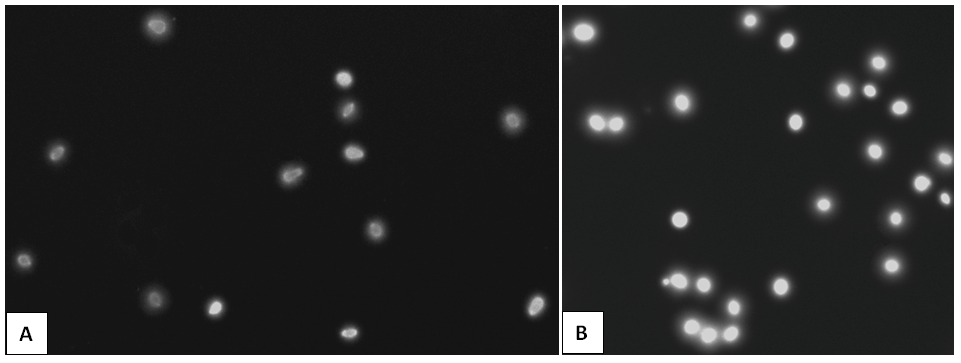 |
|
Hình 2. Khảo sát ảnh hưởng các loại dung dịch lysis SC04, SC54 (Hình A) và SC11 (Hình B) (x20) |
Khảo sát thời gian lysis
Thực hiện qui trình test SCD trên cùng 1 mẫu tinh trùng, lysis bằng dung dịch SC11 trong các khoảng thời gian phân giải màng, protein lõi nhân tinh trùng khác nhau 10 - 15 - 20 và 25 phút với mục tiêu xác định thời gian tối thiểu cần thiết đủ cho quá trình phân giải màng và làm bung vùng nhân tinh trùng ra, tạo thành các quầng sáng halo quanh lõi nhân. Kết quả hình ảnh bên dưới cho thấy quá trình lysis cần tối thiểu 20 phút trở lên thì hình ảnh quầng sáng halo sáng rõ (Hình C, D).
 |
|
Hình 3. Khảo sát ảnh hưởng của thời gian lysis từ 10 phút (Hình A), 15 phút (Hình B), 20 phút (Hình C) và 25 phút (Hình D) |
Khảo sát hiệu quả rửa cồn sau lysis
Tiến hành thực hiện test SCD trên cùng 1 mẫu tinh trùng với 2 qui trình song song. Qui trình 1 thực hiện 3 bước rửa lame mẫu sau lysis bằng cồn 70%, 90% và 100% trong vòng 2 phút/lần rửa; qui trình 2 không thực hiện các bước rửa cồn. Kết quả cho thấy hình ảnh tế bào tinh trùng có nhân tròn, sáng rõ và quầng sáng halo xung quanh nhân cũng sáng rõ như nhau giữa 2 qui trình rửa (Hình A, B), điều này cho thấy việc rửa bằng cồn thực sự không cần thiết, do đó, để tinh gọn thời gian và hóa chất cho phương pháp SCD, chúng tôi bỏ qua bước rửa ethanol trong qui trình phát hiện.
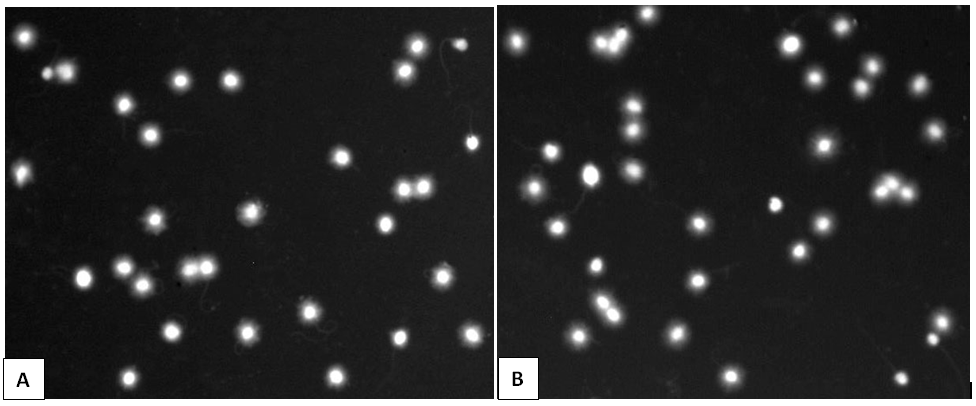 |
| Hình 4. Khảo sát ảnh hưởng của bước rửa lame mẫu bằng 3 nồng độ cồn (Hình A) và không rửa bằng cồn (Hình B) |
Xác định tỉ lệ DFI của các test đáng giá sự phân mảnh DNA
Tỉ lệ DFI của test CMA3
Bảng 2. Kết quả thống kê về tỉ lệ DFI của test CMA3
| Nhóm | % DFI CMA3 | Số lượng | Tỉ lệ % |
| 1 | 10-19 | 12 | 25 |
| 2 | 20-29 | 10 | 20,8 |
| 3 | 30-39 | 16 | 33,3 |
| 4 | 40-49 | 8 | 16,7 |
| 5 | 50-59 | 0 | |
| 6 | 60-69 | 1 | 2,1 |
| 7 | 70-79 | 0 | |
| 8 | 80-89 | 1 | 2,1 |
Các nghiên cứu về CMA3 cho rằng CMA3 có mối liên hệ với khả năng thụ thai trong IVF hay ICSI, cho thấy sự thiếu hụt protamine trong tinh trùng có liên hệ mật thiết với thụ thai thất bại (Esterhuizen và cs., 2000; Tavalaee và cs., 2007; Tarozzi và cs., 2009; Zandemami và cs., 2012). Trong một nghiên cứu của nhóm tác giả Esterhuizen (2000) thực hiện với 140 mẫu tinh trùng của các cặp IVF và ICSI, nhằm đánh giá các mối liên hệ giữa sự chất lượng đóng gói chất nhiễm sắc với protamine trong tinh trùng (thông qua khả năng nhuộm CMA3) với các chỉ tiêu đánh giá hình thái tinh trùng thường qui, tiên lượng khả năng thành công của IVF và ICSI khi được điều trị hỗ trợ sinh sản. Kết quả, ở giá trị ngưỡng DFI là 60% cho thấy sự khác biệt của 2 nhóm hình thái tinh trùng bình thường <4% và ³4% với độ nhạy 75%, độ đặc hiệu 100%. Ngoài ra, ở nhóm người thực hiện IVF, giá trị ngưỡng DFI 60% cũng cho thấy giá trị tiên lượng sử dụng IVF thành công là 60%, độ nhạy là 81,5% và độ đặc hiệu là 63,6% (Esterhuizen và cs., 2000). Năm 2012, nhóm tác giả Zandemami và cộng sự công bố kết quả nghiên cứu về phương pháp CMA3 trên 238 mẫu tinh trùng nghi ngờ thiểu tinh nặng và 208 mẫu tinh trùng có hình thái bình thường (theo tiêu chuẩn WHO), nhằm xác định ngưỡng cut-off của phương pháp CMA3 với việc phân tích các số liệu thu thập được bằng hàm ROC. Kết quả giá trị cut-off mà nhóm đưa ra là 31%, đây được xem là giá trị tỉ lệ DFI giúp phân biệt được chất lượng tinh trùng tốt hay xấu. Từ đó, nhóm tác giả nhận định test CMA3 là một test nhạy và đặc hiệu cho việc đánh giá sự protamine hóa, sự trưởng thành và chất lượng tinh trùng (Evenson và cs., 1999; Velez và cs., 2008).
Nếu lấy giá trị DFI làm ngưỡng cut-off của test CMA3 này là 31% (Zandemami và cs., 2012) thì theo kết quả bảng trên, chúng tôi có 45,8% mẫu tinh trùng có sự trưởng thành nhân là bình thường và có đến 54,2% mẫu tinh trùng có sự bất thường trong quá trình đóng gói nhân. Trong khi đó, nếu lấy giá trị DFI làm ngưỡng là 60% thì chỉ có 4,2% mẫu tinh trùng có thiếu hụt protamin, dẫn đến sự bất thường trong quá trình đóng xoắn nhân, trưởng thành của tinh trùng. Như vậy, nghiên cứu này cũng chưa xác định được giá trị ngưỡng cut-off nên vẫn chưa thể có kết luận khách quan hơn về ý nghĩa lâm sàng của test CMA3.
Tỉ lệ DFI của test SCD
Mặc dù kết quả test SCD này được cho là tương đồng với phương pháp DBD-FISH được thực hiện cùng lúc (Fernandez và cs., 2005; Velez và cs., 2008) và khả năng phát hiện sai hỏng DNA của test SCD nhạy hơn so với phương pháp TUNEL (Feijo và Esteves, 2013); nhưng hiện nay, các mối liên hệ giữa kết quả SCD và các yếu tố khác cũng chưa được xem xét toàn diện.
Khi sử dụng kit Halosperm để đánh giá mức độ phân mảnh tinh trùng ở 622 cặp đôi tiến hành làm IVF và ICSI (2005), tác giả nhận thấy tỉ lệ phân mảnh tinh trùng có liên quan với các đặc điểm như: khả năng di động, hình thái và nồng độ của tinh trùng và tỉ lệ thụ thai trong hỗ trợ sinh sản, chất lượng tinh trùng; nhưng tỉ lệ phân mảnh tinh trùng lại không có liên quan với các dấu hiệu có thai lâm sàng hay tỉ lệ sinh con (Nunez-Calonge và cs., 2012). Kết quả nghiên cứu của Fernandez và cộng sự (2005) khi sử dụng kit Halosperm cũng cho thấy tỉ lệ tinh trùng có sự phân mảnh DNA trong các nhóm đối tượng có sự khác biệt (Bảng 3).
Bảng 3. Kết quả nghiên cứu tham khảo về tỉ lệ DFI của test CMA3 (Fernandez và cs., 2005)
| STT | Nhóm đối tượng | Tỉ lệ DFI |
| 1 | Có khả năng sinh sản | 16,3 ± 6,0 |
| 2 | Có tinh dịch đồ bình thường | 27,3 ± 11,7 |
| 3 | Tinh trùng bất thường (OAT: tinh trùng ít, yếu, dị dạng) | 47,3 ± 17,3 |
Sau đó vào năm 2006, tác giả Muriel và cộng sự thực hiện nghiên cứu để xác định giá trị của test SCD trong việc đánh giá mức độ phân mảnh tinh trùng trên các mẫu tinh trùng để tiên lượng kết quả IVF và ICSI. Tác giả cho biết tỉ lệ thụ thai tương quan nghịch với tỉ lệ phân mảnh DNA trong tinh trùng, sự phân mảnh tinh trùng cao hơn ở nhóm có phôi phân chia không đồng đều, phôi chậm phát triển; ngoài ra, sự phân mảnh tinh trùng cũng có tương quan nghịch với tỉ lệ cấy phôi thành công (Muriel và cs., 2006). Thêm vào đó, trong bài báo năm 2013 của tác giả khác nghiên cứu trên 89 mẫu tinh trùng bệnh nhân nam tham gia hỗ trợ sinh sản IVF, lại cho kết quả tỉ lệ phân mảnh của tinh trùng có tương quan nghịch với hình thái tinh trùng bình thường và kết quả cuối thai kỳ, nhưng lại tương quan thuận với các hình thái bệnh lý của tinh trùng, và không có mối liên hệ nào giữa tỉ lệ phân mảnh DNA tinh trùng với nồng độ và mức độ đóng xoắn nhân tinh trùng (Fortunato và cs., 2013).
Kết quả của nghiên cứu này (Bảng 4) cho thấy nếu chọn giá trị ngưỡng là khoảng 18% (Velez và cs., 2008; Nunez-Calonge và cs., 2012) thì tỉ lệ mẫu tinh trùng có sự phân mảnh DNA trong cỡ mẫu nghiên cứu là khoảng 32,6%. Nếu chọn giá trị ngưỡng là 30% (Agarwal và Allamaneni, 2004; Fernandez và cs., 2005; Tavalaee và cs., 2010) thì chỉ khoảng 12,2% mẫu tinh trùng có sự phân mảnh tinh trùng. Do ở nghiên cứu này chúng tôi sử dụng mẫu tinh dịch ngẫu nhiên của các cặp vợ chồng cần hỗ trợ sinh sản nói chung, nên vẫn chưa có cơ sở xác định chính xác mẫu tinh trùng thuộc nhóm có khả năng sinh sản hay không có khả năng sinh sản.
Bảng 4. Kết quả thống kê về tỉ lệ DFI của test SCD ở nghiên cứu này
| Nhóm | % DFI SCD | Số lượng | Tỉ lệ % |
| 1 | 0-9 | 8 | 16,3 |
| 2 | 10-19 | 25 | 51,0 |
| 3 | 20-29 | 10 | 20,4 |
| 4 | 30-39 | 5 | 10,2 |
| 5 | 40 trở lên | 1 | 2 |
Tương quan giữa CMA3 và SCD
Bảng 5. Mối tương quan giữa kết quả DFI của test CMA3 và test SCD
| Tương quan | CMA3 | Nhóm CMA3 | Nhận xét |
| SCD | P1=0,240 | P2=0,312 | P1, P2>0,05 |
| Nhóm SCD | P3=0,405 | P4=0,423 | P3, P4>0,05 |
Theo kết quả thống kê ở bảng 5, có thể nói sự khác biệt giữa kết quả CMA3 và test SCD không có ý nghĩa thống kê, nghĩa là kết quả test CMA3 và SCD không có mối liên quan gì với nhau. Điều này cũng khá dễ hiểu vì các test có đối tượng phát hiện khác nhau, trong khi nguyên lý của test CMA3 là nhằm phát hiện sự đóng xoắn vật liệu di truyền không hoàn toàn của NST tinh trùng, nhằm đánh giá độ trưởng thành của tinh trùng (Hoissain và cs., 2009). Ngược lại, nguyên lý phát hiện của test SCD là nhằm phát hiện sự đứt gãy DNA của nhân tinh trùng, nhằm đánh giá mức độ toàn vẹn vật liệu di truyền của tinh trùng (Agarwal và Said, 2007).
Mối liên hệ giữa DFI của từng test so với các thông số tinh dịch đồ
Hiện nay, việc đánh giá chất lượng tinh trùng thường dựa vào các tiêu chuẩn tinh dịch đồ truyền thống do WHO đề xuất như: mật độ tinh trùng, khả năng di động, hình thái... Tuy nhiên, cách xem xét chất lượng tinh trùng theo các tiêu chuẩn này vẫn chưa phù hợp vì các nguyên nhân sau: (1) sự đánh giá mật độ, khả năng di động, hình thái tinh trùng có thể cho các giá trị biến động rất lớn do quan sát hay do chủ quan của người kỹ thuật viên; (2) dù các phân tích tinh dịch đồ truyền thống đều đảm bảo những nguyên tắc chung nhưng lại thường chưa thể xác định rõ nguyên nhân gây vô sinh ở tinh trùng, như không đánh giá được quá trình apotosis của tinh trùng hay sự phân mảnh nhiễm sắc thể tinh trùng, do đó nhiều cặp vô sinh có thông số tinh dịch đồ bình thường nhưng vẫn không tìm ra được nguyên nhân vô sinh; (3) các giá trị ngưỡng cut-off của các thông số tinh dịch đồ không phải là giá trị phân biệt tuyệt đối, nó có thể là kết quả đồng thời giữa quần thể tinh trùng có khả năng sinh sản và không có khả năng sinh sản; (4) hiện nay, các nhà nghiên cứu đã có nhiều hiểu biết hơn về quá trình đóng gói nhiễm sắc thể, tương tác acrosome, ROS, apoptosis, tương tác giữa trứng-tinh trùng trong quá trình sinh sản… và có thể bổ sung thêm các test chức năng tinh trùng này vào các tiêu chuẩn đánh giá của WHO (Muriel và cs., 2006). Cũng chính vì thế, mối liên hệ giữa sự phân mảnh tinh trùng qua test SCD và sự trưởng thành tinh trùng so với các thông số tinh dịch đồ cũng cho kết quả khác biệt rất lớn giữa các nhóm nghiên cứu trên thế giới. Khi sử dụng kit SCD - Halosperm để đánh giá mức độ phân mảnh tinh trùng ở 622 cặp đôi tiến hành IVF và ICSI năm 2005, Velez de la Calle và cộng sự nhận thấy tỉ lệ phân mảnh tinh trùng có liên quan với các đặc điểm của tinh dịch đồ như: khả năng di động, hình thái và nồng độ của tinh trùng (Velez và cs., 2008). Tuy nhiên, trong bài báo năm 2013 của tác giả khác nghiên cứu trên 89 mẫu tinh trùng bệnh nhân nam tham gia hỗ trợ sinh sản IVF, lại cho kết quả tỉ lệ phân mảnh của tinh trùng có tương quan nghịch với hình thái tinh trùng bình thường, nhưng lại tương quan thuận với các hình thái bệnh lý của tinh trùng và không có mối liên hệ nào giữa tỉ lệ phân mảnh DNA tinh trùng với nồng độ tinh trùng [(Fortunato và cs., 2013).
Bảng 6. Mối liên hệ giữa DFI của từng test so với các thông số tinh dịch đồ
| Tương quan | SCD | Nhóm SCD | CMA3 | Nhóm CMA3 |
| Tuổi chồng | 0,366 | 0,078 | 0,321 | 0,054 |
| Mật độ tinh trùng | 0,242 | 0,024 | 0,280 | 0,292 |
| Di động tiến tới | 0,336 | 0,334 | 0,285 | 0,391 |
| Di động không tiến tới | 0,247 | 0,672 | 0,341 | 0,72 |
| Bất động | 0,209 | 0,837 | 0,285 | 0,044 |
| Hình dạng tinh trùng | 0,467 | 0,424 | 0,412 | 0,904 |
| ROS | 0,2 | 0,363 | 0,243 | 0,386 |
Kết quả bảng trên cho thấy: (1) mật độ tinh trùng có liên quan có ý nghĩa thống kê với kết quả test nhóm SCD và (2) tinh trùng bất động có liên quan có ý nghĩa thống kê với kết quả test nhóm CMA3. Ngoài ra, các thông số khác của tinh dịch đồ đều không phản ánh được trạng thái trưởng thành hay sự phân mảnh DNA của tinh trùng.
Thử nghiệm thực tế: so sánh kit tự pha với kit Halosperm nước ngoài
Bảng 7. Mối liên hệ giữa kết quả kit Halosperm với các test CMA3 và SCD
| Tương quan | SCD | Nhóm SCD | CMA3 | Nhóm CMA3 | Nhận xét |
| Halosperm | 0,39 | 0,746 | 0,39 | 0,605 | P>0,05 |
Kết quả bảng trên cho thấy sự khác biệt giữa test CMA3 và SCD so với Halosperm đều không có ý nghĩa thống kê. Sự không phù hợp giữa kết quả giữa Halosperm và CMA3 có thể dễ dàng nhận thấy nguyên nhân là do nguyên lý hoạt động và mục tiêu phát hiện của 2 loại test này là khác nhau. Ngoài ra, sự không phù hợp giữa kết quả Halosperm và test SCD có cùng nguyên lý hoạt động và mục tiêu phát hiện cũng có thể được giải thích bởi một số nguyên nhân sau: (1) thời gian thực hiện song song 2 loại test trên ở cùng một mẫu có thể chênh lệch nhau 30 phút - 1 giờ, trong khi tinh trùng là một loại tế bào rất nhạy cảm với các biến đổi của môi trường và thường có sức sống giảm dần theo thời gian, sự giảm sức sống này nhanh hay chậm còn tùy thuộc vào sức bền của mỗi mẫu tinh trùng cụ thể, môi trường tác động...; (2) cách xử lý mẫu tinh dịch khác nhau, có pha loãng mẫu hay không pha loãng mẫu trước khi trộn với gel LMA ấm, tránh sáng hay không, giảm tối đa các biến đổi về hình thái, vật liệu di truyền, sức sống của tinh trùng mới phát sinh, có thể ảnh hưởng đến kết quả; (3) bộ hóa chất sử dụng lysis và hóa chất nhuộm tinh trùng để thực hiện qui trình có thể khác nhau, khiến cho hình dạng của các tế bào tinh trùng bị biến đổi theo các chiều hướng khác nhau. Kit Halosperm sử dụng thuốc nhuộm Wright để có thể quan sát hình ảnh tinh trùng có hay không có quầng sáng halo dưới kính hiển vi điện tử, ngược lại, test SCD của chúng tôi sử dụng thuốc nhuộm phát huỳnh quang DAPI để quan sát.
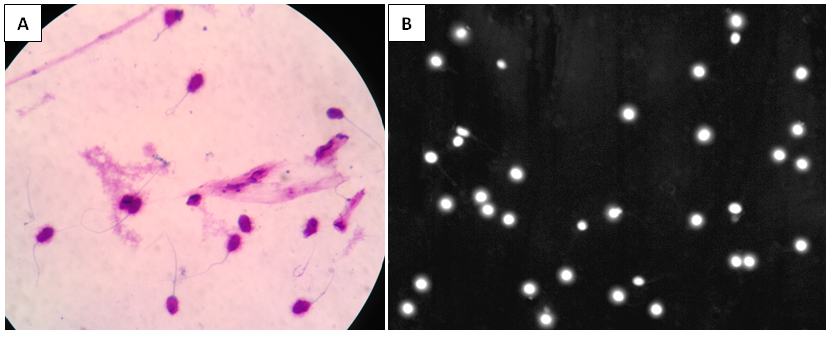 |
|
Hình 5. Hình ảnh kết quả kit Halosperm (Hình A) và kết quả test SCD (Hình B) của cùng 1 mẫu tinh trùng 02 |
Từ những kết quả thu được, chúng tôi có thể phân biệt một số đặc điểm chính của từng loại test (Bảng 8).
Bảng 8. Phân biệt các đặc điểm khác nhau của 3 loại test CMA3, SCD và kit Halosperm
| Đặc điểm | Test CMA3 | Test SCD | Kit Halosperm |
| Mục tiêu | Phát hiện sự đóng xoắn không hoàn toàn của nhân tinh trùng |
Phát hiện sự phân mảnh DNA trong tinh trùng |
|
| Yêu cầu mẫu |
Nồng độ tinh trùng tối thiểu 1 triệu/ml trở lên |
Nồng độ tinh trùng tối thiểu 20 triệu/ml trở lên |
|
| Thời gian thực hiện | Qua đêm | 40 phút | 1 giờ |
| Thiết bị cần thiết | Kính hiển vi huỳnh quang | Kính hiển vi điện tử | |
| Lưu trữ hóa chất | Tủ âm 200C | Tủ mát 40C | Tủ mát 40C |
| Chi phí hóa chất | Khoảng 80.000 đồng/test | Khoảng 50.000 đồng/test | Khoảng 500.000 đồng/test |
Như vậy, qui trình SCD phát hiện sự phân mảnh DNA tinh trùng là một test dễ thực hiện, chi phí hóa chất thấp, có thể áp dụng cho các mẫu tinh trùng có nồng độ cực thấp (1-10 triệu tinh trùng/ml), nhưng vẫn còn hạn chế là cần quan sát hình ảnh bằng kính hiển vi huỳnh quang.
KẾT LUẬN VÀ ĐỀ NGHỊ
Qui trình CMA3 và SCD là 2 qui trình kỹ thuật khá đơn giản, dễ thực hiện, chi phí thấp, có khả năng phát hiện các bất thường trong vật liệu di truyền của tinh trùng ở mức độ tế bào. Tuy nhiên, cần có thêm các nghiên cứu bổ sung nhằm xác định ý nghĩa của các qui trình này trong các liệu pháp hỗ trợ sinh sản.
TÀI LIỆU THAM KHẢO
1. Agarwal A, Allamaneni SSR (2004). The effect of sperm DNA damage on assisted reproduction outcomes. Minerva ginecol; 56:235-245.
2. Agarwal A, Said TM (2007). Sperm chromatin assessment. Textbook of Assisted Reproductive Techniques. Informa Healthcare.
3. Esterhuizen AD, Franken DR, Lourens JGH, Prinsloo E, Van Rooyen LH (2000). Sperm chromatin packaging as an indicator of in-vitro fertilization rate. Hum Reprod; 15:657-661.
4. Evenson DP, Jost LK, Marshall D, Zinaman MJ, Clegg E, Purvis K et al. (1999). Utility of sperm chromatin structure assay (SCSA) as a diagnostic and prognostic tool in the human fertility clinic. Hum Reprod; 76:86-94.
5. Feijo CM, Esteves SC (2013). Diagnostic accuracy of sperm chromatin dispersion test to evaluate sperm deoxyribonucleic acid damage in men with unexplained infertility. Fertilize.
6. Fernandez JL, Muriel L, Goyanes V, Segrelles E, Gosalvez J et al. (2005). Simple determination of human sperm DNA fragmentation with an improved sperm chromatin dispersion test. Fertility and Sterility; Vol.84.
7. Fortunato A, Leo R, Casale S, Nacchia G, Liguori F, Tosti E (2013). Sperm DNA fragmentation assays correlate with sperm abnormal morphology and the prenancy outcome. J IVF Reprod Med Genet; 1:1.
8. Gutierrez R, Becquer P, Pandolfi A, Cuevillas G, Pupo J, Hernandez EW, Riverron G, Pereira N, Cuetara E (2007). DNA damage measurement using a modified protocol of sperm chromatin dispersion test. Pharmacologyonline; 1:14-19.
9. Hoissain A, Hossain S, Phelps J (2009). Human sperm bioassay. Diagnosis evaluation.
10. Muriel L, Garrido N, Fernandez JL, Remohi J, Pellicer A, Jose de los Santos M, Meseguer M (2006). Value of the sperm deoxyribonucleic acid fragmentation level, as measured by the sperm chromatin dispersion test, in the outcome of in vitro fertilization and intracytoplasmic sperm injection. Fertility and Sterility; Vol.85, No.2.
11. Nguyễn Viết Tiến và cs. (2009). Tỉ lệ hiện mắc vô sinh và một số yếu tố ảnh hưởng. Bệnh viện Phụ Sản Trung ương.
12. Nunez-Calonge R, Caballero P, Lopez-Frenandez C, Guijarro JA, Fernandez JZ, Johnstone S et al. (2012). Am improve experimental model for understanding the impact of sperm DNA fragmentation on human pregnancy following ICSI. Repro Sci; 19:1163-1168.
13. Ramadan A Saleh et al. (2002). Increase sperm nuclear DNA damage in normalzoospermic infertile men: a prospective study. Elsevier Science Inc.
14. Tarozzi N, Nadalini M, Stronati A, Bizzao D, Dal Prato L, Coticcichio G et al. (2009). Abnormalies in sperm chromatin packaging: implication for assisted reproduction techniques. Reprod Biomed Online.
15. Tavalaee M, Kiani A, Arbabian M, Deemeh MR, Esfahani MHN (2010). Flow cytometry: a new approach for indirect assessment of sperm protamine deficiency. IJFS; Vol.3, No.4.
16. Tavalaee M, Razavi S, Nasr-Esfahani MH (2007). Effects of spermiogenesis defects on fertilization and pregnancy rate in IVF patients. Yakhteh.
17. Trevor G Coope et al. (2010). WHO laboratory manual for the Examination and processing of human semen. Fifth edition, WHO Press.
18. Velez de la Calle JF, Muller A, Walschaerts, Clavere JL, Jimennez C, Wittemer C, Thonneau P (2008). Sperm deoxyribonucleotid acid fragmentation as assessed by the sperm chromatin dispersion test in assisted reproductive technology programs: results of a large prospective multicenter study. Fertility and Sterility.
19. Zandemami M, Quieq D, Akhondi MM, Kamali K, Raygani M, Lakpour N, Shiraz ES, Sadeghi MR (2012). Correlation of CMA3 staining with sperm quality and protamine deficiency. Lab Medicine; 262-267.
Từ khóa: DNA phân mảnh ở tinh trùng người
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Năm 2020
Khách sạn Equatorial, chủ nhật ngày 23 . 11 . 2025
GIỚI THIỆU SÁCH MỚI

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...
FACEBOOK








