CN. Đinh Thị Ngọc Ánh
Đơn vị HTSS IVFMD FAMILY, BVĐK Gia Đình, Đà Nẵng
Thụ tinh trong ống nghiệm (TTTON) là một phương pháp hỗ trợ sinh sản tiên tiến, trong đó noãn và tinh trùng được kết hợp bên ngoài cơ thể người phụ nữ trong một môi trường được kiểm soát chặt chẽ. Sau khi thụ tinh thành công, phôi sẽ được nuôi cấy và chuyển vào tử cung để tiếp tục phát triển thành thai nhi. Đây là một giải pháp hiệu quả cho những cặp vợ chồng gặp khó khăn trong việc thụ thai tự nhiên do hiếm muộn hoặc vô sinh. Một trong những yếu tố then chốt quyết định thành công của TTTON là việc lựa chọn phôi và giao tử tối ưu. Phương pháp truyền thống hiện nay chủ yếu dựa trên đánh giá hình thái học dưới kính hiển vi – một cách tiếp cận đơn giản, không xâm lấn, tiết kiệm chi phí và được ứng dụng rộng rãi tại các trung tâm IVF. Phương pháp này giúp giảm thiểu rủi ro cho bệnh nhân, nhưng vẫn tồn tại những hạn chế do sự phụ thuộc vào kinh nghiệm và tính chủ quan của các chuyên viên phôi học. Dù còn nhiều thách thức, đánh giá hình thái học vẫn đóng vai trò nền tảng trong quy trình TTTON, góp phần quan trọng vào việc lựa chọn những phôi có tiềm năng phát triển tốt nhất.
Tiềm năng ứng dụng trí tuệ nhân tạo (Artificial intelligence – AI) trong TTTON là rất lớn, đặc biệt khi máy học (machine learning - ML) và học sâu (deep learning - DL) ngày càng phát triển. Tại các nước phát triển, AI đã được áp dụng rộng rãi và mang lại nhiều kết quả tích cực trong lĩnh vực thụ tinh trong ống nghiệm, đặc biệt trong việc lựa chọn giao tử và phôi.
-
Tổng quan
Việc áp dụng AI vào việc lựa chọn noãn và tinh trùng mang lại lợi ích to lớn cho hỗ trợ sinh sản. Chọn lựa noãn dựa trên AI có khả năng xác định được các noãn có tiềm năng phát triển cao nhất để thụ tinh. Điều này có thể làm tăng hiệu quả của quy trình IVF và giảm việc tạo ra các phôi chất lượng kém, hoặc bất thường về nhiễm sắc thể. Lựa chọn noãn dựa vào AI tức là đánh giá chất lượng noãn mà không xâm lấn, không làm ảnh hưởng đến chất lượng của noãn. Vì sự xuất hiện của các cấu trúc đặc trưng của noãn có liên quan đến quá trình thụ tinh thành công, nên các thuật toán ML đã hướng đến việc phân tích chúng (1). Nghiên cứu về ứng dụng của hệ thống AI vào việc đánh giá, phân loại và lựa chọn tinh trùng thường tiên tiến hơn so với nghiên cứu về noãn. Hơn nữa, không giống như noãn, các thông số có thể nhận dạng bằng mắt thường như khả năng di chuyển và hình thái của tinh trùng đã được chứng minh là phản ánh tính toàn vẹn của DNA (2). Thông qua các mô hình, AI có thể phân tích hàng ngàn hình ảnh phôi, nhận diện các đặc điểm tiềm ẩn mà con người có thể bỏ qua, từ đó đưa ra các dự đoán chính xác về khả năng phát triển của phôi. Điều này giúp tăng tỉ lệ thành công của TTTON và cải thiện khả năng sinh sản. Học máy (ML) và học sâu (DL) là hai phương pháp chủ chốt được sử dụng trong AI để phân tích dữ liệu phức tạp. ML sử dụng các thuật toán để học từ dữ liệu quá khứ và cải thiện dự đoán, trong khi DL sử dụng các mạng nơron nhân tạo để mô phỏng cách thức hoạt động của bộ não, xử lý và phân tích dữ liệu lớn một cách hiệu quả.
2.Học máy và học sâu trong TTTON
.png)
Hình 1. Quy trình làm việc của trí tuệ nhân tạo trong hỗ trợ sinh sản (3)
Học máy (Machine Learning – ML) là một công cụ quan trọng trong trí tuệ nhân tạo, với quá trình hoạt động gồm hai giai đoạn then chốt: đào tạo và thử nghiệm. Trong giai đoạn đào tạo, mô hình được cung cấp tập dữ liệu có nhãn bao gồm các đặc trưng đầu vào và kết quả mong đợi. Từ đó, mô hình học cách nhận diện các quy luật và mối quan hệ tiềm ẩn trong dữ liệu, nhằm đưa ra dự đoán hoặc phân loại chính xác khi gặp dữ liệu mới (4). Sau khi hoàn tất đào tạo, mô hình được đánh giá trong giai đoạn thử nghiệm bằng một tập dữ liệu độc lập chưa từng sử dụng trước đó. Hiệu quả được đo lường thông qua các chỉ số như độ chính xác, độ nhạy, độ đặc hiệu, AUC-ROC, điểm F1 và cả thời gian thực thi. Học sâu (Deep Learning – DL) là một nhánh nâng cao của ML và được coi là công nghệ cốt lõi trong Cách mạng Công nghiệp 4.0. So với các thuật toán ML truyền thống, học sâu yêu cầu nhiều thời gian để huấn luyện do số lượng lớn tham số, nhưng lại có lợi thế vượt trội ở tốc độ dự đoán trong giai đoạn thử nghiệm (5). Các kỹ thuật như rừng ngẫu nhiên (Random Forest - RF), máy vecto hỗ trợ (Support Vector Machine - SVM), mạng nơron nhân tạo (Artificial Neural Network - ANN), mạng nơron tích chập (Convolutional Neural Network - CNN),… đang được ứng dụng rộng rãi trong y học sinh sản. Chúng có khả năng phân tích và học các đặc điểm phức tạp của phôi và giao tử, từ đó hỗ trợ quá trình lựa chọn phôi một cách khách quan, không xâm lấn, tiết kiệm thời gian và đạt độ chính xác cao (6). Đây được xem là một bước tiến mới trong tối ưu hóa hiệu quả thụ tinh trong ống nghiệm.
-
Ứng dụng AI trong lựa chọn giao tử
Các hệ thống AI có khả năng tìm kiếm, lựa chọn, phân tích và chẩn đoán chất lượng noãn và tinh trùng dựa trên dữ liệu hình ảnh và thông số động học. Thông qua các thuật toán học máy và học sâu, AI có thể nhận diện các đặc điểm hình thái, đánh giá khả năng di động của tinh trùng, chất lượng bào tương hoặc mức độ trưởng thành của noãn.
3.1 Đánh giá tự động tiềm năng phát triển của noãn người dựa trên mạng nơ-ron tích chập
Năm 2021, Dennis B. và cộng sự đã giới thiệu một phương pháp hoàn toàn tự động nhằm phân loại noãn trên hình ảnh kính hiển vi quang học thành hai nhóm: khả thi và không khả thi (7). Những noãn được phân loại là khả thi được xem là có tiềm năng phát triển thành phôi chất lượng tốt. Trong nghiên cứu, nhóm tác giả sử dụng 34 hình ảnh greyscale của các cụm tế bào noãn sau khi đã loại bỏ tế bào cumulus. Mỗi hình ảnh chứa từ 1 đến 7 tế bào noãn, và chỉ những noãn được ghi nhận đầy đủ trong trường quan sát mới được đưa vào phân tích, tổng cộng 103 noãn (50 khả thi, 53 không khả thi). Phương pháp được áp dụng dựa trên mạng nơ-ron tích chập (Convolutional Neural Network – CNN), triển khai trên bản đồ phân đoạn noãn để dự đoán tiềm năng phát triển. Các lớp trong bản đồ phân đoạn được chú thích bởi chuyên gia, bao gồm: nền (màu đen), tế bào chất (xanh lam), màng trong suốt (xanh lục), thể cực (đỏ) và tế bào cumulus (vàng). Dựa trên phân tích này, các noãn khả thi và không khả thi lần lượt được đánh dấu bằng khung xanh lục và đỏ. Kết quả nghiên cứu cho thấy mô hình đạt độ chính xác phân loại 70%, mở ra tiềm năng ứng dụng AI trong hỗ trợ lựa chọn noãn nhằm nâng cao hiệu quả của quy trình thụ tinh trong ống nghiệm.
.png)
Hình 2. Đánh giá tự động tiềm năng phát triển của noãn từ hình ảnh kính hiển vi (7)
3.2 Dự đoán chất lượng noãn bằng học máy tích hợp công nghệ vi lưu
Nghiên cứu của Hassan năm 2025 vừa trình bày một hướng tiếp cận mới trong đánh giá chất lượng noãn bằng cách kết hợp công nghệ vi lưu (microfluidic) và học máy (8). Nhóm nghiên cứu đã thiết kế một kênh vi lưu tùy chỉnh cho phép ghi nhận biến dạng của noãn khi đi qua dòng chảy, từ đó trích xuất các đặc trưng sinh cơ học gồm căng bề mặt vỏ (Cortical Tension – CT), chỉ số biến dạng (Deformation Index – DI), đường kính tế bào, và lưu lượng tới hạn (Q). Dữ liệu của 54 noãn chuột ở giai đoạn GV được phân loại dựa trên khả năng trưởng thành, thụ tinh và phân cắt phôi, sau đó huấn luyện bằng các mô hình học máy. Kết quả cho thấy mô hình rừng ngẫu nhiên đạt độ chính xác cao nhất (76,1%), đặc biệt khi sử dụng kết hợp các đặc trưng CT, Q và DI. Phân tích tương quan chỉ ra mối liên hệ chặt giữa CT và Q (r = 0,9) cũng như mối tương quan âm với DI, khẳng định vai trò sinh học của các đặc trưng cơ học trong tiên lượng khả năng phát triển của noãn. So với các phương pháp đánh giá hình thái hoặc time-lapse, mô hình vi lưu – AI này có chi phí thấp (~5.000 USD), thời gian phân tích nhanh (~2 phút/noãn) và không gây tổn hại cấu trúc tế bào. Nghiên cứu chứng minh rằng việc tích hợp dữ liệu phi hình thái giúp cải thiện đáng kể độ khách quan và độ chính xác trong dự đoán chất lượng noãn, mở ra triển vọng ứng dụng trong tối ưu hóa quy trình lựa chọn giao tử và tăng hiệu quả thụ tinh trong ống nghiệm.
3.3 Dự đoán tỉ lệ thụ tinh bằng học sâu dựa trên hình thái noãn
Thirumalaraju và cộng sự đã phát triển một mô hình học sâu dựa trên hình thái noãn nhằm dự đoán khả năng thụ tinh (9). Hình ảnh noãn và phôi người từ Embryoscope được sử dụng để huấn luyện mạng nơ-ron tích chập sâu (CNN) với 2.123 ảnh, kiểm nghiệm trên 712 ảnh độc lập. Mô hình phân loại noãn theo kết quả thụ tinh bình thường (2PN) hay bất thường sau 18 giờ thụ tinh. Kết quả cho thấy mô hình đạt độ chính xác 67%, AUC = 0,6133, và sau tinh chỉnh đạt khả năng dự đoán tối đa 86%. Nghiên cứu chứng minh rằng trí tuệ nhân tạo có thể hỗ trợ đánh giá khách quan chất lượng noãn, giúp lựa chọn noãn tối ưu và cải thiện tiên lượng trong thụ tinh trong ống nghiệm
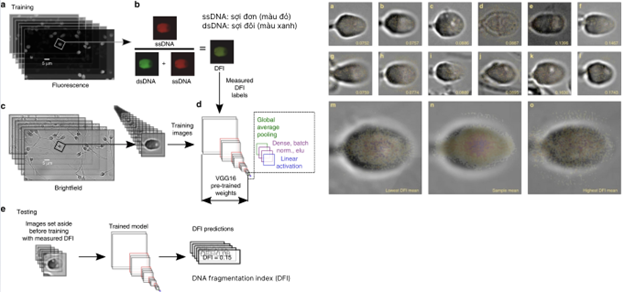
3.4 Kiểm tra hình thái tinh trùng tự động bằng trí tuệ nhân tạo
Yếu tố chính trong việc chẩn đoán vô sinh ở nam giới là phân tích hình thái tinh trùng (Sperm Morphology Analysis - SMA). Thirumalaraju và cộng sự (2018) đã phát triển ANN được đào tạo và xác thực với 3820 tinh trùng được chia thành các tập huấn luyện và thử nghiệm với tỷ lệ chia 80-20 (10). Tất cả các hình ảnh tinh trùng được sử dụng trong quá trình đào tạo đều được chú thích bởi 10 kỹ thuật viên phòng thí nghiệm khác nhau, trong đó mỗi hình ảnh được chú thích ba lần. Khi mô hình được thử nghiệm với 415 hình ảnh tinh trùng riêng lẻ, mô hình này có thể xác định chính xác 371 tinh trùng (khoảng 89%) dựa trên các chú thích thu được từ các kỹ thuật viên. Nhóm nghiên cứu thực hiện đánh giá hiệu suất của mạng lưới trong việc đánh giá các mẫu tinh dịch để xét nghiệm hình thái tinh trùng. Mô hình thực hiện với độ chính xác 100% trong việc xác định tất cả các mẫu bất thường và bình thường. Độ nhạy và độ đặc hiệu của mô hình là 100% với giá trị dự đoán dương tính và âm tính là 100%.
-
Phần mềm máy tính hỗ trợ lựa chọn tinh trùng đơn lẻ theo thời gian thực liên quan đến quá trình thụ tinh và hình thành phôi nang
Chất lượng tinh trùng đóng vai trò quan trọng trong sự phát triển của phôi, có thể ảnh hưởng ngay từ giai đoạn đầu và làm giảm tỷ lệ hình thành phôi nang. Do đó, việc lựa chọn tinh trùng chất lượng cao là một bước thiết yếu, đòi hỏi sự chính xác và kinh nghiệm của chuyên viên phôi học. Nhằm tối ưu hóa quá trình này, một hệ thống hỗ trợ dựa trên thị giác máy tính và trí tuệ nhân tạo (Sperm ID - SiD) đã được phát triển (11). SiD có khả năng phát hiện và nhận dạng tinh trùng đơn lẻ trực tiếp dưới kính hiển vi ICSI (độ phóng đại ≥20x), phân tích đặc điểm hình thái và khả năng di động để hỗ trợ lựa chọn nhanh chóng và khách quan. Hệ thống tính toán các thông số di động tiến tới như VSL (straight-line velocity - tốc độ theo đường thẳng) và LIN (linearity - chỉ số tuyến tính), đồng thời định lượng kiểu chuyển động đầu tinh trùng. Các đặc điểm này được xử lý, đánh giá và xếp hạng theo thời gian thực, cho phép hiển thị trực quan kết quả trên màn hình. Nhờ đó, SiD mang lại một công cụ hỗ trợ hiệu quả, giúp cải thiện độ chính xác trong lựa chọn tinh trùng cho ICSI, qua đó nâng cao tiềm năng phát triển phôi và tỷ lệ thành công lâm sàng.
Hình 3. Giao diện người dùng đồ họa của SiD. Màn hình hiển thị quá trình chọn lọc và thu thập tinh trùng ngay trước khi tiêm tinh trùng vào bào tương (11)
Cho đến nay, số lượng nghiên cứu về mối liên hệ giữa lựa chọn tinh trùng có hỗ trợ AI và kết quả ICSI còn rất hạn chế. Để khắc phục khoảng trống này, nghiên cứu đã tiến hành trên 646 noãn MII anh chị em, được phân ngẫu nhiên thành hai nhóm: (i) ICSI, sử dụng tinh trùng được lựa chọn thủ công bởi chuyên viên phôi học, và (ii) ICSI-SiD, sử dụng tinh trùng được chọn bằng phần mềm SiD (12). Kết quả cho thấy, nhóm ICSI-SiD có xu hướng cải thiện nhẹ, nhưng không có ý nghĩa thống kê, ở nhiều thông số sinh học bao gồm: tỷ lệ thụ tinh, phân cắt, phát triển phôi ngày 3, hình thành phôi nang và chất lượng phôi ngày 5. Tỷ lệ mang thai sớm và mang thai lâm sàng tích lũy sau ICSI-SiD tương đương với phương pháp ICSI thông thường. Nghiên cứu sơ bộ này cho thấy lựa chọn tinh trùng bằng AI (SiD) mang lại kết quả sinh học tương đương với lựa chọn thủ công, gợi ý tính khả thi của phần mềm như một công cụ hỗ trợ trong thực hành lâm sàng.
-
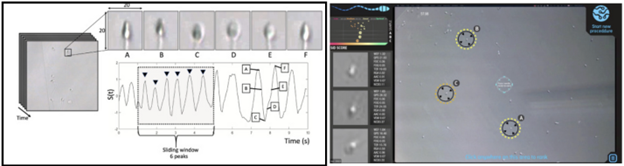
Lựa chọn tinh trùng người có tính toàn vẹn DNA cao dựa trên học sâu
nghiệm và mô hình) (13)
Trong nghiên cứu này, một mô hình CNN được sử dụng nhằm dự đoán mức độ phân mảnh DNA (DNA Fragmentation Index – DFI) của tinh trùng dựa trên hình ảnh hiển vi trường sáng. Phân mảnh DNA là chỉ số quan trọng phản ánh tính toàn vẹn di truyền của tinh trùng và có liên quan trực tiếp đến tiềm năng thụ tinh cũng như sự phát triển phôi. Thay vì dựa vào các phương pháp nhuộm huỳnh quang truyền thống mang tính xâm lấn, cách tiếp cận này cho phép ước lượng DFI một cách gián tiếp, không gây tổn hại đến tinh trùng. Mô hình được huấn luyện trên hơn một nghìn hình ảnh tinh trùng với giá trị DFI đã được đo trước đó, thu thập từ nhiều mẫu người hiến khỏe mạnh. Sau khi huấn luyện, CNN cho thấy khả năng dự đoán DFI với độ tương quan đáng kể so với giá trị thực, đồng thời có thể phân loại tinh trùng thành các nhóm có chỉ số phân mảnh thấp, trung bình hoặc cao. Kết quả minh họa tiềm năng của trí tuệ nhân tạo trong việc hỗ trợ lựa chọn tinh trùng có tính toàn vẹn DNA cao mà không cần can thiệp trực tiếp (13).
4. Ứng dụng AI trong lựa chọn phôi
4.1 Dự đoán tiềm năng phát triển phôi nang từ hình ảnh phôi phân chia
Học sâu có thể tiên lượng tiềm năng phát triển thành phôi nang từ hình ảnh của phôi ngày 2 và ngày 3 bằng mô hình CNN được báo cáo bởi Thirumalaraju và cộng sự vào năm 2019 (14). Nghiên cứu đã cho thấy AI có thể ứng dụng trong việc lựa chọn phôi tốt giai đoạn phân chia một cách khách quan với độ chính xác cao. Thirumalaraju và cộng sự sử dụng một tập dữ liệu bao gồm 1.282 phôi được thụ tinh bình thường. 10 chuyên viên phôi học thực hiện đánh dấu dữ liệu. Tập dữ liệu được chia thành 1100 phôi để huấn luyện và 182 phôi để thử nghiệm (tỉ lệ training data: testing data ~ 1:6). Thuật toán học sâu này có thể dự đoán phôi có phát triển đến giai đoạn phôi nang hay không với độ chính xác là 68,13% khi sử dụng một hình ảnh duy nhất được chụp tại ngày 2 với độ nhạy 74,16%. Khi sử dụng một hình ảnh duy nhất được chụp tại ngày 3, độ chính xác của việc dự đoán sự phát triển phôi nang là 71,42% với độ nhạy 75,83%.
4.2 Lựa chọn phôi chất lượng cao dựa trên mạng nơron
Nghiên cứu của Khosravi và cộng sự khai thác dữ liệu hình ảnh phôi thai được thu thập tại Trung tâm Y học Sinh sản, Weill Cornell Medicine, từ tháng 5/2012 đến 12/2017, được gọi là tập dữ liệu WCM-NY (15). Đầu tiên, nhóm nghiên cứu đã chuẩn bị và xử lý hình ảnh bằng cách loại bỏ các hình ảnh gây nhiễu và gắn nhãn cho tập dữ liệu thành 3 loại như chất lượng tốt, chất lượng trung bình và chất lượng kém dựa trên hệ thống phân loại của Veeck và Zaninovic. Khosravi chia các hình ảnh thành các nhóm đào tạo, xác thực và thử nghiệm, phân bổ 70% hình ảnh cho nhóm đào tạo và 30% còn lại cho các nhóm xác thực và thử nghiệm. Các tập đào tạo, xác thực và thử nghiệm không chồng chéo.
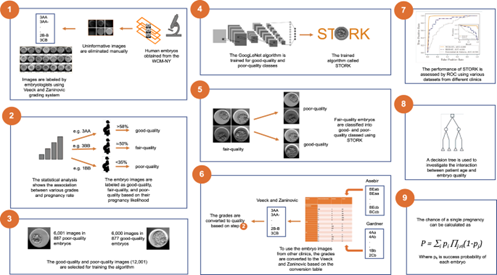
Hình 5. Sơ đồ minh họa thiết kế và đánh giá STORK (15)
Kết quả của nghiên cứu cho thấy thuật toán đã được đào tạo có thể xác định hình ảnh chất lượng tốt và chất lượng kém với độ chính xác 96,94% (1871 dự đoán đúng trong số 1930 hình ảnh). Để đánh giá mô hình STORK (15), nhóm nghiên cứu đã kiểm tra hiệu suất của nó bằng cách sử dụng các tập dữ liệu bổ sung về hình ảnh phôi thu được từ hai trung tâm IVF khác, Universidad de Valencia và IRDB-IC, bao gồm 127 phôi (74 chất lượng tốt, 53 chất lượng kém) và 87 (61 chất lượng tốt, 26 chất lượng kém). Kết quả thử nghiệm chứng minh rằng mặc dù hệ thống tính điểm được sử dụng cho các trung tâm này khác với hệ thống được sử dụng để đào tạo mô hình STORK, mô hình này vẫn xác định và ghi lại thành công các biến thể điểm và phân biệt chúng một cách mạnh mẽ, với AUC (the area under the ROC curve - diện tích dưới đường cong ROC) lần lượt là 0,759 và 0,901.
Để so sánh hiệu quả của STORK so với các chuyên viên phôi học trong việc lựa chọn phôi, nhóm nghiên cứu đã yêu cầu năm nhà phôi học từ ba phòng khám khác nhau cung cấp điểm số cho mỗi phôi trong số 394 phôi được tạo ra trong các phòng thí nghiệm khác nhau. Nghiên cứu cho thấy mức độ đồng thuận thấp giữa các nhà phôi học với chỉ 89 phôi trong số 394 phôi được cả năm nhà phôi học phân loại là có cùng chất lượng. Do đó, để tạo ra một tập dữ liệu chuẩn lớn hơn và chính xác hơn, nhóm nghiên cứu đã sử dụng quy trình bỏ phiếu đa số của các nhà phôi học (tức là chất lượng của mỗi hình ảnh được xác định bằng điểm số do ít nhất ba trong số năm nhà phôi học đưa ra) để phân loại 239 hình ảnh. Khi áp dụng STORK cho 239 hình ảnh này, nhóm nghiên cứu thấy rằng nó dự đoán được phiếu bầu đa số của các nhà phôi học với độ chính xác là 95,7%. Để so sánh, STORK đồng ý với từng nhà phôi học riêng lẻ như sau: 0,69, 0,54, 0,25, 0,62 và 0,54. Những kết quả này chỉ ra rằng STORK có thể vượt trội hơn các nhà phôi học riêng lẻ khi đánh giá chất lượng hình ảnh phôi.
Mục tiêu cuối cùng của bất kỳ phương pháp đánh giá phôi nào là xác định các phôi có tiềm năng làm tổ cao nhất dẫn đến sinh con sống (16). Nhóm đã sử dụng phương pháp cây quyết định phân cấp bằng cách kết hợp chất lượng phôi và độ tuổi của bệnh nhân được gọi là thuật toán phát hiện tương tác tự động chi bình phương (Chi-squared Automatic Interaction Detection - CHAID). Nhóm nghiên cứu đã thiết kế một cây quyết định CHAID sử dụng 2182 phôi từ cơ sở dữ liệu WCM-NY với thông tin lâm sàng có sẵn và kết quả thai kỳ. Kết quả xác nhận mối liên hệ giữa xác suất mang thai thành công và độ tuổi của bệnh nhân. Xác suất sinh con sống đối với những bệnh nhân có phôi chất lượng tốt cao hơn đáng kể so với những bệnh nhân có phôi chất lượng kém ở các độ tuổi khác nhau.
5. Kết luận
So với phương pháp lựa chọn phôi truyền thống dựa trên hình thái, AI kết hợp với hệ thống timelapse mang lại sự đánh giá khách quan, ổn định và khả năng theo dõi chi tiết toàn bộ quá trình phát triển của phôi. Các thuật toán hiện đại đã được áp dụng nhằm nâng cao độ chính xác, tuy nhiên phần lớn nghiên cứu vẫn còn hạn chế về quy mô, số lượng và chủ yếu dựa vào dữ liệu hình ảnh tĩnh, nên tính khái quát hóa chưa cao. Một thách thức đáng kể trong việc triển khai AI tại các labo TTTON là chi phí đầu tư lớn cho hạ tầng công nghệ, phần mềm chuyên dụng và đào tạo nhân lực, đi kèm với những băn khoăn về đạo đức khi AI có thể bị lạm dụng để lựa chọn đặc điểm di truyền mong muốn. Vì vậy, cần xây dựng các quy định và khung pháp lý chặt chẽ, đồng thời tiếp tục nghiên cứu sâu rộng để tối ưu hiệu quả và thúc đẩy ứng dụng AI một cách an toàn, bền vững trong lĩnh vực y học sinh sản.
Tài liệu tham khảo
1. Lazzaroni-Tealdi E, Barad DH, Albertini DF, Yu Y, Kushnir VA, Russell H, et al. Oocyte Scoring Enhances Embryo-Scoring in Predicting Pregnancy Chances with IVF Where It Counts Most. PLOS ONE. 2015 thg 12;10(12):e0143632.
2. Zhang Z, Dai C, Shan G, Chen X, Liu H, Abdalla K, et al. Quantitative selection of single human sperm with high DNA integrity for intracytoplasmic sperm injection. Fertil Steril. 2021 Nov 1;116(5):1308–18.
3. Wang R, Pan W, Jin L, Li Y, Geng Y, Gao C, et al. Artificial intelligence in reproductive medicine. 2019 Oct 1;
4. Varoquaux G, Colliot O. Evaluating Machine Learning Models and Their Diagnostic Value. In: Colliot O, editor. Machine Learning for Brain Disorders. 2023.
5. Sarker IH. Deep Learning: A Comprehensive Overview on Techniques, Taxonomy, Applications and Research Directions. Sn Comput Sci. 2021;2(6):420.
6. Jain, K. Fertility Science and Research. Artificial intelligence in assisted reproductive technology--current scenario and future implications. - Document - Gale Academic OneFile. vol 6, no 2. 2019 Dec;57.
7. Baručić D, Kybic J, Teplá O, Topurko Z, Kratochvílová I. Automatic evaluation of human oocyte developmental potential from microscopy images. In: Walker A, Rittner L, Romero Castro E, Lepore N, Brieva J, Linguraru MG, editors. Campinas, Brazil; 2021.
8. Saffari H, Fathi D, Palay P, Gourabi H, Fathi R. Machine learning and microfluidic integration for oocyte quality prediction. Sci Rep. 2025 Jul 22;15(1):26532.
9. Thirumalaraju P, Bormann CL, Kanakasabapathy MK, Kandula H, Shafiee H. Deep learning-enabled prediction of fertilization based on oocyte morphological quality. Fertil Steril. 2019 Sep 1;112(3):e275.
10. Thirumalaraju P, Bormann CL, Kanakasabapathy M, Doshi F, Souter I, Dimitriadis I, et al. Automated sperm morpshology testing using artificial intelligence. Fertil Steril. 2018 Sep 1;110(4):e432.
11. Mendizabal-Ruiz G, Chavez-Badiola A, Aguilar Figueroa I, Martinez Nuño V, Flores-Saiffe Farias A, Valencia-Murilloa R, et al. Computer software (SiD) assisted real-time single sperm selection associated with fertilization and blastocyst formation. Reprod Biomed Online. 2022 Oct;45(4):703–11.
12. Montjean D, Godin Pagé MH, Pacios C, Calvé A, Hamiche G, Benkhalifa M, et al. Automated Single-Sperm Selection Software (SiD) during ICSI: A Prospective Sibling Oocyte Evaluation. Med Sci. 2024 Jun;12(2):19.
13. McCallum C, Riordon J, Wang Y, Kong T, You JB, Sanner S, et al. Deep learning-based selection of human sperm with high DNA integrity. Commun Biol. 2019 Jan 1;
14. Thirumalaraju P, Hsu JY, Bormann CL, Kanakasabapathy M, Souter I, Dimitriadis I, et al. Deep learning-enabled blastocyst prediction system for cleavage stage embryo selection. Fertil Steril. 2019 Apr 1;111(4):e29.
15. Khosravi P, Kazemi E, Zhan Q, Malmsten JE, Toschi M, Zisimopoulos P, et al. Deep learning enables robust assessment and selection of human blastocysts after in vitro fertilization. Npj Digit Med. 2019 Apr 4;2(1):1–9.
16. Kinzer DR, Barrett CB, Penzias AS, Alper MM, Sakkas D. Evaluation of a high implantation potential (HIP) embryo grading system designed to reduce multiple pregnancy. J Reprod Health Med. 2016 Jan 1;2(1):11–6.
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...








