CVPH. Ngô Thị Lan Phương
Đơn vị HTSS IVFMD FAMILY, Bệnh viện Đa khoa Gia Đình Đà Nẵng
Giới thiệu
Chất lượng tinh trùng đã được chứng minh là có liên quan đến rối loạn chức năng của phôi người ngay từ giai đoạn phát triển rất sớm, thậm chí trước khi kích hoạt bộ gen phôi. Tuy vậy, ảnh hưởng của tinh trùng đến rối loạn chức năng phôi mới ngày càng được thừa nhận và chứng minh bằng các nghiên cứu lâm sàng. Hậu quả của rối loạn chức năng này bao gồm phôi ngừng phát triển, thất bại làm tổ, sẩy thai và bất thường ở thế hệ con. Bên cạnh đó, sự ra đời của thụ tinh trong ống nghiệm cũng là một yếu tố hạn chế các cơ chế tự nhiên trong lựa chọn tinh trùng so với IVF thông thường [1]. Bài tổng quan này đề cập đến các yếu tố chính có nguồn gốc từ tinh trùng mà sự rối loạn chức năng của chúng có thể gây ra tình trạng ngừng phát triển phôi người, thất bại làm tổ, sảy thai và dị tật ở con cái.
Yếu tố hoạt hóa noãn từ tinh trùng
-
Cơ sở phân tử
Khi dậy thì, chu kỳ tế bào của noãn bị dừng lại ở kỳ giữa của giảm phân II. Để hoàn thành giảm phân và bắt đầu quá trình thụ tinh, noãn cần được kích hoạt bởi tinh trùng. Quá trình này được bắt đầu bằng các tín hiệu canxi do một yếu tố được giải phóng từ tinh trùng. Yếu tố hoạt hóa noãn này là một dạng đặc biệt của phospholipase C (PLC) được gọi là PLC zeta (PLCζ) [2].
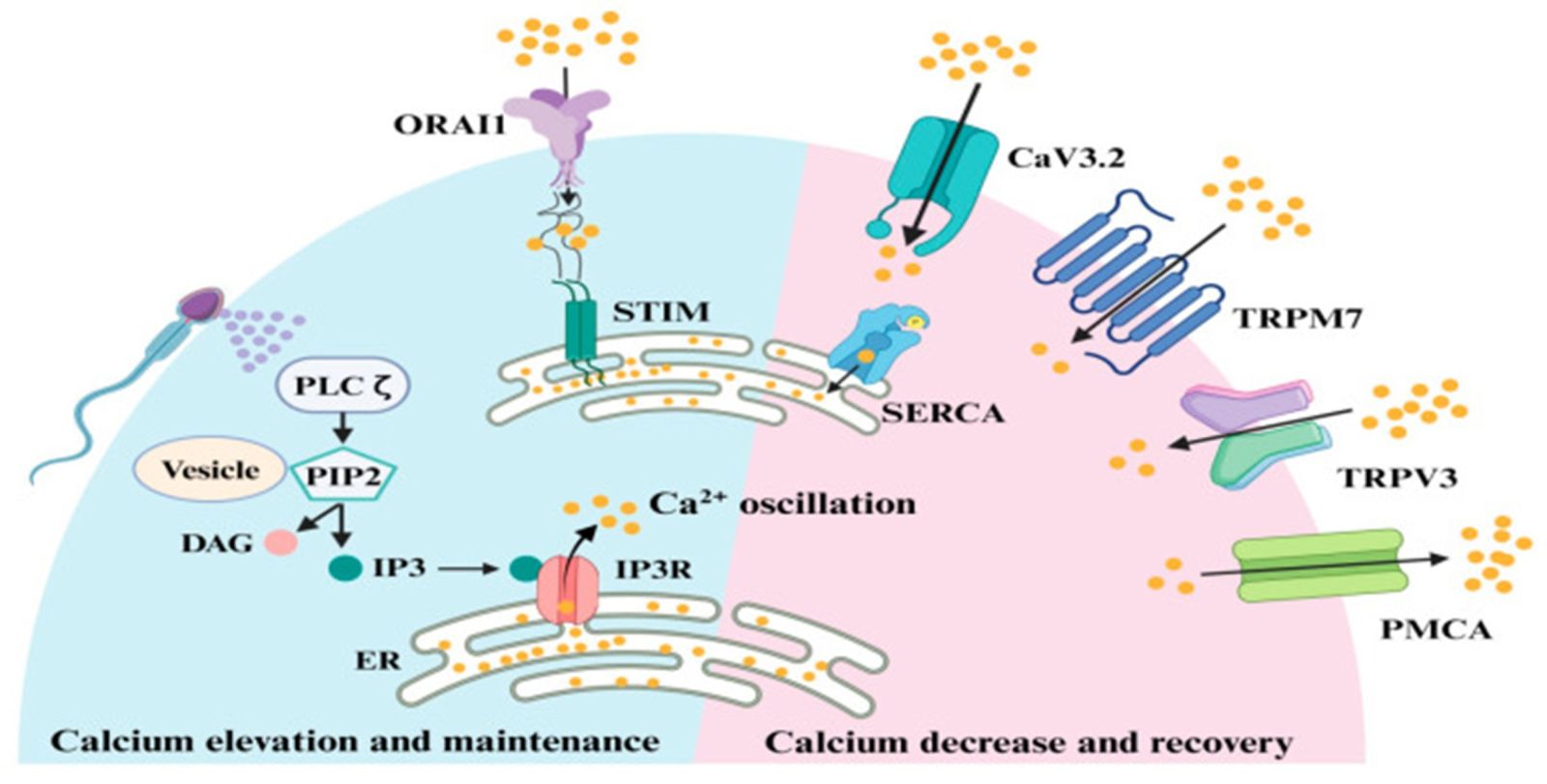
Hình 1. Cơ chế hoạt hóa noãn
[1] Sự thiếu hụt PLCζ thường liên quan đến hình thái tinh trùng. Chủ yếu là globozoospermia, một tình trạng đặc trưng bởi tỷ lệ cao tinh trùng đầu tròn trong mẫu tinh trùng. Những tinh trùng như vậy thiếu phần acrosome và có màng nhân bất thường. Globozoospermia chiếm chưa đến 0,1% bệnh nhân vô sinh trên toàn thế giới [3]. Trong khi sự vắng mặt của phần acrosome cản trở quá trình thụ tinh tự nhiên và IVF thông thường, thì việc thiếu hoạt hóa noãn thông qua tác động của PLCζ là một vấn đề lớn trong ICSI. Có nhiều dạng globozoospermia khác nhau với các kiểu hình tiên lượng khác nhau, chúng khác nhau cả về tỷ lệ tế bào tinh trùng bị ảnh hưởng và khả năng hoạt hóa noãn. Mặt khác, tinh trùng hình thái bình thường cũng có thể thiếu PLCζ và việc đi sâu vào giá trị thực sự của hình thái tinh trùng trong việc dự đoán kết quả thụ tinh và phát triển phôi vẫn là một thách thức [4].
Ngoài việc gây ra tình trạng thất bại thụ tinh hoàn toàn, những thiếu hụt nhỏ của PLCζ có thể ảnh hưởng đến chất lượng phôi và gây nguy cơ sẩy thai sau khi chuyển phôi. Cụ thể, những bất thường từ tín hiệu canxi do tinh trùng gây ra có thể dẫn đến bất thường ở lần phân chia giảm phân thứ hai, tạo thể tam bội hoặc những bất thường về số lượng nhiễm sắc thể de novo. Bên cạnh đó, nó còn dẫn đến sự phát triển và chức năng tiền nhân bất thường, những bất thường trong quá trình phát triển như phôi ngừng phân chia [5]. Sự thiếu hụt yếu tố hoạt hóa noãn ở tinh trùng thường không được phát hiện bằng phương pháp tinh dịch đồ thông thường. Đây là trường hợp gián đoạn actin-like 7A (ACTL7A) có liên quan đến các khiếm khuyết acrosome có thể phát hiện được bằng phương pháp tế bào học và kính hiển vi điện tử. Nồng độ protein ACTL7A trong tinh trùng giảm dẫn đến chất lượng phôi kém và được đề xuất là một dấu ấn sinh học cho kết quả của công nghệ hỗ trợ sinh sản. Kiểm tra di truyền đối với đột biến PLCZ1 (gen mã hóa cho PLCζ ở người) cũng có thể được thực hiện khi nghi ngờ các vấn đề về hoạt hóa noãn do tinh trùng gây ra [6].
-
Các lựa chọn điều trị
Khả năng hoạt hóa noãn của tinh trùng bị thiếu hoặc giảm, dẫn đến thụ tinh thất bại và phát triển phôi kém, có thể được cải thiện thành công bằng phương pháp hỗ trợ hoạt hóa noãn (assisted oocyte activation-AOA) sau ICSI. Cơ chế của phương pháp này là noãn được tiêm tinh trùng chưa thụ tinh khi tiếp xúc với AOA, sử dụng ionophore canxi A23187 (calcimycin) đã sinh ra các dao động Ca2 + tự do trong tế bào chất, khá giống với những dao động được quan sát thấy sau khi tinh trùng và noãn hợp nhất. Ngày nay, có nhiều báo cáo về việc sử dụng AOA với calcimycin và tất cả đều đồng ý rằng phương pháp này có hiệu quả trong việc cải thiện khả năng thụ tinh và phát triển phôi sau ICSI ở các cặp vợ chồng có tiền sử trước đó, ngay cả ở những cặp mà tác động của yếu tố hoạt hóa noãn tinh trùng chưa được xác định rõ ràng [7]. Ngoài ionophore canxi, việc kích hoạt thành công không cần hóa chất của noãn người cũng có thể đạt được bằng kỹ thuật ICSI đặc biệt (hút tế bào chất mạnh gấp đôi) hoặc tiếp xúc noãn với trường điện [1]. Tuy nhiên, các nghiên cứu về hiệu quả của AOA chỉ với quy mô mẫu nhỏ nên cần có nhiều đánh giá hơn theo dõi sức khỏe trẻ sinh ra sau AOA.
Trung thể tinh trùng
-
Cơ sở phân tử
Mỗi tinh trùng người có hai trung thể, trong khi noãn không có. Các trung thể tinh trùng, một trung thể gần hình thùng (điển hình) và một trung thể xa hình quạt (không điển hình), đều nằm ở cổ tinh trùng (một vùng nhỏ giữa đầu tinh trùng và phần giữa) và thực hiện nhiều chức năng trong quá trình thụ tinh và phát triển phôi sau đó. Hợp tử người thừa hưởng cả hai trung thể tinh trùng. Hoạt động của trung thể tinh trùng trong hợp tử người phụ thuộc rất nhiều vào chức năng của các protein trung thể, chủ yếu là centrin, α-tubulin và γ-tubulin [8].
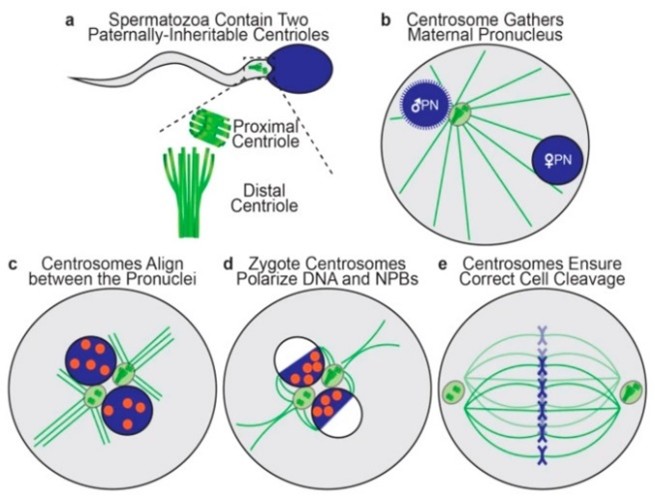
Hình 2. Sơ đồ biểu diễn động lực học của trung tử ở hợp tử [1]
Ngay sau khi tinh trùng và noãn hợp nhất, các trung thể của bố gần nhau và gần với nhân tinh trùng. Chúng tạo thành trung thể đầu tiên của hợp tử bằng cách kéo các protein quanh trung thể từ noãn và phóng ra một sợi vi ống hình sao để kéo tiền nhân của mẹ về phía tiền nhân của bố, dẫn đến sự hình thành hai tiền nhân ở trung tâm. Sau khi nhân đôi, hai trung thể của hợp tử, mỗi trung thể chứa hai trung thể có nguồn gốc từ tinh trùng, xếp thẳng hàng ở mặt phẳng xích đạo chuẩn bị cho quá trình phân bào. Sau đó, hai trung thể liên kết với các cực của thoi phân bào kép, giúp tổ chức và đảm bảo sự phân chia nguyên phân chính xác trong quá trình phân cắt phôi đầu tiên. Các nghiên cứu dịch tễ học đều cho thấy rằng những bất thường của trung thể có thể là nguyên nhân gây ra rối loạn chức năng phôi thai ở người và sinh non [9].
· Phương pháp chẩn đoán
Để phân tích trực tiếp chức năng của trung thể tinh trùng, phương pháp đánh giá tỷ lệ dựa trên huỳnh quang của trung thể (Fluorescence-based Ratiometric Assessment of Centrioles-FRAC) đã được phát triển. Bên cạnh đó, việc phát hiện ra biểu hiện protein trung thể thấp hơn ở nam giới bị oligosthenozoospermic so với nam giới normozoospermic có thể làm cơ sở cho việc phát triển các phương pháp phân tích protein nhanh để dự đoán chức năng trung thể tinh trùng [10].
· Các lựa chọn điều trị
Về việc cải thiện rối loạn chức năng phôi do khiếm khuyết chức năng trung thể tinh trùng, dữ liệu hiện có rất hạn chế. Chỉ có một nghiên cứu đề cập đến vấn đề này vào năm 2005, và kết quả cho thấy chức năng trung thể hợp tử có thể được cải thiện bằng cách điều trị tinh trùng người bằng dithiothreitol trước ICSI và noãn bằng paclitaxel sau ICSI. Tuy nhiên, những quan sát tiên phong này vẫn chưa được bất kỳ nghiên cứu nào sau đó xác nhận [1].
DNA tinh trùng
· Cơ sở phân tử
Các yếu tố ảnh hưởng đến DNA tinh trùng có thể ảnh hưởng đến sự phát triển phôi sớm, thậm chí trước khi kích hoạt chính quá trình phiên mã và biểu hiện gen phôi, diễn ra ở giai đoạn 4 tế bào và giữa giai đoạn phân chia 4 tế bào và 8 tế bào. Trong số các yếu tố này, có thể chia thành các yếu tố di truyền và biểu sinh.
Các yếu tố di truyền của tinh trùng ảnh hưởng đến tiềm năng phát triển của phôi có thể được di truyền hoặc mắc phải. Về các yếu tố di truyền, có một số bất thường nhiễm sắc thể và đột biến hoặc mất gen ảnh hưởng đến chất lượng phôi. Đáng chú ý, nhiều đột biến gen đơn lẻ hoặc thay đổi biểu hiện và tác động tương ứng của chúng lên chức năng tinh trùng [11].
Sự phân mảnh DNA tinh trùng là yếu tố di truyền mắc phải được nghiên cứu rộng rãi nhất liên quan đến rối loạn chức năng phôi người. Chủ yếu bắt nguồn từ apoptosis trong giai đoạn đầu của quá trình sinh tinh trùng và stress oxy hóa, cũng như quá trình đóng gói chromatin bị lỗi trong giai đoạn cuối của quá trình sinh tinh trùng, sự đứt gãy DNA có thể liên quan đến một chuỗi DNA đơn lẻ hoặc cả hai. Vì DNA của tinh trùng được bảo vệ chống lại các tổn thương bằng cách liên kết với protamin trong cấu trúc chromatin rất nhỏ gọn, nên có mối liên hệ chặt chẽ giữa sự phân mảnh của nó với quá trình đóng gói chromatin bị lỗi. Mặc dù, không giống như noãn, tinh trùng không có khả năng tự sửa chữa tổn thương DNA của chúng, nhưng nó có thể được sửa sai sau khi thụ tinh trong hợp tử bằng cơ chế sửa chữa DNA của mẹ. Các đặc điểm chung của cơ chế sửa chữa tổn thương DNA và hoạt động của chúng trong hợp tử và phôi người đã được xem xét gần đây. Khả năng sửa chữa DNA này bị hạn chế và có khả năng suy giảm theo tuổi của phụ nữ, và tổn thương DNA không được sửa chữa có thể phá vỡ sự phát triển tiếp theo của hợp tử, có khả năng dẫn đến sẩy thai, dị tật bẩm sinh và tăng nguy cơ mắc một số bệnh, bao gồm cả ung thư [12].
Một yếu tố di truyền khác có thể ảnh hưởng đến chức năng của phôi người là tình trạng lệch bội tinh trùng, là kết quả của bất thường nhiễm sắc thể trong quá trình sinh tinh, chủ yếu liên quan đến nhiễm sắc thể X và Y, và thường gặp hơn ở tinh trùng được thu nhận từ phẫu thuật ở bệnh nhân nam bị vô tinh không do tắc hoặc thiểu tinh nghiêm trọng. Tinh trùng lệch bội có khả năng thụ tinh cho noãn, dẫn đến lệch bội phôi và tình trạng này liên quan đến tỷ lệ làm tổ và mang thai thấp hơn và tỷ lệ sẩy thai cao hơn sau khi chuyển phôi [13].
Các yếu tố biểu sinh ảnh hưởng đến chức năng của phôi người bằng cách tác động lên DNA của cha. Các vấn đề biểu sinh khác, liên quan đến hoạt động của yếu tố hoạt hóa noãn tinh trùng và trung thể, đã được đề cập ở trên và những vấn đề liên quan đến biểu hiện của RNA nhỏ không mã hóa được đưa vào. Các dấu hiệu biểu sinh, bao gồm metyl hóa DNA, trạng thái axetyl hóa histon và RNA nhỏ, đều bị loại bỏ hoàn toàn và sau đó được thiết lập lại trong quá trình lập trình lại dòng tế bào mầm. Tuy nhiên, hiện nay người ta biết rằng quá trình thiết lập lại này chưa hoàn tất và một số vùng được tinh trùng di truyền có thể thoát khỏi quá trình lập trình lại để tác động đến những thay đổi chức năng trong quá trình phát triển phôi trước và sau khi làm tổ thông qua các cơ chế liên quan đến các yếu tố phiên mã, tổ chức chromatin và các yếu tố chuyển vị [14].
· Phương pháp chẩn đoán
Hiện nay có các phương pháp để xác định phân mảnh DNA tinh trùng, tuy nhiên các vấn đề khác vẫn chưa có các xét nghiệm chẩn đoán cụ thể.
· Các lựa chọn điều trị
Đối với trường hợp tinh trùng bị phân mảnh DNA, có thể sử dụng kháng sinh đường uống và thuốc chống viêm phù hợp với từng bệnh nhân để kiểm soát nhiễm trùng tinh dịch, thay thế hormone, uống vitamin chống oxy hóa, sử dụng phương pháp IMSI khi ICSI, và việc sử dụng tinh trùng tinh hoàn khi tất cả các phương pháp trên đều thất bại đã được chứng minh là có ích trong các trường hợp tinh trùng bị phân mảnh DNA quá mức [15].
RNA tinh trùng
· Cơ sở phân tử
Trong số các loại RNA được đưa vào noãn bởi tinh trùng thụ tinh, các RNA nhỏ không mã hóa, chẳng hạn như RNA nhỏ có nguồn gốc từ tRNA, RNA can thiệp nhỏ, RNA nhỏ có nguồn gốc từ RNA ribosome, microRNA, RNA hạt nhân nhỏ và RNA tương tác với PIWI tham gia điều chỉnh sự phát triển của phôi, kiểu hình của thế hệ con và các sửa đổi kết quả có thể được di truyền qua nhiều thế hệ. Hầu hết các tác động của các RNA này đều liên quan đến các sửa đổi biểu sinh của hoạt động bộ gen phôi, trong khi mRNA do tinh trùng sinh ra có vai trò tiềm tàng trong hoạt hóa bộ gen hợp tử và di truyền biểu sinh. Ngoài ra, RNA tinh trùng cũng được chứng minh là tham gia vào các sự kiện ban đầu thiết yếu khác trong phôi, chẳng hạn như tái cấu trúc chromatin, lập trình nhân, hoạt hóa bộ gen và hoạt động của yếu tố chuyển vị [16]. Nhìn chung, RNA tinh trùng ngày càng được coi là dấu hiệu tiềm năng của rối loạn chức năng phôi có nguồn gốc từ tinh trùng và các mục tiêu điều trị, mặc dù cơ chế hoạt động của chúng trong phôi vẫn chỉ được hiểu một phần.
· Phương pháp chẩn đoán
Các xét nghiệm về RNA tinh trùng liên quan đến sự phát triển phôi chỉ mới xuất hiện gần đây và dựa trên trình tự thế hệ mới để lập hồ sơ RNA được chiết xuất từ tinh trùng của bệnh nhân. Trong số các loại RNA khác nhau đã được nghiên cứu cho đến nay bằng trình tự phiên mã thế hệ mới, ba microRNA (hsa-miR-9-3p, hsa-miR-30b-5p và hsa-miR-122-5p) có tiềm năng cao nhất làm dấu ấn sinh học về khả năng sinh sản và chất lượng tinh trùng của nam giới [17].
· Các lựa chọn điều trị
Hiện chưa có phương pháp điều trị cụ thể nào cho các vấn đề về RNA tinh trùng.
Protein tinh trùng
· Cơ sở phân tử
Một nghiên cứu gần đây đã xác định được 560 protein tinh trùng có liên quan đến việc điều chỉnh biểu hiện gen bằng cách điều hòa phiên mã, methyl hóa DNA, sửa đổi sau dịch mã histon và sinh tổng hợp RNA không mã hóa [18]. Các protein tinh trùng khác có chức năng đã biết, chẳng hạn như những protein liên quan đến quá trình protamination DNA tinh trùng (chủ yếu là protamin-2, protein chuyển tiếp và histon acetyltransferase) và khả năng chống oxy hóa (chẳng hạn như superoxide dismutase loại 1 và peroxiredoxin 5) đã được chứng minh là cần thiết để bảo tồn tính toàn vẹn của DNA tinh trùng ở mô hình chuột.
· Phương pháp chẩn đoán
Các nghiên cứu gần đây đã khôi phục lại khả năng hiện tại của việc đánh giá các dấu hiệu protein của chức năng tinh trùng bằng phương pháp nghiên cứu protein và xác định các protein có thể là mục tiêu tiềm năng cho các nghiên cứu cơ bản và lâm sàng sâu hơn.
· Các lựa chọn điều trị
Ngoài các phương pháp điều trị hậu quả của tình trạng thiếu hụt protein tinh trùng cụ thể, bao gồm yếu tố hoạt hóa noãn tinh trùng, trung thể và lập trình lại biểu sinh DNA tinh trùng như đã trình bày ở phần trên, một số báo cáo cho rằng chất lượng tinh trùng nói chung có thể được cải thiện bằng chế độ ăn uống phù hợp và việc bổ sung chất dinh dưỡng và thực phẩm chức năng.
Kết luận
Ngoài việc truyền bộ gen của cha, các yếu tố tinh trùng được biết là đóng vai trò thiết yếu khác trong sự phát triển của phôi. Các yếu tố này bao gồm yếu tố hoạt hóa noãn tinh trùng, trung thể, DNA, RNA và protein, mỗi yếu tố đều ảnh hưởng đến các đặc điểm phát triển khác nhau của phôi. Ngoại trừ sự phân mảnh DNA của tinh trùng, việc chẩn đoán các yếu tố tinh trùng khác khó khăn hơn. Rối loạn chức năng của yếu tố hoạt hóa noãn tinh trùng (PLCζ) có thể được đánh giá gián tiếp bằng ICSI dị loại với noãn chuột, hoặc trực tiếp bằng cách đánh giá sự phân bố PLCζ trong tinh trùng hoặc các bất thường siêu cấu trúc liên quan. ICSI dị loại (noãn thỏ hoặc bò) cũng có thể dùng để đánh giá chức năng của trung thể tinh trùng. Các bất thường trong DNA tinh trùng (ngoài sự phân mảnh) có thể được tiếp cận gián tiếp bằng cách đánh giá sự hiện diện của RNA và protein liên quan đến quá trình biểu sinh.
Các phương pháp điều trị hiện có cho tình trạng rối loạn chức năng phôi có nguồn gốc từ tinh trùng bao gồm hỗ trợ hoạt hóa noãn (yếu tố hoạt hóa noãn), chống oxy hóa đường uống, điều trị các bệnh lý đi kèm và lựa chọn tinh trùng ở độ phóng đại cao để sử dụng trong ICSI. Hiện chưa có phương pháp điều trị đặc hiệu nào được xác nhận lâm sàng cho các bất thường DNA khác và các vấn đề về RNA và protein, nhưng việc sử dụng IVF thông thường thay vì ICSI để tận dụng lợi thế của việc lựa chọn tinh trùng tự nhiên có thể được xem xét nếu khả thi. Do đó, việc tiếp tục phát triển các xét nghiệm chẩn đoán nhanh chóng và dễ dàng là một hướng quan trọng cho nghiên cứu trong tương lai.
Tài liệu tham khảo
[1] J. Tesarik and R. Mendoza Tesarik, “Sperm-Derived Dysfunction of Human Embryos: Molecular Mechanisms and Clinical Resolution,” Int J Mol Sci, vol. 26, no. 13, p. 6217, June 2025, doi: 10.3390/ijms26136217.
[2] “Calcium signaling in oocyte quality and functionality and its application - PMC.” Accessed: Sept. 22, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC11361953/
[3] P. Modarres, M. Tavalaee, K. Ghaedi, and M. H. Nasr-Esfahani, “An Overview of The Globozoospermia as A Multigenic Identified Syndrome,” Int J Fertil Steril, vol. 12, no. 4, pp. 273–277, 2019, doi: 10.22074/ijfs.2019.5561.
[4] “Sperm morphology value in assisted reproduction: dismantling an enigma and key takeaways for the busy clinician - PMC.” Accessed: Sept. 22, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC11624537/
[5] “Calcium Signaling in Human Preimplantation Development: A Review - PMC.” Accessed: Sept. 22, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC3455764/
[6] T.-Y. Yang et al., “Sperm-specific protein ACTL7A as a biomarker for fertilization outcomes of assisted reproductive technology,” Asian J Androl, vol. 24, no. 3, pp. 260–265, Feb. 2022, doi: 10.4103/aja2021111.
[7] J. L. Ruan, S. S. Liang, J. P. Pan, Z. Q. Chen, and X. M. Teng, “Artificial oocyte activation with Ca2+ ionophore improves reproductive outcomes in patients with fertilization failure and poor embryo development in previous ICSI cycles,” Front Endocrinol (Lausanne), vol. 14, p. 1244507, Aug. 2023, doi: 10.3389/fendo.2023.1244507.
[8] “Correlation of human sperm centrosomal proteins with fertility - PMC.” Accessed: Sept. 22, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC2970799/
[9] “The Role of Sperm Centrioles in Human Reproduction – The Known and the Unknown - PMC.” Accessed: Sept. 22, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC6781795/
[10] D. F. Kluczynski et al., “Spermatozoa centriole quality determined by FRAC may correlate with zygote nucleoli polarization—a pilot study,” J Assist Reprod Genet, vol. 42, no. 4, pp. 1121–1132, Apr. 2025, doi: 10.1007/s10815-025-03411-x.
[11] “Morphological and Molecular Bases of Male Infertility: A Closer Look at Sperm Flagellum - PMC.” Accessed: Sept. 23, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC9956255/
[12] “DNA damage in preimplantation embryos and gametes: specification, clinical relevance and repair strategies - PMC.” Accessed: Sept. 23, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC9071077/
[13] “Lower sperm aneuploidy frequency is associated with high pregnancy rates in ICSI programmes - PubMed.” Accessed: Sept. 23, 2025. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/12832359/
[14] “Emerging evidence that the mammalian sperm epigenome serves as a template for embryo development - PMC.” Accessed: Sept. 23, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC10104880/
[15] J. Tesarik, “Lifestyle and Environmental Factors Affecting Male Fertility, Individual Predisposition, Prevention, and Intervention,” Int J Mol Sci, vol. 26, no. 6, p. 2797, Mar. 2025, doi: 10.3390/ijms26062797.
[16] “Sperm epigenetics and male infertility: unraveling the molecular puzzle - PMC.” Accessed: Sept. 23, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC11149391/
[17] “Qualitative and quantitative assessment of sperm miRNAs identifies hsa-miR-9-3p, hsa-miR-30b-5p and hsa-miR-122-5p as potential biomarkers of male infertility and sperm quality - PMC.” Accessed: Sept. 23, 2025. [Online]. Available: https://pmc.ncbi.nlm.nih.gov/articles/PMC9377062/
[18] “The contribution of human sperm proteins to the development and epigenome of the preimplantation embryo - PubMed.” Accessed: Sept. 23, 2025. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/29800303/
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...








