CVPH. Ngô Thị Lan Phương
Đơn vị HTSS IVFMD FAMILY, Bệnh viện Đa khoa Gia Đình Đà Nẵng
Giới thiệu
Vô tinh là tình trạng không có tinh trùng trong tinh dịch, bao gồm hai loại chính: vô tinh trùng tắc nghẽn (obstructive azoospermia-OA) và vô tinh trùng không tắc nghẽn (nonobstructive azoospermia-NOA). Trong trường hợp vô tinh do tắc nghẽn, tình trạng không có tinh trùng là do bất thường trong quá trình sản xuất tinh trùng hoặc sự trưởng thành của tinh trùng trong tinh hoàn. Trong trường hợp này, phẫu thuật lấy tinh trùng từ tinh hoàn (TESE) là lựa chọn duy nhất để thu nhận tinh trùng thực hiện thụ tinh trong ống nghiệm (TTTON).
Kỹ thuật lấy tinh trùng micro-TESE được giới thiệu vào năm 1999 và được báo cáo là một phương pháp thay thế tiên tiến để lấy tinh trùng từ tinh hoàn hiệu quả hơn phương pháp TESE thông thường (cTESE) [1]. Micro-TESE là một kỹ thuật chuyên biệt nhằm xác định các vùng cụ thể trong tinh hoàn, nơi có thể sản xuất tinh trùng mặc dù không có tinh trùng trong tinh dịch. Kỹ thuật này chính xác hơn trong việc lấy tinh trùng, nhờ kính hiển vi phẫu thuật hỗ trợ bác sĩ phẫu thuật lấy tinh trùng ở vị trí có khả năng tìm thấy tinh trùng cao nhất, từ đó tăng tỷ lệ lấy tinh trùng. Hơn nữa, việc lấy tinh trùng ở mức tối thiểu và chính xác giúp giảm thiểu tổn thương tinh hoàn. Những tinh trùng hiếm như vậy, thường được lấy ra sau khi phẫu thuật và xét nghiệm kỹ lưỡng, đòi hỏi những nỗ lực không kém phần khó khăn để bảo quản đông lạnh để sử dụng trong tương lai.
Đông lạnh tinh trùng thu nhận từ micro-TESE đóng vai trò rất quan trọng trong TTTON vì số lượng tinh trùng được thu nhận rất ít. Khả năng tìm thấy tinh trùng trong lần micro-TESE tiếp theo rất khó. Trong trường micro-TESE được thực hiện trước chu kỳ điều trị, nếu không tìm thấy tinh trùng thì bệnh nhân có thể hủy chu kỳ mà không cần kích thích buồng trứng. Nếu bệnh nhân có tinh trùng và thất bại trong chu kỳ đầu thì bảo quản lạnh tinh trùng giúp tránh lặp lại quy trình micro-TESE.
Tổng quan về đông lạnh tinh trùng
Thông thường, tinh trùng được bảo quản theo các phương pháp đông lạnh chậm, thủy tinh hóa hay thủy tinh hóa cải tiến. Tuy nhiên, sau 60 năm, hiệu quả đông lạnh tinh trùng chỉ đạt tỷ lệ sống sau rã chỉ 45-55% [2].
Nguyên nhân chính dẫn đến tình trạng mất khả năng sống này là do bảo quản lạnh có thể gây ra những thay đổi có hại cho tế bào, đặc biệt là cấu trúc mỏng manh của màng tinh trùng dẫn đến giảm khả năng sống và khả năng thụ tinh sau khi rã đông của tinh trùng. Các chất bảo vệ tinh trùng (CPA), được thêm vào mẫu tinh trùng trước khi làm lạnh, được biết là có tác dụng giảm thiểu tổn thương do đông lạnh bằng cách bảo vệ tinh trùng khỏi những tổn thương do đông lạnh gây ra [3]. Tuy nhiên, tác động của nhiều loại CPA khác nhau lên cấu trúc màng tinh trùng vẫn là lĩnh vực cần thêm nhiều nghiên cứu để tối ưu hóa quy trình bảo quản lạnh và cải thiện kết quả sinh sản.
Sinh lý của việc đông lạnh tế bào/tinh trùng
Bảo quản tinh trùng đông lạnh là một quá trình vật lý cho phép bảo quản cấu trúc và chức năng của tế bào ở nhiệt độ rất thấp trong khoảng thời gian gần như vô thời hạn. Việc tiếp xúc tế bào gốc với nhiệt độ cực thấp thường dẫn đến chết tế bào. Do thành phần chủ yếu của tế bào là nước (khoảng 80%), việc đông lạnh có thể kích thích sự hình thành tinh thể băng cả bên trong và bên ngoài tế bào. Do đó, sự đông đặc của nước được cho là có liên quan đến các tác động sinh hóa và cấu trúc có hại của quá trình đông lạnh, gây nguy hiểm cho tính toàn vẹn của tế bào sau khi rã đông. Mức độ tổn thương tế bào có liên quan đến tốc độ làm mát. Ở tốc độ chậm, sự hình thành băng ngoại bào tăng lên, gây mất nước tế bào quá mức. Ngược lại, ở tốc độ rất nhanh, nước nội bào bị đông lại, gây tổn thương các bào quan bên trong [4].
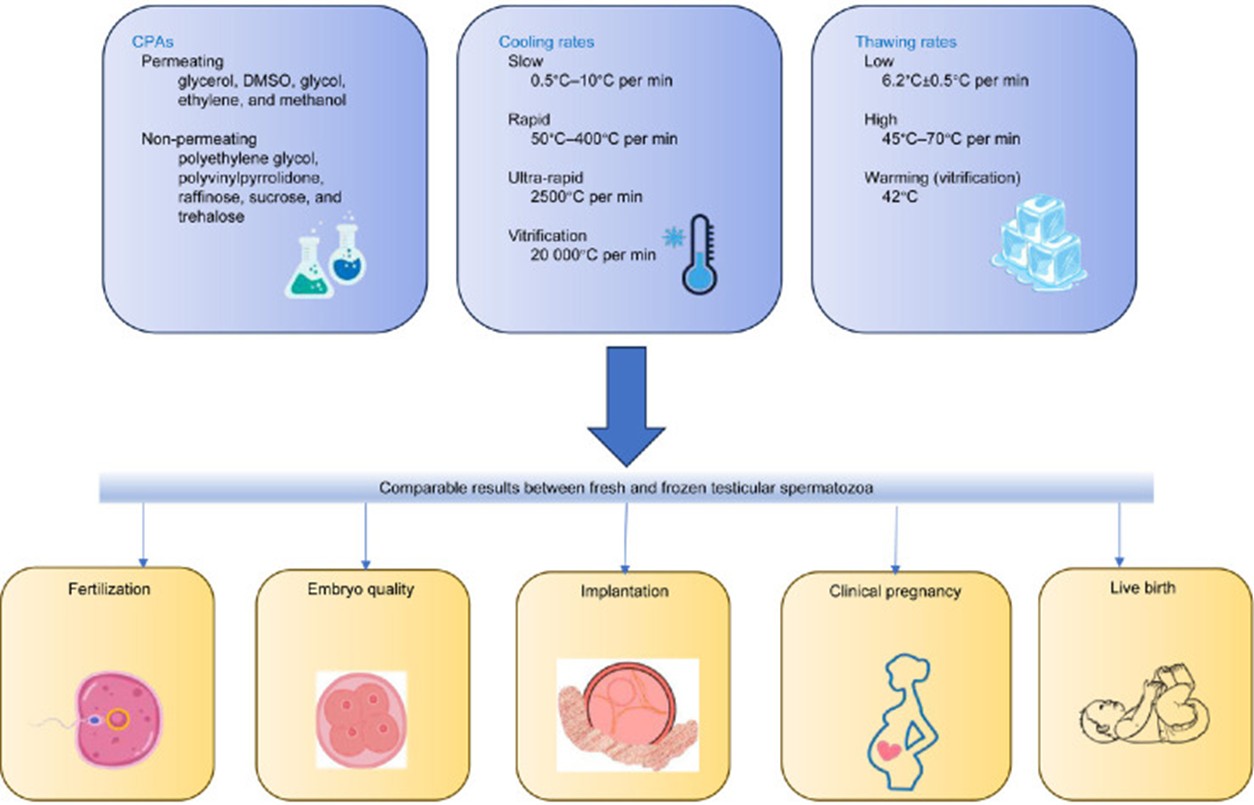
Việc sử dụng các chất bảo vệ đông lạnh nhằm mục đích giảm thiểu tổn thương do đông lạnh gây ra cho tế bào tinh trùng. Các CPA thẩm thấu như glycerol, dimethyl sulfoxide (DMSO), glycol, ethylene và methanol, cũng như các CPA không thẩm thấu như polyethylene glycol (PEG), polynynilpyrrolidone (PVP), raffinose, sucrose và trehalose, được sử dụng phổ biến nhất [2].
CPA thẩm thấu, bản chất ưa nước có thể xâm nhập vào tế bào bằng cách xuyên qua màng tế bào. Tác dụng thẩm thấu của chúng thúc đẩy nước thoát ra khỏi tế bào, do đó giảm thiểu sự hình thành băng nội bào và ổn định lớp màng bilipid. CPA không thẩm thấu bao gồm các phân tử có trọng lượng phân tử cao, không thấm qua màng tế bào, do đó làm tăng nồng độ chất tan ngoại bào, tạo ra một gradient thẩm thấu gây mất nước tế bào.
Quá trình làm ấm không đúng cách của môi trường nội bào có thể gây ra tổn thương nghiêm trọng. Ở tốc độ làm ấm thấp, tức là dưới 1000°C/phút, quá trình tái kết tinh xảy ra, dẫn đến sự hình thành các tinh thể băng nội và ngoại bào. Ngược lại, khi làm ấm ở tốc độ cao, sự hình thành tinh thể băng giảm đáng kể. Do đó, nhiệt độ làm ấm rất quan trọng để bảo vệ cấu trúc và chức năng của màng plasma, ngay cả khi các tế bào dường như không bị ảnh hưởng [4].
Ảnh hưởng của đông lạnh đến chất lượng tinh trùng
Các quá trình sinh hóa diễn ra trong quá trình đông lạnh-rã đông/thủy tinh hóa-làm ấm gây ra những suy giảm phân tử liên quan đến những thay đổi về chuyển hóa, mất cân bằng oxy hóa bằng cách tăng các loại oxy phản ứng và làm giảm mức độ các yếu tố chống oxy hóa liên quan đến tổn thương DNA, biến đổi biểu sinh và chết tế bào [4]. Hơn nữa, những thay đổi trong protein liên quan đến chức năng màng có nhiều tác động khác nhau đến chức năng của tinh trùng, chẳng hạn như khả năng vận động của tinh trùng, khả năng sống của tinh trùng, phản ứng acrosome, khả năng hoạt động, chuyển hóa, khả năng thụ tinh, cũng như chết tế bào thông qua cơ chế apoptosis hoặc các cơ chế khác [2]. Nguyên nhân khiến tỷ lệ tinh trùng bất động cao sau rã đông vẫn còn chưa rõ ràng. Sự khác biệt về tỷ lệ không sống này cũng đã được quan sát thấy giữa các mẫu và kỹ thuật được áp dụng.
Tác động có hại của việc bảo quản tinh trùng đông lạnh lên sự phân mảnh DNA tinh trùng (sperm DNA fragmentation-SDF) đã được nghiên cứu rộng rãi. Cơ chế chính của SDF sau khi rã đông có liên quan đến tổn thương oxy hóa. Để chống lại tình trạng stress oxy hóa do đông lạnh này, việc bổ sung CPA với các chất chống oxy hóa, chẳng hạn như vitamin E, hypotaurine hoặc các chất khác, đã được đề xuất để ngăn ngừa tổn thương tế bào tinh trùng, bảo vệ tính toàn vẹn của DNA và chức năng màng [5].
Hình 1. Các yếu tố khác nhau ảnh hưởng đến đông lạnh tinh trùng từ tinh hoàn
Bảo quản lạnh tinh trùng hiếm
Nhận thấy tầm quan trọng của việc bảo quản số lượng tinh trùng ít ỏi thu được trong những tình huống khó khăn, có nhiều phương pháp đông lạnh tinh trùng hiếm được nghiên cứu.
-
Bảo quản tinh trùng trong zona
Đây là phương pháp sử dụng zona rỗng từ động vật hoặc người để bảo quản một hoặc một số lượng tinh trùng giới hạn, được chọn lọc thủ công và bảo quản trong zona bằng hai phương pháp: lấp đầy vùng zona rỗng bằng CPA và tiêm tinh trùng vào đó hoặc đưa tinh trùng vào một vùng zona rỗng, sau đó tiếp xúc cấu trúc này với CPA. Sau đó, tinh trùng chứa vùng zona được làm lạnh bằng hơi nước hoặc phương pháp đông lạnh chậm.
Walmsley và cộng sự đã báo cáo ca sinh sống đầu tiên sử dụng tinh trùng thu nhận từ mào tinh và tinh hoàn bảo quản trong zona [6]. Tuy nhiên, phương pháp này vẫn chưa được áp dụng với tinh trùng micro-TESE.
Việc sử dụng zona pellucida làm vật mang cho bảo quản tinh trùng đông lạnh có một số ưu điểm và hạn chế. Về mặt tích cực, zona tạo ra môi trường bảo vệ tinh trùng, vì nó không thấm và giữ chặt tinh trùng. Giúp dễ dàng định vị tinh trùng dưới kính hiển vi soi nổi sau khi rã đông. Ngoài ra, việc xử lý zona cũng thuận tiện hơn vì có thể thu hồi mà không làm ảnh hưởng đến tinh trùng được bảo quản bên trong. Tuy nhiên, kỹ thuật này có những hạn chế đáng kể. Việc sử dụng zona từ động vật gặm nhấm để bảo quản tinh trùng người bị hạn chế do lo ngại về miễn dịch và nguy cơ nhiễm chéo vi sinh vật. Việc sử dụng zona từ người cũng bị hạn chế, gây khó khăn cho việc triển khai thường quy. Hơn nữa, việc thu hồi tinh trùng có thể khó khăn nếu nó bị mắc kẹt ở bên trong của zona, và một lỗ tiêm lớn có thể ảnh hưởng đến khả năng giữ lại tinh trùng di động. Việc chuẩn bị zona đòi hỏi các dụng cụ công nghệ cao và tay nghề của chuyên viên phôi học, khiến phương pháp này ít phổ biến [2].
-
Phương pháp vi giọt
Nguyên tắc của phương pháp này là làm đông các giọt nhỏ 50–100 µl chứa hỗn hợp tinh trùng và CPA bằng đá khô hoặc tấm thép lạnh, những giọt rắn nhỏ này được rã đông khi cần lấy tinh trùng. Tỷ lệ làm tổ, mang thai lâm sàng và mang thai diễn tiến với tinh trùng được bảo quản lạnh tương đương với tinh trùng tươi từ tinh hoàn (lần lượt là 13,1% so với 12,2%, 27,8% so với 28,2% và 21,8% so với 22,4%) [7].
Ưu điểm của phương pháp này là đơn giản và không yêu cầu bất kỳ thiết bị đặc biệt nào, giúp thực hiện nhanh chóng và đảm bảo tỷ lệ thu hồi tốt. Tuy nhiên, phương pháp này cũng có những nhược điểm đáng chú ý, bao gồm khả năng di chuyển sau khi rã đông rất khác nhau và nguy cơ lây nhiễm chéo do tinh trùng không được bao bọc. Ngoài ra, phương pháp này đòi hỏi không gian lưu trữ rất lớn, khiến nó không thực tế khi sử dụng trên quy mô lớn. Hơn nữa, vật liệu polystyrene của đĩa Petri không phù hợp để bảo quản đông lạnh lâu dài, càng làm hạn chế tính thực tiễn của phương pháp này [2].
-
Đông lạnh tinh trùng bằng pipet ICSI
Tinh trùng được chọn lọc trong một nhóm từ 5–50 con vào kim ICSI, sau đó được cân bằng trong các giọt CPA và được nhúng trực tiếp vào ni tơ lỏng hoặc tiếp xúc với hơi ni tơ lỏng 20 phút trước khi nhúng trực tiếp vào ni tơ. Sohn và cộng sự đã áp dụng phương pháp này để bảo quản từng tinh trùng thu được từ TESE bằng phương pháp đông lạnh chậm và thủy tinh hóa. Kết quả cho thấy tỷ lệ phục hồi và khả năng di động lần lượt là 90% và 29% đối với phương pháp đông lạnh chậm và 80% và 8% đối với phương pháp thủy tinh hóa [8].
Về mặt tích cực, phương pháp này cho phép kiểm soát chính xác quá trình lựa chọn và di chuyển tinh trùng, dẫn đến khả năng mất tinh trùng trong quá trình bảo quản đông lạnh rất thấp và tỷ lệ thu hồi cao. Tuy nhiên, kỹ thuật này đòi hỏi thiết bị hiện đại và thao tác khéo léo. Vật liệu mang tinh trùng rất dễ vỡ, làm tăng khả năng hư hỏng trong quá trình vận chuyển, và bản chất nhỏ bé của nó khiến việc bảo quản hiệu quả trở nên khó khăn. Ngoài ra, thiết kế hệ thống mở khiến nó dễ bị nhiễm chéo vi sinh vật.
-
Phương pháp quả cầu Volvox
Phương pháp này sử dụng các quả cầu được hình thành bởi các khuẩn lạc tảo Volvox globator. Quả cầu được cân bằng với dung dịch CP. Một số lượng cố định gồm 8 tinh trùng có hình thái bình thường và di động từ những bệnh nhân thiểu năng tinh trùng nặng được đưa vào kim tiêm. Quả cầu tảo được giữ bằng kim và nhẹ nhàng thả tinh trùng vào quả cầu, sau đó được đưa vào cọng rạ và đông lạnh bằng phương pháp đông lạnh chậm. Just và cộng sự đã báo cáo khả năng phục hồi 100% và khả năng di động được duy trì là 50% [9].
Phương pháp bảo quản tinh trùng đông lạnh bằng tảo cho thấy triển vọng với khả năng phục hồi tốt và độ di động chấp nhận được của tinh trùng. Tuy nhiên, phương pháp này có một số hạn chế. Phương pháp này chưa có nhiều nghiên cứu và phương pháp phức tạp của nó gây trở ngại cho việc triển khai thường quy. Ngoài ra, còn có nguy cơ nhiễm bẩn từ các yếu tố di truyền hoặc sinh hóa chưa biết của tảo, và việc chuẩn bị và duy trì các quần thể tảo không bị nhiễm bẩn rất phức tạp và tốn thời gian. Ngoài ra, việc sử dụng vật liệu có nguồn gốc từ tảo cho mục đích y tế bị cấm ở nhiều quốc gia, càng làm hạn chế việc áp dụng phương pháp này.
-
Phương pháp hạt alginate
Herrler và cộng sự đã sử dụng hạt alginate làm chất mang để bảo quản số lượng tinh trùng thấp. Alginate là một polysaccharide có nguồn gốc từ rong biển nâu. Nó tạo thành cấu trúc giống như gel khi kết hợp với các hợp chất canxi. Sau khi ly tâm, phần cặn tinh trùng được trộn với CPA. Axit alginic ở nồng độ 7,3 mg/ml được thêm ngay vào đó. Những giọt nhỏ của hỗn hợp này được tiếp xúc với dung dịch canxi clorua để bắt đầu quá trình nang hóa tạo thành các hạt nhỏ. Những hạt chứa tinh trùng này được bảo quản lạnh bằng phương pháp đông lạnh chậm. Các hạt được tiếp xúc với dung dịch natri citrat để hòa tan trong quá trình rã đông, sau đó tinh trùng được phân lập, rửa sạch axit alginic và sử dụng cho ICSI [10].
Việc sử dụng nang trơ để bảo quản tinh trùng đông lạnh có ưu điểm là giữ được tinh trùng nguyên vẹn. Tuy nhiên, phương pháp này chưa được nghiên cứu rộng rãi và đòi hỏi quy trình thiết lập phức tạp, tốn nhiều thời gian. Việc ứng dụng thường quy bị hạn chế bởi hiệu quả thấp, do quy trình bao gồm việc chuẩn bị hạt, thực hiện phản ứng và duy trì độ pH tối ưu để duy trì khả năng sống của tinh trùng. Ngoài ra, axit alginic được sử dụng trong quy trình này có thể ảnh hưởng tiêu cực đến khả năng vận động của tinh trùng.
-
Phương pháp vi cầu agarose
Phương pháp này sử dụng các vi cầu agarose 2% có đường kính khoảng 100 µm. Khoảng 1–10 tinh trùng từ tinh dịch được lắng trong các quả cầu này, sau đó tiếp xúc với CPA trong 5 phút. Sau khi cân bằng, 5–10 vi cầu được nạp vào các cọng rạ nhựa 0,25 ml và bảo quản lạnh bằng phương pháp đông lạnh chậm.
Phương pháp này là một lựa chọn thay thế tốt cho các vật mang sinh học với tỷ lệ phục hồi và duy trì khả năng di động ở mức chấp nhận được. Tuy nhiên, nó có một số hạn chế, bao gồm việc chưa được nghiên cứu nhiều và chưa có dữ liệu về kết quả thai kỳ lâm sàng. Ngoài ra, quy trình thiết lập phức tạp, có khả năng khiến nó không phù hợp để sử dụng thường quy.
Các phương pháp thủy tinh hóa trong bảo quản lạnh tinh trùng
Việc ứng dụng phương pháp thủy tinh hóa để bảo quản tinh trùng từ tinh hoàn trong TTTON hứa hẹn hơn phương pháp đông lạnh thông thường về khả năng phục hồi khả năng vận động, bảo toàn tính toàn vẹn của DNA và màng, cũng như khả năng sống.
-
Phương pháp cryoloop và strip
Phương pháp này sử dụng cryoloop với một vòng nhỏ có đường kính khoảng 1 mm ở một đầu. Một lớp mỏng chất bảo vệ tinh trùng được tạo ra trên bề mặt của vòng. Tinh trùng cần bảo quản đông lạnh được lấy bằng micropipette dưới kính hiển vi và được đặt lên lớp màng mỏng này. Sau đó, cryoloop được tiếp xúc với hơi ni tơ lỏng 15 phút và nhúng vào ni tơ [11].
Vì xu hướng chung là ưu tiên hệ thống kín hơn hệ thống hở để ngăn ngừa khả năng nhiễm chéo qua nitơ lỏng, Mangoli và cộng sự đã báo cáo việc bảo quản đông lạnh một số lượng nhỏ tinh trùng mà không cần bất kỳ chất bảo vệ đông lạnh bổ sung nào bằng thiết bị VitriMate®. Hu và cộng sự gần đây đã xác nhận hiệu quả của hệ thống kín với kết quả tương đương [12].
Kỹ thuật này có ưu điểm là thiết lập đơn giản, dễ vận hành, tỷ lệ phục hồi tốt và khả năng sử dụng hệ thống kín để ngăn ngừa nhiễm chéo khi bảo quản số lượng tinh trùng ít. Tuy nhiên, hiện có rất ít nghiên cứu xác nhận hiệu quả của kỹ thuật này.
-
Phương pháp cell sleepers
Đây là phương pháp sử dụng một hệ thống dạng lọ có chứa một khay ở mặt trong của nắp để chứa các giọt tinh trùng siêu nhỏ (3,5 µl). Sau khi nạp một tinh trùng duy nhất, nắp được lắp vào lọ tạo ra một môi trường hệ thống kín. Cell sleepers được giữ cách hơi ni tơ lỏng trong 2,5 phút trước khi nhúng vào ni tơ. Coetzee và cộng sự đã sử dụng cell sleepers để bảo quản đông lạnh từng tinh trùng tinh hoàn trên một giọt 2 µl. Tổng cộng 304 tinh trùng được bảo quản đông lạnh, trong đó 265 tinh trùng được rã đông. Tỷ lệ thu hồi là 94%, với tỷ lệ duy trì khả năng sống là 56% [13].
-
Phương pháp mesh và pearl drop
O’Neill và cộng sự đã công bố dữ liệu về phương pháp thủy tinh hóa tinh trùng bằng thiết bị mới “mesh và pearl drop”. Một thiết bị hình phễu được thiết kế đặc biệt, phần đáy được nhúng trong ni tơ lỏng. Bề mặt phẳng có cấu trúc dạng lưới, trên đó đặt các giọt 20 µl chứa trung bình 5 tinh trùng. Sau khi đông đặc, các giọt được nhận ở cấu trúc ống dưới cùng và được lưu trữ trong ni tơ lỏng [14].
So sánh hiệu quả sử dụng tinh trùng tươi và tinh trùng đông lạnh thu nhận từ micro-TESE
Theo phần lớn dữ liệu nghiên cứu hiện có, việc sử dụng tinh trùng tinh hoàn tươi so với tinh trùng tinh hoàn đông lạnh dường như mang lại kết quả tương đương về mặt thụ tinh, chất lượng phôi, làm tổ, thai lâm sàng và tỷ lệ sinh sống. Bên cạnh đó, mặc dù tỷ lệ thụ tinh thấp hơn xảy ra do sử dụng tinh trùng kém di động, nhưng không có sự khác biệt có ý nghĩa nào về sự phát triển phôi hoặc tỷ lệ mang thai giữa noãn được thụ tinh bởi tinh trùng di động và tinh trùng di động kém sau khi thụ tinh thành công. Nhìn chung, việc sử dụng tinh trùng tinh hoàn đông lạnh có khả năng di chuyển yếu so với tinh trùng tinh hoàn bất động hoàn toàn sẽ tạo ra phôi chất lượng tốt hơn, ngay cả khi tỷ lệ thụ tinh có thể tương tự nhau [15]. Do đó, trong nỗ lực cải thiện kết quả ICSI, các kỹ thuật như bổ sung các chất tăng cường khả năng di chuyển của tinh trùng, chủ yếu là pentoxifylline, đã được áp dụng để giúp phân biệt tinh trùng sống trong trường hợp tinh trùng hoàn toàn bất động.
Các chiến lược lựa chọn tinh trùng thay thế cũng đã mang lại những kết quả khả quan trong nỗ lực lựa chọn tinh trùng sống. Bao gồm HOST, xác định tinh trùng có sống và hoạt động dưới dạng đuôi cuộn, cũng như kỹ thuật lựa chọn tinh trùng bất động hỗ trợ laser (LAISS), gây ra hiện tượng cuộn đuôi và xoắn lại bằng cách chiếu tia laser. Pentoxifylline được báo cáo là một phương pháp thay thế tốt hơn HOST để lựa chọn tinh trùng sống trong quần thể tinh trùng TESE không di động [2].
Kết luận
Nên cân nhắc bảo quản lạnh số lượng ít tinh trùng tinh hoàn được lấy ra bằng phẫu thuật bất cứ khi nào có thể, vì tinh trùng tươi và tinh trùng đông lạnh đều cho kết quả tương đương nhau. Cần có thêm nhiều nghiên cứu với cỡ mẫu lớn hơn để có thể chuẩn hóa và tinh chỉnh các quy trình bảo quản lạnh được áp dụng tại các trung tâm hỗ trợ sinh sản khác nhau. Việc áp dụng kỹ thuật thủy tinh hóa để bảo quản lạnh số lượng ít tinh trùng tinh hoàn dường như hứa hẹn hơn so với phương pháp đông lạnh thông thường về khả năng phục hồi khả năng di động, bảo tồn tính toàn vẹn của DNA và màng, cũng như khả năng sống.
Trong tương lai, các phương pháp đông lạnh tinh trùng thu nhận từ micro-TESE-ICSI cần tập trung vào việc cải thiện các quy trình, phương pháp, bao gồm tốc độ làm lạnh và làm ấm/rã đông, nồng độ và sự kết hợp CPA, và các điều kiện cân bằng thẩm thấu. Việc sử dụng các dấu hiệu đông lạnh mới có nguồn gốc từ nghiên cứu phiên mã học, nghiên cứu protein học và tin sinh học, nhằm mô tả những thay đổi phân tử trong tinh trùng trước, trong và sau khi bảo quản lạnh, có thể cho phép áp dụng các quy trình cá nhân hóa nhằm tăng cường khả năng phục hồi tinh trùng sống và hoạt động sau khi rã đông.
Từ khóa: cryopreservation, micro-TESE, nonobstructive azoospermia, rare sperm
Tài liệu tham khảo
[1] R. Shah, “Surgical sperm retrieval: Techniques and their indications,” Indian J Urol, vol. 27, no. 1, pp. 102–109, 2011, doi: 10.4103/0970-1591.78439.
[2] V. Mangoli, E. Evgeni, and C. Wyns, “Sperm cryopreservation protocol for micro-TESE-retrieved sperm,” Asian J Androl, vol. 27, no. 3, pp. 392–398, Sept. 2024, doi: 10.4103/aja202466.
[3] G. F. Boafo, K. T. Magar, M. D. Ekpo, W. Qian, S. Tan, and C. Chen, “The Role of Cryoprotective Agents in Liposome Stabilization and Preservation,” Int J Mol Sci, vol. 23, no. 20, p. 12487, Oct. 2022, doi: 10.3390/ijms232012487.
[4] M. Schulz, J. Risopatrón, P. Uribe, E. Isachenko, V. Isachenko, and R. Sánchez, “Human sperm vitrification: A scientific report,” Andrology, vol. 8, no. 6, pp. 1642–1650, Nov. 2020, doi: 10.1111/andr.12847.
[5] N. Zribi et al., “Effect of freezing-thawing process and quercetin on human sperm survival and DNA integrity,” Cryobiology, vol. 65, no. 3, pp. 326–331, Dec. 2012, doi: 10.1016/j.cryobiol.2012.09.003.
[6] R. Walmsley, J. Cohen, T. Ferrara-Congedo, A. Reing, and J. Garrisi, “The first births and ongoing pregnancies associated with sperm cryopreservation within evacuated egg zonae,” Hum Reprod, vol. 13 Suppl 4, pp. 61–70, Dec. 1998, doi: 10.1093/humrep/13.suppl_4.61.
[7] M. Gil-Salom, J. Romero, C. Rubio, A. Ruiz, J. Remohí, and A. Pellicer, “Intracytoplasmic sperm injection with cryopreserved testicular spermatozoa,” Mol Cell Endocrinol, vol. 169, no. 1–2, pp. 15–19, Nov. 2000, doi: 10.1016/s0303-7207(00)00345-2.
[8] J. O. Sohn, S. H. Jun, L. S. Park, E. K. Kim, T. G. Chung, and D. R. Lee, “Comparison of recovery and viability of sperm in ICSI pipette after ultra rapid freezing or slow freezing,” Fertility and Sterility, vol. 80, p. 128, Sept. 2003, doi: 10.1016/S0015-0282(03)01213-5.
[9] A. Just, I. Gruber, M. Wöber, J. Lahodny, A. Obruca, and H. Strohmer, “Novel method for the cryopreservation of testicular sperm and ejaculated spermatozoa from patients with severe oligospermia: a pilot study,” Fertil Steril, vol. 82, no. 2, pp. 445–447, Aug. 2004, doi: 10.1016/j.fertnstert.2003.12.050.
[10] “Cryopreservation of spermatozoa in alginic acid capsules - PubMed.” Accessed: Sept. 11, 2025. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/16412755/
[11] “Ultra-rapid freezing of very low numbers of sperm using cryoloops - PubMed.” Accessed: Sept. 12, 2025. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/12660272/
[12] “Comparison of rapid freezing versus vitrification for human sperm cryopreservation using sucrose in closed straw systems - PubMed.” Accessed: Sept. 12, 2025. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/32870439/
[13] “Reliable single sperm cryopreservation in Cell Sleepers for azoospermia management - PubMed.” Accessed: Sept. 12, 2025. [Online]. Available: https://pubmed.ncbi.nlm.nih.gov/25988980/
[14] H. C. O’Neill, M. Nikoloska, H. Ho, A. Doshi, and W. Maalouf, “Improved cryopreservation of spermatozoa using vitrification: comparison of cryoprotectants and a novel device for long-term storage,” J Assist Reprod Genet, vol. 36, no. 8, pp. 1713–1720, Aug. 2019, doi: 10.1007/s10815-019-01505-x.
[15] Y. Arai et al., “Outcomes of the study of intracytoplasmic sperm injection (ICSI) and sperm motility with microdissection testicular sperm extraction,” Asian J Androl, vol. 24, no. 2, pp. 221–222, Sept. 2021, doi: 10.4103/aja202152.
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...








