Tin chuyên ngành
on Wednesday 25-10-2023 10:35pm
Danh mục: Vô sinh & hỗ trợ sinh sản
BS. Nguyễn Thị Thanh Dung(1), BS. Lý Thiện Trung(2)
(1): Bệnh viện Phụ sản TP. Cần Thơ
(2): Bệnh viện Mỹ Đức Phú Nhuận
I. MỞ ĐẦU
Ngày nay, hiện tượng phôi khảm xuất hiện rất phổ biến ở những chu kỳ thụ tinh trong ống nghiệm có thực hiện xét nghiệm di truyền tiền làm tổ. Đối với một số cặp vợ chồng không có phôi nguyên bội, thì việc sử dụng phôi khảm là một sự lựa chọn được đặt lên bàn cân cùng với việc kích thích buồng trứng thụ tinh trong ống nghiệm lại để tìm phôi nguyên bội. Chuyển phôi khảm được ghi nhận có làm giảm tỷ lệ có thai, giảm tỷ lệ làm tổ, tăng tỷ lệ sẩy thai và giảm tỷ lệ sinh sống (Hình 1). Trong phạm vi bài viết này chúng tôi xin được phép nhắc lại về phôi khảm và cập nhật các khuyến cáo sử dụng phôi khảm trong thực hành lâm sàng mới nhất hiện nay của Hiệp hội Sinh sản và Phôi học Người Châu Âu (European Society of Human Reproduction and Embryology – ESHRE) năm 2022.
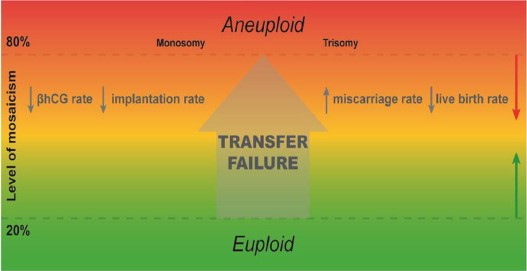
Hình 1: Mối quan hệ giữa mức độ khảm và kết quả chuyển của phôi khảm [6].
II. ĐỊNH NGHĨA PHÔI KHẢM
Bằng kỹ thuật Xét nghiệm di truyền tiền làm tổ phát hiện lệch bội (Preimplantation genetic testing for aneuploidies - PGT-A), các chuyên gia về hiếm muộn có thể đánh giá được đặc điểm về số lượng nhiễm sắc thể của phôi trước khi chuyển vào buồng tử cung.
Phôi nguyên bội (euploid) là phôi có số lượng nhiễm sắc thể bình thường (trên người là 22 cặp nhiễm sắc thể thường và 1 cặp nhiễm sắc thể giới tính). Phôi lệch bội (aneuploid) là phôi có bất thường về mặt số lượng nhiễm sắc thể (dư hoặc thiếu một hoặc vài nhiễm sắc thể thường hoặc nhiễm sắc thể giới tính). Phôi nguyên bội có tỷ lệ làm tổ và tỷ lệ sinh sống cao hơn so với phôi lệch bội. Mặt khác, phôi lệch bội có thể là nguyên nhân dẫn đến thất bại làm tổ, sẩy thai sớm hoặc dị tật bẩm sinh (như hội chứng Down, hội chứng Edward, hội chứng Pateau). Phôi khảm là sự hiện diện của hai hoặc nhiều dòng tế bào với các bộ nhiễm sắc thể khác nhau trong cùng một phôi (Hình 2).
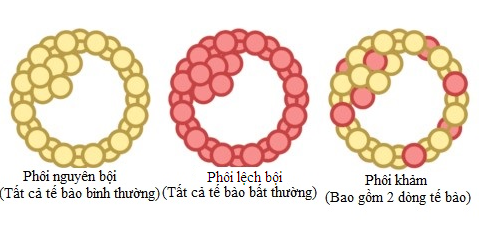
Hình 2: Đặc điểm của phôi nguyên bội, phôi lệch bội và phôi khảm [1]
Ở giai đoạn phôi nang, ước tính có khoảng 2% đến 50% sinh thiết phôi được báo cáo là khảm. Theo Hiệp hội Quốc tế Chẩn đoán Di truyền Tiền làm tổ (Preimplantation Genetic Diagnosis International Society - PGDIS) để báo cáo kết quả phôi nguyên bội, lệch bội hay phôi khảm, điểm giới hạn được đề xuất là 20% và 80%. Theo đó, nếu tỷ lệ lệch bội ở bất kỳ một nhiễm sắc thể nào < 20% thì phôi được xem là nguyên bội, nếu tỷ lệ này > 80% thì được xem là phôi lệch bội. Nếu tỷ lệ này nằm trong khoảng từ 20 - 80% thì phôi được gọi là phôi khảm [6].
III. CƠ CHẾ HÌNH THÀNH PHÔI KHẢM
Trái ngược với lệch bội thường có nguồn gốc từ giảm phân, thể khảm thường phát sinh do sự sai lệch trong quá trình nguyên phân của phôi sau khi thụ tinh [5]. Hiện nay có ba cơ chế chính có thể dẫn đến hiện tượng thêm hoặc mất nhiễm sắc thể trong nguyên phân: sự không phân ly, trễ anaphase (anaphase lagging), và nội nhân đôi nhiễm sắc thể (endoreplication).
(1) Không phân ly nhiễm sắc thể là hiện tượng nhiễm sắc thể chị em không được tách ra trong quá trình nguyên phân ở một vài tế bào. Sau khi nhân đôi thì một hoặc vài nhiễm sắc thể bị kéo về một bên cực của tế bào thay vì phân ly về hai cực, dẫn đến hình thành một tế bào dư một hoặc vài nhiễm sắc thể và một tế bào thiếu một hoặc vài nhiễm sắc thể (đều là các tế bào lệch bội). Sự tồn tại song song của nhóm tế bào nguyên bội và nhóm tế bào lệch bội là nguyên nhân tạo ra thể khảm.
(2) Trễ anaphase là hiện tượng nhiễm sắc thể không thể gắn vào thoi vô sắc hoặc gắn vào được thoi vô sắc nhưng không thể kết hợp vào nhân, từ đó tạo ra một tế bào dư nhiễm sắc thể và một tế bào thiếu nhiễm sắc thể. [13]
(3) Nội nhân đôi nhiễm sắc thể là tình trạng nhiễm sắc thể có sao chép mà không phân chia, dẫn đến tạo ra một tế bào đơn nhiễm và một tế bào tam nhiễm. Hiện tượng nội nhân đôi nhiễm sắc thể được cho rằng xuất phát từ hai cơ chế, thứ nhất là do sai sót trong chu trình tế bào làm cho một nhiễm sắc thể được sao chép mà không có phân chia tế bào chất, và thứ hai là do quá trình nguyên phân diễn ra trong thời gian quá ngắn chỉ đủ thời gian để sao chép nhiễm sắc thể. [14]
IV. TÍNH ĐẠI DIỆN CHO PHÔI CỦA KẾT QUẢ XÉT NGHIỆM DI TRUYỀN TIỀN LÀM TỔ
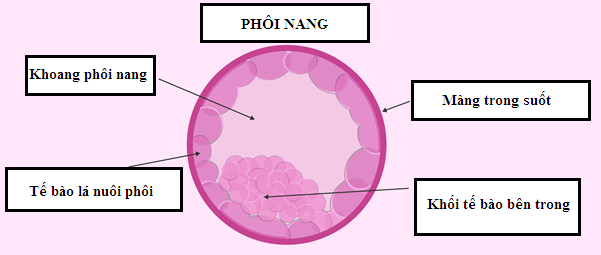
Hình 3: Cấu tạo một phôi nang [15]
Ngày nay, việc sinh thiết lấy tế bào để xét nghiệm di truyền không được khuyến cáo thực hiện trên phôi ở giai đoạn phân chia, mà chỉ nên thực hiện trên phôi ở giai đoạn phôi nang để giảm tối đa sự ảnh hưởng đến khả năng phát triển của phôi sau sinh thiết [15]. Để thực hiện xét nghiệm di truyền phôi nang, cần có 5 – 10 tế bào được sinh thiết từ ngoại bì lá nuôi (Trophectoderm - TE) chứ không được lấy từ khối nội phôi bào (Inner cell mass – ICM) (Hình 3).
Về bản chất, TE và ICM có cùng nguồn gốc từ hợp tử ban đầu nên đặc điểm di truyền sẽ phải giống nhau. Tuy nhiên các sai lệch đều có thể xảy ra trong quá trình nguyên phân. Nếu sự không phân ly diễn ra ở giai đoạn phôi phân chia (trước quá trình biệt hoá phôi bào), có thể khối nội phôi bào và ngoại bì lá nuôi của phôi đều ở dạng khảm. Nếu sự không phân ly diễn ra ở ngoại bì lá nuôi trong tại giai đoạn phôi nang (giai đoạn sau của quá trình biệt hoá phôi bào) thì có thể nhau thai chứa dòng tế bào khảm, trong khi đó, phôi thai vẫn không bị ảnh hưởng [3]. Ngoài ra, kết quả xét nghiệm di truyền chỉ đánh giá 5 - 10 phôi bào được sinh thiết từ ngoại bì lá nuôi. Các tế bào ngoại bì lá nuôi ở các vị trí khác nhau có thể có đặc điểm di truyền khác nhau và khác với khối nội phôi bào nếu sai lệch nguyên phân xảy ra ở giai đoạn phôi bào đã biệt hoá.
V. HIỆU QUẢ SỬ DỤNG PHÔI KHẢM
Cho đến nay, hiệu quả của việc lựa chọn phôi khảm để sử dụng vẫn còn gây tranh cãi. Nhiều nghiên cứu cho thấy sử dụng phôi khảm làm tăng tỷ lệ sẩy thai và các kết quả chu sinh bất lợi. Tuy nhiên, cũng đã có nhiều báo cáo cho kết quả trẻ sinh sống khỏe mạnh từ phôi khảm.
Nghiên cứu mù đôi của Capalbo và cộng sự công bố năm 2021 thực hiện trên 484 phôi nguyên bội, 282 phôi khảm nguy cơ thấp và 131 phôi khảm nguy cơ trung bình ghi nhận tỷ lệ trẻ sinh sống của phôi nguyên bội, phôi khảm thấp và trung bình lần lượt là 43,4% (95%, KTC, 38,9 – 47), 42,9% (95%, KTC, 37,1 – 48,9) và 42% (95%, KTC, 33,4 – 50,9). Kết cục sản khoa và trẻ sơ sinh là tương đương nhau giữa các nhóm nghiên cứu. Thêm vào đó, nghiên cứu cho thấy phôi khảm thấp (20 - 30%) có thể được chuyển mà tỷ lệ sinh sống và tỷ lệ sẩy thai tương đương nhau và ghi nhận không có trường hợp trẻ sinh ra bị bất thường về dị tật. [2]
Greco và cộng sự vào năm 2015 đã báo cáo về kết cục của trẻ sinh ra khỏe mạnh sau chuyển phôi khảm. Nghiên cứu gồm 8 phụ nữ thực hiện IVF chuyển phôi khảm (tỷ lệ khảm từ 30-50%) do không có phôi nguyên bội để chuyển. Kết quả cả 8 trường hợp có thai lâm sàng, trong đó có 6 trẻ khỏe mạnh được sinh ra. [5]
Bên cạnh đó, Zhang và cộng sự vào năm 2019 đã nghiên cứu trên 102 phôi khảm (tỷ lệ khảm <50%), và 268 phôi nguyên bội ở nhóm chứng. Kết quả cho thấy tỷ lệ sinh sống trên mỗi chu kỳ chuyển phôi ở nhóm phôi khảm thấp hơn so với nhóm chứng (46,6% so với 59,1%), với tỷ lệ chênh lệch là 0,6 (95%, KTC, 0,38 – 0,95). Tỷ lệ có thai trên mỗi chu kỳ chuyển phôi khảm thấp hơn đáng kể so với chuyển phôi nguyên bội (65,7% so với 76,1%), (95%, KTC, 0,37 - 0,99). Tác giả ghi nhận không có sự khác biệt có ý nghĩa thống kê giữa các nhóm về tỷ lệ thai lâm sàng và sẩy thai. [12]
Spinella và cộng sự vào năm 2018 đã thực hiện chuyển 77 phôi khảm trên những phụ nữ điều trị thụ tinh trong ống nghiệm nhưng không có phôi nguyên bội. Kết quả lâm sàng thu được sau khi chuyển phôi khảm có tỷ lệ lệch bội thấp (< 50%) và cao (≥ 50%) được so sánh với nhóm chứng gồm 251 phôi bình thường. Kết quả có 24 trẻ được sinh ra có karyotype bình thường từ chuyển phôi khảm. Phôi khảm có tỷ lệ lệch bội cao (≥ 50%) có tỷ lệ thai lâm sàng thấp hơn (15,2% so với 46,4%), tỷ lệ làm tổ thấp hơn (24,4% so với 54,6%) và tỷ lệ sinh sống thấp hơn (15,2% so với 40,2%). Ngược lại, phôi có tỷ lệ lệch bội thấp (< 50%) có kết quả lâm sàng tương đương phôi bình thường. [8]
Một nghiên cứu khác của Viotti và cộng sự vào năm 2020 thực hiện chuyển tổng cộng 5.561 phôi nguyên bội và 1.000 phôi khảm, ghi nhận tỷ lệ làm tổ, tỷ lệ thai lâm sàng và tỷ lệ trẻ sinh sống ở nhóm phôi khảm có tỷ lệ lệch bội < 50% cao hơn so với nhóm phôi khảm có tỉ lệ lệch bội ≥ 50%). [10]
Trong nghiên cứu của Zore và cộng sự năm 2019, trong số 377 phôi được chuyển, với 357 phôi nguyên bội và 20 phôi khảm thì tỷ lệ trẻ sinh sống ở các trường hợp chuyển phôi khảm thấp hơn đáng kể so với nhóm chuyển phôi nguyên bội (30,0% so với 53,8%). Tỷ lệ sẩy thai tự nhiên cao hơn có ý nghĩa thống kê sau khi chuyển phôi khảm so với chuyển phôi nguyên bội (40,0% so với 18,2%). [11]
VI. CẬP NHẬT KHUYẾN CÁO SỬ DỤNG PHÔI KHẢM THEO ESHRE 2022
Dưới đây là những khuyến cáo mới nhất của ESHRE về sử dụng phôi khảm. [4]
• Các trung tâm hỗ trợ sinh sản, sinh thiết phôi nên giám sát dữ liệu về phôi khảm và điều chỉnh chính sách bất cứ khi nào có bằng chứng cập nhật mới.
• Nếu kỹ thuật xét nghiệm di truyền tiền làm tổ được sử dụng không đánh giá được phôi khảm, nên thảo luận với bệnh nhân trong quá trình tư vấn di truyền và/hoặc được đề cập rõ ràng trong quá trình nghiên cứu tiền lâm sàng.
• Nếu có chỉ định để chuyển phôi khảm, cần tư vấn rõ lợi ích và nguy cơ với bệnh nhân trong quá trình tư vấn di truyền và/hoặc được đề cập rõ ràng trong quá trình nghiên cứu tiền lâm sàng.
• Trung tâm xét nghiệm di truyền tiền làm tổ có thể không báo cáo phôi khảm, chỉ cần trung tâm đó có chiến lược phân loại phôi và hành động dựa trên chiến lược đó. Không được phép coi phôi khảm như là phôi lệch bội.
• Các phòng xét nghiệm nên trình bày cách tiếp cận của họ đối với việc quản lý phôi khảm trong bảng đồng thuận xét nghiệm di truyền tiền làm tổ và thảo luận với khách hàng trong các buổi tư vấn trước khi bắt đầu thực hiện quy trình xét nghiệm.
• Tư vấn di truyền nên bao gồm các giới hạn kỹ thuật và sinh học liên quan đến việc phát hiện phôi khảm và chính sách của trung tâm về chuyển và bảo quản phôi khảm.
• Phôi khảm cần được đưa vào bảng cung cấp thông tin và văn bản đồng thuận sàng lọc nhiễm sắc thể.
• Vì sự hiện diện của phôi khảm là một vấn đề khi phân tích các mẫu sinh thiết tế bào lá nuôi, nên đưa các mẫu khảm (tức là hỗn hợp các tế bào có tế bào lệch bội và tế bào bình thường) vào nghiên cứu kiểm chứng.
• Nếu phôi khảm được báo cáo, thì nên thực hiện các thử nghiệm xác thực, đồng thời dữ liệu xác thực và tiêu chí cụ thể được sử dụng để phân loại khảm phải được ghi lại rõ ràng cho trung tâm hỗ trợ sinh sản.
• Liên quan đến các hạn chế của xét nghiệm, nên xác định ngưỡng phát hiện khảm.
• Rủi ro về kết quả âm tính giả hoặc dương tính giả do các lý do kỹ thuật và sinh học. Việc phát hiện phôi khảm trong sinh thiết tế bào lá nuôi có thể không phản ánh cấu tạo của toàn bộ phôi cũng như khả năng sống của phôi.
• Nguy cơ bệnh nhân bị sẩy thai, thai chết lưu hoặc con cái bị bất thường nhiễm sắc thể nằm ngoài phạm vi kiểm tra của xét nghiệm.
• Thuật ngữ báo cáo kết quả xét nghiệm di truyền tiền làm tổ phải phản ánh thực tế là sinh thiết tế bào lá nuôi không thể đưa ra quyết định tuyệt đối về khảm trong phần còn lại của phôi. Do đó, các phát hiện di truyền phù hợp với việc phát hiện khảm nên được mô tả bằng từ ngữ như “giả định”, “chỉ ra” hoặc “gợi ý”.
• Chúng tôi khuyến nghị rằng tất cả các hạn chế về kỹ thuật và sinh học liên quan đến việc phát hiện bệnh khảm đều được nêu rõ trong tư vấn xét nghiệm di truyền tiền làm tổ.
• Ngoài ra, tư vấn xét nghiệm di truyền tiền làm tổ phải có thông tin kỹ thuật để cho phép diễn giải dữ liệu một cách cẩn thận. Trong trường hợp phôi được vận chuyển giữa các trung tâm khác nhau, thông tin kỹ thuật chi tiết phải được cung cấp theo yêu cầu.
• Khi xem xét việc chuyển phôi khảm:
a. Cân nhắc chuyển phôi khảm tỷ lệ thấp (<50%) sau khi được tư vấn di truyền phù hợp, liên quan đến những rủi ro tiềm ẩn.
b. Không khuyến khích thực hiện chu kỳ mới nếu có phôi khảm tỷ khảm lệ thấp có thể chuyển.
c. Không khuyến cáo sinh thiết lại để khẳng định kết quả khảm.
d. Không thể đưa ra các khuyến cáo cụ thể liên quan đến khả năng chuyển phôi khảm, tỷ lệ khảm cao do không đủ dữ liệu từ các nghiên cứu hiện có. Trong trường hợp không có dữ liệu kết luận, cần tư vấn di truyền kỹ trước khi chuyển phôi khảm nguy cơ cao, cho dù trong môi trường nghiên cứu hay trong thực hành lâm sàng.
Theo dõi trẻ được sinh ra: Karyotype máu ngoại vi.
VII. KẾT LUẬN
Có bằng chứng rằng phôi khảm có tỷ lệ làm tổ, tỷ lệ sinh sống thấp hơn và tỷ lệ sẩy thai cao hơn so với phôi nguyên bội. Tuy nhiên, không có đủ dữ liệu liên quan đến sức khỏe của thai kỳ và trẻ sinh ra sau khi chuyển phôi khảm. Việc xét nghiệm di truyền phôi dựa trên một số tế bào lá nuôi có thể chưa đại diện cho toàn bộ phôi. Do đó, chuyển phôi khảm cần dựa trên những cập nhật, khuyến cáo, nghiên cứu mới nhất ở thời điểm điều trị. Cần tư vấn rõ cho bệnh nhân về lợi ích và hạn chế của xét nghiệm di truyền tiền làm tổ và có nên chuyển phôi khảm hay không. Đặc biệt, nếu quyết định sử dụng phôi khảm, cần phải theo dõi kỹ toàn bộ thai kỳ và sức khỏe của trẻ được sinh ra.
TÀI LIỆU THAM KHẢO
(1): Bệnh viện Phụ sản TP. Cần Thơ
(2): Bệnh viện Mỹ Đức Phú Nhuận
I. MỞ ĐẦU
Ngày nay, hiện tượng phôi khảm xuất hiện rất phổ biến ở những chu kỳ thụ tinh trong ống nghiệm có thực hiện xét nghiệm di truyền tiền làm tổ. Đối với một số cặp vợ chồng không có phôi nguyên bội, thì việc sử dụng phôi khảm là một sự lựa chọn được đặt lên bàn cân cùng với việc kích thích buồng trứng thụ tinh trong ống nghiệm lại để tìm phôi nguyên bội. Chuyển phôi khảm được ghi nhận có làm giảm tỷ lệ có thai, giảm tỷ lệ làm tổ, tăng tỷ lệ sẩy thai và giảm tỷ lệ sinh sống (Hình 1). Trong phạm vi bài viết này chúng tôi xin được phép nhắc lại về phôi khảm và cập nhật các khuyến cáo sử dụng phôi khảm trong thực hành lâm sàng mới nhất hiện nay của Hiệp hội Sinh sản và Phôi học Người Châu Âu (European Society of Human Reproduction and Embryology – ESHRE) năm 2022.

Hình 1: Mối quan hệ giữa mức độ khảm và kết quả chuyển của phôi khảm [6].
II. ĐỊNH NGHĨA PHÔI KHẢM
Bằng kỹ thuật Xét nghiệm di truyền tiền làm tổ phát hiện lệch bội (Preimplantation genetic testing for aneuploidies - PGT-A), các chuyên gia về hiếm muộn có thể đánh giá được đặc điểm về số lượng nhiễm sắc thể của phôi trước khi chuyển vào buồng tử cung.
Phôi nguyên bội (euploid) là phôi có số lượng nhiễm sắc thể bình thường (trên người là 22 cặp nhiễm sắc thể thường và 1 cặp nhiễm sắc thể giới tính). Phôi lệch bội (aneuploid) là phôi có bất thường về mặt số lượng nhiễm sắc thể (dư hoặc thiếu một hoặc vài nhiễm sắc thể thường hoặc nhiễm sắc thể giới tính). Phôi nguyên bội có tỷ lệ làm tổ và tỷ lệ sinh sống cao hơn so với phôi lệch bội. Mặt khác, phôi lệch bội có thể là nguyên nhân dẫn đến thất bại làm tổ, sẩy thai sớm hoặc dị tật bẩm sinh (như hội chứng Down, hội chứng Edward, hội chứng Pateau). Phôi khảm là sự hiện diện của hai hoặc nhiều dòng tế bào với các bộ nhiễm sắc thể khác nhau trong cùng một phôi (Hình 2).

Hình 2: Đặc điểm của phôi nguyên bội, phôi lệch bội và phôi khảm [1]
Ở giai đoạn phôi nang, ước tính có khoảng 2% đến 50% sinh thiết phôi được báo cáo là khảm. Theo Hiệp hội Quốc tế Chẩn đoán Di truyền Tiền làm tổ (Preimplantation Genetic Diagnosis International Society - PGDIS) để báo cáo kết quả phôi nguyên bội, lệch bội hay phôi khảm, điểm giới hạn được đề xuất là 20% và 80%. Theo đó, nếu tỷ lệ lệch bội ở bất kỳ một nhiễm sắc thể nào < 20% thì phôi được xem là nguyên bội, nếu tỷ lệ này > 80% thì được xem là phôi lệch bội. Nếu tỷ lệ này nằm trong khoảng từ 20 - 80% thì phôi được gọi là phôi khảm [6].
III. CƠ CHẾ HÌNH THÀNH PHÔI KHẢM
Trái ngược với lệch bội thường có nguồn gốc từ giảm phân, thể khảm thường phát sinh do sự sai lệch trong quá trình nguyên phân của phôi sau khi thụ tinh [5]. Hiện nay có ba cơ chế chính có thể dẫn đến hiện tượng thêm hoặc mất nhiễm sắc thể trong nguyên phân: sự không phân ly, trễ anaphase (anaphase lagging), và nội nhân đôi nhiễm sắc thể (endoreplication).
(1) Không phân ly nhiễm sắc thể là hiện tượng nhiễm sắc thể chị em không được tách ra trong quá trình nguyên phân ở một vài tế bào. Sau khi nhân đôi thì một hoặc vài nhiễm sắc thể bị kéo về một bên cực của tế bào thay vì phân ly về hai cực, dẫn đến hình thành một tế bào dư một hoặc vài nhiễm sắc thể và một tế bào thiếu một hoặc vài nhiễm sắc thể (đều là các tế bào lệch bội). Sự tồn tại song song của nhóm tế bào nguyên bội và nhóm tế bào lệch bội là nguyên nhân tạo ra thể khảm.
(2) Trễ anaphase là hiện tượng nhiễm sắc thể không thể gắn vào thoi vô sắc hoặc gắn vào được thoi vô sắc nhưng không thể kết hợp vào nhân, từ đó tạo ra một tế bào dư nhiễm sắc thể và một tế bào thiếu nhiễm sắc thể. [13]
(3) Nội nhân đôi nhiễm sắc thể là tình trạng nhiễm sắc thể có sao chép mà không phân chia, dẫn đến tạo ra một tế bào đơn nhiễm và một tế bào tam nhiễm. Hiện tượng nội nhân đôi nhiễm sắc thể được cho rằng xuất phát từ hai cơ chế, thứ nhất là do sai sót trong chu trình tế bào làm cho một nhiễm sắc thể được sao chép mà không có phân chia tế bào chất, và thứ hai là do quá trình nguyên phân diễn ra trong thời gian quá ngắn chỉ đủ thời gian để sao chép nhiễm sắc thể. [14]
IV. TÍNH ĐẠI DIỆN CHO PHÔI CỦA KẾT QUẢ XÉT NGHIỆM DI TRUYỀN TIỀN LÀM TỔ

Hình 3: Cấu tạo một phôi nang [15]
Ngày nay, việc sinh thiết lấy tế bào để xét nghiệm di truyền không được khuyến cáo thực hiện trên phôi ở giai đoạn phân chia, mà chỉ nên thực hiện trên phôi ở giai đoạn phôi nang để giảm tối đa sự ảnh hưởng đến khả năng phát triển của phôi sau sinh thiết [15]. Để thực hiện xét nghiệm di truyền phôi nang, cần có 5 – 10 tế bào được sinh thiết từ ngoại bì lá nuôi (Trophectoderm - TE) chứ không được lấy từ khối nội phôi bào (Inner cell mass – ICM) (Hình 3).
Về bản chất, TE và ICM có cùng nguồn gốc từ hợp tử ban đầu nên đặc điểm di truyền sẽ phải giống nhau. Tuy nhiên các sai lệch đều có thể xảy ra trong quá trình nguyên phân. Nếu sự không phân ly diễn ra ở giai đoạn phôi phân chia (trước quá trình biệt hoá phôi bào), có thể khối nội phôi bào và ngoại bì lá nuôi của phôi đều ở dạng khảm. Nếu sự không phân ly diễn ra ở ngoại bì lá nuôi trong tại giai đoạn phôi nang (giai đoạn sau của quá trình biệt hoá phôi bào) thì có thể nhau thai chứa dòng tế bào khảm, trong khi đó, phôi thai vẫn không bị ảnh hưởng [3]. Ngoài ra, kết quả xét nghiệm di truyền chỉ đánh giá 5 - 10 phôi bào được sinh thiết từ ngoại bì lá nuôi. Các tế bào ngoại bì lá nuôi ở các vị trí khác nhau có thể có đặc điểm di truyền khác nhau và khác với khối nội phôi bào nếu sai lệch nguyên phân xảy ra ở giai đoạn phôi bào đã biệt hoá.
V. HIỆU QUẢ SỬ DỤNG PHÔI KHẢM
Cho đến nay, hiệu quả của việc lựa chọn phôi khảm để sử dụng vẫn còn gây tranh cãi. Nhiều nghiên cứu cho thấy sử dụng phôi khảm làm tăng tỷ lệ sẩy thai và các kết quả chu sinh bất lợi. Tuy nhiên, cũng đã có nhiều báo cáo cho kết quả trẻ sinh sống khỏe mạnh từ phôi khảm.
Nghiên cứu mù đôi của Capalbo và cộng sự công bố năm 2021 thực hiện trên 484 phôi nguyên bội, 282 phôi khảm nguy cơ thấp và 131 phôi khảm nguy cơ trung bình ghi nhận tỷ lệ trẻ sinh sống của phôi nguyên bội, phôi khảm thấp và trung bình lần lượt là 43,4% (95%, KTC, 38,9 – 47), 42,9% (95%, KTC, 37,1 – 48,9) và 42% (95%, KTC, 33,4 – 50,9). Kết cục sản khoa và trẻ sơ sinh là tương đương nhau giữa các nhóm nghiên cứu. Thêm vào đó, nghiên cứu cho thấy phôi khảm thấp (20 - 30%) có thể được chuyển mà tỷ lệ sinh sống và tỷ lệ sẩy thai tương đương nhau và ghi nhận không có trường hợp trẻ sinh ra bị bất thường về dị tật. [2]
Greco và cộng sự vào năm 2015 đã báo cáo về kết cục của trẻ sinh ra khỏe mạnh sau chuyển phôi khảm. Nghiên cứu gồm 8 phụ nữ thực hiện IVF chuyển phôi khảm (tỷ lệ khảm từ 30-50%) do không có phôi nguyên bội để chuyển. Kết quả cả 8 trường hợp có thai lâm sàng, trong đó có 6 trẻ khỏe mạnh được sinh ra. [5]
Bên cạnh đó, Zhang và cộng sự vào năm 2019 đã nghiên cứu trên 102 phôi khảm (tỷ lệ khảm <50%), và 268 phôi nguyên bội ở nhóm chứng. Kết quả cho thấy tỷ lệ sinh sống trên mỗi chu kỳ chuyển phôi ở nhóm phôi khảm thấp hơn so với nhóm chứng (46,6% so với 59,1%), với tỷ lệ chênh lệch là 0,6 (95%, KTC, 0,38 – 0,95). Tỷ lệ có thai trên mỗi chu kỳ chuyển phôi khảm thấp hơn đáng kể so với chuyển phôi nguyên bội (65,7% so với 76,1%), (95%, KTC, 0,37 - 0,99). Tác giả ghi nhận không có sự khác biệt có ý nghĩa thống kê giữa các nhóm về tỷ lệ thai lâm sàng và sẩy thai. [12]
Spinella và cộng sự vào năm 2018 đã thực hiện chuyển 77 phôi khảm trên những phụ nữ điều trị thụ tinh trong ống nghiệm nhưng không có phôi nguyên bội. Kết quả lâm sàng thu được sau khi chuyển phôi khảm có tỷ lệ lệch bội thấp (< 50%) và cao (≥ 50%) được so sánh với nhóm chứng gồm 251 phôi bình thường. Kết quả có 24 trẻ được sinh ra có karyotype bình thường từ chuyển phôi khảm. Phôi khảm có tỷ lệ lệch bội cao (≥ 50%) có tỷ lệ thai lâm sàng thấp hơn (15,2% so với 46,4%), tỷ lệ làm tổ thấp hơn (24,4% so với 54,6%) và tỷ lệ sinh sống thấp hơn (15,2% so với 40,2%). Ngược lại, phôi có tỷ lệ lệch bội thấp (< 50%) có kết quả lâm sàng tương đương phôi bình thường. [8]
Một nghiên cứu khác của Viotti và cộng sự vào năm 2020 thực hiện chuyển tổng cộng 5.561 phôi nguyên bội và 1.000 phôi khảm, ghi nhận tỷ lệ làm tổ, tỷ lệ thai lâm sàng và tỷ lệ trẻ sinh sống ở nhóm phôi khảm có tỷ lệ lệch bội < 50% cao hơn so với nhóm phôi khảm có tỉ lệ lệch bội ≥ 50%). [10]
Trong nghiên cứu của Zore và cộng sự năm 2019, trong số 377 phôi được chuyển, với 357 phôi nguyên bội và 20 phôi khảm thì tỷ lệ trẻ sinh sống ở các trường hợp chuyển phôi khảm thấp hơn đáng kể so với nhóm chuyển phôi nguyên bội (30,0% so với 53,8%). Tỷ lệ sẩy thai tự nhiên cao hơn có ý nghĩa thống kê sau khi chuyển phôi khảm so với chuyển phôi nguyên bội (40,0% so với 18,2%). [11]
VI. CẬP NHẬT KHUYẾN CÁO SỬ DỤNG PHÔI KHẢM THEO ESHRE 2022
Dưới đây là những khuyến cáo mới nhất của ESHRE về sử dụng phôi khảm. [4]
- Khuyến cáo chung
• Các trung tâm hỗ trợ sinh sản, sinh thiết phôi nên giám sát dữ liệu về phôi khảm và điều chỉnh chính sách bất cứ khi nào có bằng chứng cập nhật mới.
• Nếu kỹ thuật xét nghiệm di truyền tiền làm tổ được sử dụng không đánh giá được phôi khảm, nên thảo luận với bệnh nhân trong quá trình tư vấn di truyền và/hoặc được đề cập rõ ràng trong quá trình nghiên cứu tiền lâm sàng.
• Nếu có chỉ định để chuyển phôi khảm, cần tư vấn rõ lợi ích và nguy cơ với bệnh nhân trong quá trình tư vấn di truyền và/hoặc được đề cập rõ ràng trong quá trình nghiên cứu tiền lâm sàng.
• Trung tâm xét nghiệm di truyền tiền làm tổ có thể không báo cáo phôi khảm, chỉ cần trung tâm đó có chiến lược phân loại phôi và hành động dựa trên chiến lược đó. Không được phép coi phôi khảm như là phôi lệch bội.
- Khuyến cáo cụ thể cho tư vấn di truyền và bảng cung cấp thông tin
• Các phòng xét nghiệm nên trình bày cách tiếp cận của họ đối với việc quản lý phôi khảm trong bảng đồng thuận xét nghiệm di truyền tiền làm tổ và thảo luận với khách hàng trong các buổi tư vấn trước khi bắt đầu thực hiện quy trình xét nghiệm.
• Tư vấn di truyền nên bao gồm các giới hạn kỹ thuật và sinh học liên quan đến việc phát hiện phôi khảm và chính sách của trung tâm về chuyển và bảo quản phôi khảm.
• Phôi khảm cần được đưa vào bảng cung cấp thông tin và văn bản đồng thuận sàng lọc nhiễm sắc thể.
- Khuyến cáo cụ thể về chỉ định
• Vì sự hiện diện của phôi khảm là một vấn đề khi phân tích các mẫu sinh thiết tế bào lá nuôi, nên đưa các mẫu khảm (tức là hỗn hợp các tế bào có tế bào lệch bội và tế bào bình thường) vào nghiên cứu kiểm chứng.
• Nếu phôi khảm được báo cáo, thì nên thực hiện các thử nghiệm xác thực, đồng thời dữ liệu xác thực và tiêu chí cụ thể được sử dụng để phân loại khảm phải được ghi lại rõ ràng cho trung tâm hỗ trợ sinh sản.
• Liên quan đến các hạn chế của xét nghiệm, nên xác định ngưỡng phát hiện khảm.
- Khuyến cáo cụ thể để đánh giá rủi ro
• Rủi ro về kết quả âm tính giả hoặc dương tính giả do các lý do kỹ thuật và sinh học. Việc phát hiện phôi khảm trong sinh thiết tế bào lá nuôi có thể không phản ánh cấu tạo của toàn bộ phôi cũng như khả năng sống của phôi.
• Nguy cơ bệnh nhân bị sẩy thai, thai chết lưu hoặc con cái bị bất thường nhiễm sắc thể nằm ngoài phạm vi kiểm tra của xét nghiệm.
- Khuyến cáo cụ thể về phôi khảm
• Thuật ngữ báo cáo kết quả xét nghiệm di truyền tiền làm tổ phải phản ánh thực tế là sinh thiết tế bào lá nuôi không thể đưa ra quyết định tuyệt đối về khảm trong phần còn lại của phôi. Do đó, các phát hiện di truyền phù hợp với việc phát hiện khảm nên được mô tả bằng từ ngữ như “giả định”, “chỉ ra” hoặc “gợi ý”.
• Chúng tôi khuyến nghị rằng tất cả các hạn chế về kỹ thuật và sinh học liên quan đến việc phát hiện bệnh khảm đều được nêu rõ trong tư vấn xét nghiệm di truyền tiền làm tổ.
• Ngoài ra, tư vấn xét nghiệm di truyền tiền làm tổ phải có thông tin kỹ thuật để cho phép diễn giải dữ liệu một cách cẩn thận. Trong trường hợp phôi được vận chuyển giữa các trung tâm khác nhau, thông tin kỹ thuật chi tiết phải được cung cấp theo yêu cầu.
- Chính sách quản lý chuyển phôi
• Khi xem xét việc chuyển phôi khảm:
a. Cân nhắc chuyển phôi khảm tỷ lệ thấp (<50%) sau khi được tư vấn di truyền phù hợp, liên quan đến những rủi ro tiềm ẩn.
b. Không khuyến khích thực hiện chu kỳ mới nếu có phôi khảm tỷ khảm lệ thấp có thể chuyển.
c. Không khuyến cáo sinh thiết lại để khẳng định kết quả khảm.
d. Không thể đưa ra các khuyến cáo cụ thể liên quan đến khả năng chuyển phôi khảm, tỷ lệ khảm cao do không đủ dữ liệu từ các nghiên cứu hiện có. Trong trường hợp không có dữ liệu kết luận, cần tư vấn di truyền kỹ trước khi chuyển phôi khảm nguy cơ cao, cho dù trong môi trường nghiên cứu hay trong thực hành lâm sàng.
- Khuyến cáo cụ theo dõi thai kỳ và trẻ được sinh ra
Theo dõi trẻ được sinh ra: Karyotype máu ngoại vi.
VII. KẾT LUẬN
Có bằng chứng rằng phôi khảm có tỷ lệ làm tổ, tỷ lệ sinh sống thấp hơn và tỷ lệ sẩy thai cao hơn so với phôi nguyên bội. Tuy nhiên, không có đủ dữ liệu liên quan đến sức khỏe của thai kỳ và trẻ sinh ra sau khi chuyển phôi khảm. Việc xét nghiệm di truyền phôi dựa trên một số tế bào lá nuôi có thể chưa đại diện cho toàn bộ phôi. Do đó, chuyển phôi khảm cần dựa trên những cập nhật, khuyến cáo, nghiên cứu mới nhất ở thời điểm điều trị. Cần tư vấn rõ cho bệnh nhân về lợi ích và hạn chế của xét nghiệm di truyền tiền làm tổ và có nên chuyển phôi khảm hay không. Đặc biệt, nếu quyết định sử dụng phôi khảm, cần phải theo dõi kỹ toàn bộ thai kỳ và sức khỏe của trẻ được sinh ra.
TÀI LIỆU THAM KHẢO
- Abhari S, Kawwass JF. Pregnancy and Neonatal Outcomes after Transfer of Mosaic Embryos: A Review. J Clin Med. 2021 Mar 27;10(7):1369.
- Capalbo A, Poli M, Rienzi L, et al. Mosaic human preimplantation embryos and their developmental potential in a prospective, non-selection clinical trial. Am J Hum Genet. 2021;108(12):2238-2247.
- Coonen E, Derhaag JG, Dumoulin JCM, van Wissen LCP, Bras M, Janssen M, et al. Anaphase lagging mainly explains chromosomal mosaicism in human preimplantation embryos. Hum Reprod. 2004 Feb;19(2):316–24.
- ESHRE Working Group on Chromosomal Mosaicism and others, ESHRE survey results and good practice recommendations on managing chromosomal mosaicism, Human Reproduction Open, Volume 2022, Issue 4, 2022
- Greco E, Minasi MG, Fiorentino F. Healthy Babies after Intrauterine Transfer of Mosaic Aneuploid Blastocysts. N Engl J Med. 2015 Nov 19;373(21):2089-90.
- Munné S, Grifo J, Wells D. Mosaicism: "survival of the fittest" versus "no embryo left behind". Fertil Steril. 2016 May;105(5):1146-1149. doi: 10.1016/j.fertnstert.2016.01.016.
- PGDIS position statement on the transfer of mosaic embryos 2021.
- Spinella F, Fiorentino F, Biricik A, Bono S, Ruberti A, Cotroneo E, Baldi M, Cursio E, Minasi MG, Greco E. Extent of chromosomal mosaicism influences the clinical outcome of in vitro fertilization treatments. Fertil Steril. 2018 Jan;109(1):77-83.
- Taylor TH, Gitlin SA, Patrick JL, Crain JL, Wilson JM, Griffin DK. The origin, mechanisms, incidence and clinical consequences of chromosomal mosaicism in humans. Hum Reprod Update. 2014;20(4):571–81.
- Viotti M, Victor AR, Barnes FL, Zouves CG, Besser AG, Grifo JA, Cheng EH, Lee MS, Horcajadas JA, Corti L, Fiorentino F, Spinella F, Minasi MG, Greco E, Munné S. Using outcome data from one thousand mosaic embryo transfers to formulate an embryo ranking system for clinical use. Fertil Steril. 2021 May;115(5):1212-12
- Zore T, Kroener LL, Wang C, Liu L, Buyalos R, Hubert G, Shamonki M. Transfer of embryos with segmental mosaicism is associated with a significant reduction in live-birth rate. Fertil Steril. 2019 Jan;111(1):69-76.
- Zhang, L., Wei, D., Zhu, Y., Gao, Y., Yan, J., & Chen, Z. J. (2019). Rates of live birth after mosaic embryo transfer compared with euploid embryo transfer. Journal of assisted reproduction and genetics, 36(1), 165–172.
- Forman EJ, Treff NR, Stevens JM, Garnsey HM, Katz-Jaffe MG, Scott RTJ, et al. Embryos whose polar bodies contain isolated reciprocal chromosome aneuploidy are almost always euploid. Hum Reprod. 2013 Feb;28(2):502–8.
- Vázquez-Diez C, FitzHarris G. Causes and consequences of chromosome segregation error in preimplantation embryos. Reproduction. 2018 Jan;155(1):R63–76
- Scott RT Jr, Upham KM, Forman EJ, Hong KH, Scott KL, Taylor D, Tao X, Treff NR. Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: a randomized controlled trial. Fertil Steril. 2013 Sep;100(3):697-703. doi: 10.1016/j.fertnstert.2013.04.035. Epub 2013 Jun 1. PMID: 23731996.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...
FACEBOOK








