Tin chuyên ngành
on Thursday 11-06-2020 10:32am
Danh mục: Vô sinh & hỗ trợ sinh sản
ThS. Võ Như Thanh Trúc – Chuyên viên phôi học – IVFAS
1. Sự tương tác noãn – tế bào hạt và các cấu trúc TZP (transzonal projection)
Sự hình thành và phát triển nang noãn cũng như tiềm năng phát triển của noãn phụ thuộc vào hệ thống các yếu tố điều hòa liên quan đến các con đường truyền tín hiệu của các yếu tố nội tiết, cận tiết và tự tiết. Một số nghiên cứu cho thấy các yếu tố tăng trưởng như TGFβ, GDF9, BMP15 có nguồn gốc từ noãn thúc đẩy sự phát triển nang noãn [6, 9], bên cạnh đó, một số protein được tiết bởi các tế bào granulosa như cKIT được chứng minh có sự tương tác với các thụ thể trên bề mặt noãn, thúc đẩy sự phát triển của noãn [18]. Những giai đoạn sớm trong suốt quá trình trao đổi tín hiệu và tương tác tế bào giữa noãn và tế bào granulosa trong sự phát triển nang noãn, trên các tế bào granulosa xuất hiện các liên kết dính, N – cadherin và nectin 2 nhưng không xuất hiện các liên kết chặt chẽ như loại liên kết giữa các tế bào granulosa dạng khối. Tuy nhiên, ở giai đoạn nang noãn tiền hốc và giai đoạn sớm của nang noãn có hốc, các tế bào granulosa tập hợp quanh noãn như một hợp bào chức năng, tương tác với noãn thông qua liên kết gap junction trong khi vẫn có sự tồn tại của liên kết dính nhưng các liên kết này không ngăn cản sự khuếch tán của các cơ chất qua khoảng không ngoại bào về phía noãn [15].
Trong suốt quá trình phát triển nang noãn, các TZP nhô ra từ đỉnh tế bào granulosa về phía noãn và kết thúc tại chất nền của màng trong suốt, do đó các TZP neo các tế bào granulosa vào vùng ngoại vi noãn. Sự hình thành cấu trúc này được điều hòa trong suốt quá trình phát triển nang noãn [16, 27]. Cấu trúc này đã được quan sát trên người [11]và sau đó là trên nhiều mô hình động vật như chuột [12], hamster [20], lợn [24]. Các TZP được chia thành hai loại dựa vào cấu trúc: các TZP cấu tạo bởi vi ống gồm các đơn phân tubulin mtTZP và các TZP cấu tạo bởi vi sợi actin actTZP. Những đơn phân actin và tubulin kéo dài thành sợi trong cấu trúc TZP không những đóng vai trò giúp ổn định cấu trúc TZP mà còn thúc đẩy quá trình vận chuyển các chất mang tương ứng. Trong giai đoạn sớm của sự phát triển nang noãn, một số TZP xuất hiện và kéo dài sâu hơn về phía noãn, hỗ trợ sự tương tác của noãn, vỏ noãn và các thành phần trong tế bào cũng như hỗ trợ cho sự trao đổi tín hiệu qua lại giữa noãn và tế bào granulosa. Các nghiên cứu trên chuột cho thấy từ giai đoạn nang noãn tiền hốc đến giai đoạn nang noãn có hốc, có sự tăng sinh về mật độ cũng như chiều dài của các actTZP [2, 25]. Nghiên cứu của Motta và cộng sự (1994) trên noãn người cho thấy các cấu trúc TZP này tiêu biến dần ở giai đoạn phóng noãn [16].
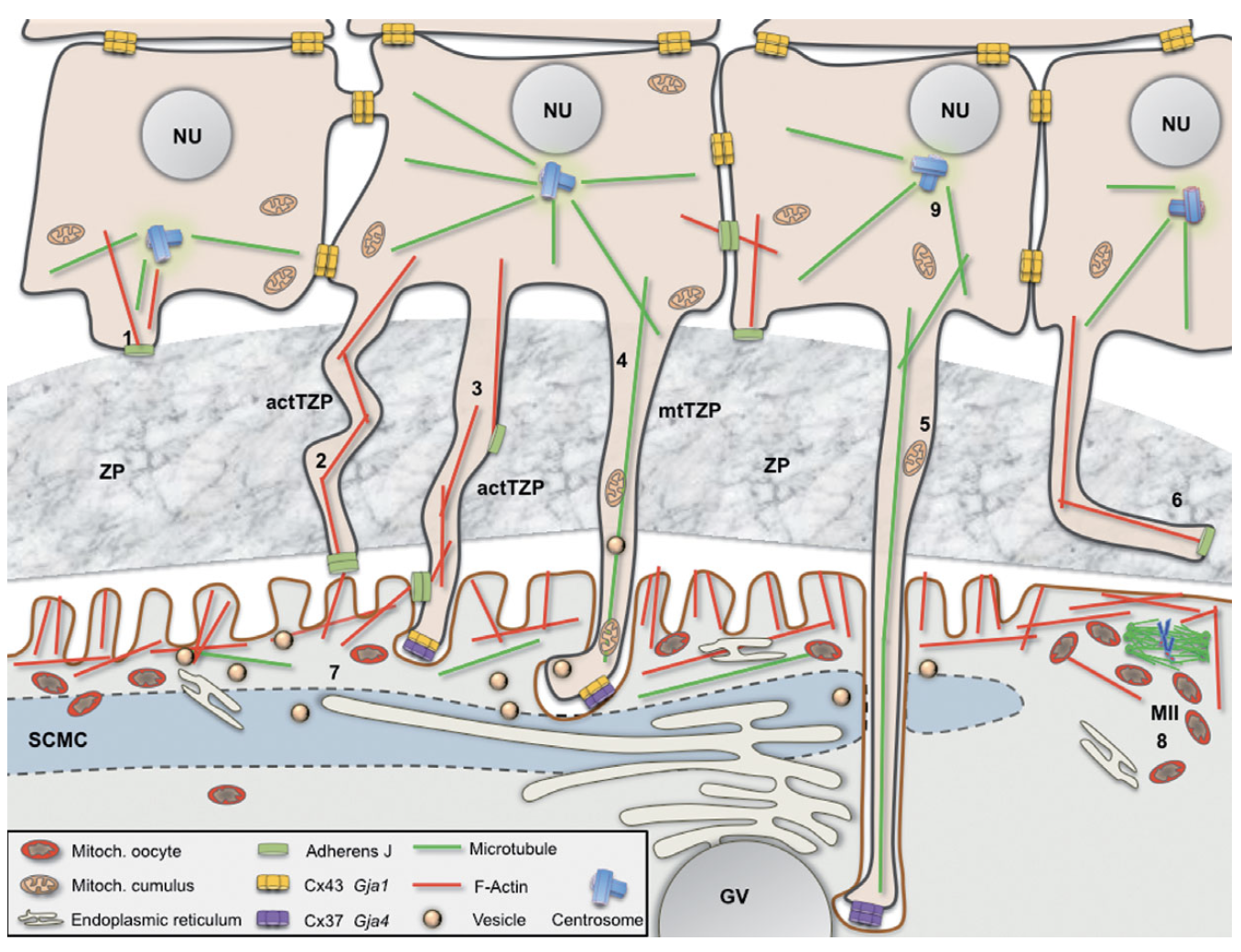
Hình 1. Các loại TZPs tương tác giữa noãn và tế bào nang noãn
Trong suốt quá trình phát triển nang noãn, các TZP nhô ra từ đỉnh tế bào granulosa về phía noãn và kết thúc tại chất nền của màng trong suốt, do đó các TZP neo các tế bào granulosa vào vùng ngoại vi noãn. Sự hình thành cấu trúc này được điều hòa trong suốt quá trình phát triển nang noãn [16, 27]. Cấu trúc này đã được quan sát trên người [11]và sau đó là trên nhiều mô hình động vật như chuột [12], hamster [20], lợn [24]. Các TZP được chia thành hai loại dựa vào cấu trúc: các TZP cấu tạo bởi vi ống gồm các đơn phân tubulin mtTZP và các TZP cấu tạo bởi vi sợi actin actTZP. Những đơn phân actin và tubulin kéo dài thành sợi trong cấu trúc TZP không những đóng vai trò giúp ổn định cấu trúc TZP mà còn thúc đẩy quá trình vận chuyển các chất mang tương ứng. Trong giai đoạn sớm của sự phát triển nang noãn, một số TZP xuất hiện và kéo dài sâu hơn về phía noãn, hỗ trợ sự tương tác của noãn, vỏ noãn và các thành phần trong tế bào cũng như hỗ trợ cho sự trao đổi tín hiệu qua lại giữa noãn và tế bào granulosa. Các nghiên cứu trên chuột cho thấy từ giai đoạn nang noãn tiền hốc đến giai đoạn nang noãn có hốc, có sự tăng sinh về mật độ cũng như chiều dài của các actTZP [2, 25]. Nghiên cứu của Motta và cộng sự (1994) trên noãn người cho thấy các cấu trúc TZP này tiêu biến dần ở giai đoạn phóng noãn [16].

Hình 1. Các loại TZPs tương tác giữa noãn và tế bào nang noãn
2. Các loại liên kết trên màng bào tương noãn
Liên kết gap junction
Liên kết gap junction là các kênh xuyên màng khác nhau về độ dẫn và đặc tính thẩm thấu, được cấu tạo bởi hai cấu trúc được gọi là các connexon kết nối với nhau từ hai phía đối diện trên màng bào tương của các tế bào kề cận. Mỗi connexon gồm một hexamer các phân tử Connexin (Cx), mỗi Cx gồm 4 domain xuyên màng với đầu C- và đuôi N- nằm trong bào tương, một cấu trúc dạng loop nằm trong bào tương và 2 cấu trúc dạng loop ở ngoại bào. Đầu C- của các Cx có thể tương tác với nhiều protein khác nhau và tham gia vào hình thành liên kết gap junction, vào các tương tác cũng như hình thành nên các cấu trúc dạng phiến của liên kết này trên màng tế bào hoặc tương tác với các thành phần có thể kiểm soát quá trình biểu hiện gene cũng như các con đường truyền tín hiệu. Liên kết gap junction cho phép sự thẩm thấu bị động một số ion cũng như phân tử kích thước nhỏ từ tế bào granulosa vào noãn như Na+, Cl- [1], cAMP [3, 22], cGMP [17], ribonucleoside, choline [10], amino acid [7], 2 – deoxyglucose [4]và inositol [14]. Những sự kiện được điều hòa bởi các tín hiệu cận tiết và tự tiết thông qua các liên kết gap junction phụ thuộc vào loại Cx và tế bào đặc hiệu và hoạt động đóng mở của các liên kết này cũng được điều hòa chặt chẽ, ví dụ Cx43 phụ thuộc vào nồng độ Ca2+ nội bào [21].
Tương tác giữa noãn và tế bào cumulus thông qua liên kết gap junction đóng vai trò quan trọng trong điều hòa cơ chế đóng xoắn NST và dịch mã trong suốt các giai đoạn sớm của sự trưởng thành noãn đã được chứng minh trong các thí nghiệm trên bò. Trong môi trường thí nghiệm làm bất hoạt liên kết gap junction bằng FSH, các NST đóng xoắn nhanh hơn và quá trình tổng hợp RNA ở các noãn này ngừng lại đột ngột [13].
Liên kết dính (adhesion junction)
Khi nói về các tương tác giữa noãn và tế bào granulosa, ngoài liên kết gap junction đã đề cập ở trên, chúng ta không thể không kể đến liên kết dính, một loại liên kết cấu tạo bởi những phân tử cấu trúc xuyên màng liên kết với các protein liên kết nhằm neo các phức hợp liên kết dính này vào khung xương tế bào. Thành phần chính của liên kết dính là cadherin và catenin. Cadherin được gắn kết vào các vi sợi actin trong khung xương tế bào bởi các αβ-catenin [5]. N-cadherin được chứng minh tồn tại ở noãn chuột tại giai đoạn nang noãn sơ cấp nhưng sau đó tiêu biến khi nang noãn ở giai đoạn tăng trưởng, N-cadherin thúc đẩy quá trình phân chia tế bào và các tương tác giữa các tế bào granulosa cũng như tương tác giữa tế bào granulosa và noãn [8, 19, 26]. Bên cạnh đó, sự biểu hiện một loại cadherin khác, E-cadherin đóng vai trò quan trọng đối với sự tăng trưởng của noãn, cần thiết cho tiềm năng trưởng thành của noãn. Tương tác giữa N-cadherin và E-cadherin có thể tham gia quá trình điều hòa cấu trúc khung xương tế bào và tín hiệu nội bào giữa noãn và tế bào granulosa, góp phần neo tế bào granulosa với màng trong suốt và với noãn ở những giai đoạn sớm của nang tiền hốc [23]. Điều đặc biệt là các E-cadherin không được biểu hiện ở các tế bào có dấu hiệu apoptosis, chứng tỏ rằng E-cadherin quan trọng trong duy trì sự sống của tế bào và ngăn cản quá trình apoptosis ở nang noãn tiền hốc [19, 23].
Liên kết gap junction là các kênh xuyên màng khác nhau về độ dẫn và đặc tính thẩm thấu, được cấu tạo bởi hai cấu trúc được gọi là các connexon kết nối với nhau từ hai phía đối diện trên màng bào tương của các tế bào kề cận. Mỗi connexon gồm một hexamer các phân tử Connexin (Cx), mỗi Cx gồm 4 domain xuyên màng với đầu C- và đuôi N- nằm trong bào tương, một cấu trúc dạng loop nằm trong bào tương và 2 cấu trúc dạng loop ở ngoại bào. Đầu C- của các Cx có thể tương tác với nhiều protein khác nhau và tham gia vào hình thành liên kết gap junction, vào các tương tác cũng như hình thành nên các cấu trúc dạng phiến của liên kết này trên màng tế bào hoặc tương tác với các thành phần có thể kiểm soát quá trình biểu hiện gene cũng như các con đường truyền tín hiệu. Liên kết gap junction cho phép sự thẩm thấu bị động một số ion cũng như phân tử kích thước nhỏ từ tế bào granulosa vào noãn như Na+, Cl- [1], cAMP [3, 22], cGMP [17], ribonucleoside, choline [10], amino acid [7], 2 – deoxyglucose [4]và inositol [14]. Những sự kiện được điều hòa bởi các tín hiệu cận tiết và tự tiết thông qua các liên kết gap junction phụ thuộc vào loại Cx và tế bào đặc hiệu và hoạt động đóng mở của các liên kết này cũng được điều hòa chặt chẽ, ví dụ Cx43 phụ thuộc vào nồng độ Ca2+ nội bào [21].
Tương tác giữa noãn và tế bào cumulus thông qua liên kết gap junction đóng vai trò quan trọng trong điều hòa cơ chế đóng xoắn NST và dịch mã trong suốt các giai đoạn sớm của sự trưởng thành noãn đã được chứng minh trong các thí nghiệm trên bò. Trong môi trường thí nghiệm làm bất hoạt liên kết gap junction bằng FSH, các NST đóng xoắn nhanh hơn và quá trình tổng hợp RNA ở các noãn này ngừng lại đột ngột [13].
Liên kết dính (adhesion junction)
Khi nói về các tương tác giữa noãn và tế bào granulosa, ngoài liên kết gap junction đã đề cập ở trên, chúng ta không thể không kể đến liên kết dính, một loại liên kết cấu tạo bởi những phân tử cấu trúc xuyên màng liên kết với các protein liên kết nhằm neo các phức hợp liên kết dính này vào khung xương tế bào. Thành phần chính của liên kết dính là cadherin và catenin. Cadherin được gắn kết vào các vi sợi actin trong khung xương tế bào bởi các αβ-catenin [5]. N-cadherin được chứng minh tồn tại ở noãn chuột tại giai đoạn nang noãn sơ cấp nhưng sau đó tiêu biến khi nang noãn ở giai đoạn tăng trưởng, N-cadherin thúc đẩy quá trình phân chia tế bào và các tương tác giữa các tế bào granulosa cũng như tương tác giữa tế bào granulosa và noãn [8, 19, 26]. Bên cạnh đó, sự biểu hiện một loại cadherin khác, E-cadherin đóng vai trò quan trọng đối với sự tăng trưởng của noãn, cần thiết cho tiềm năng trưởng thành của noãn. Tương tác giữa N-cadherin và E-cadherin có thể tham gia quá trình điều hòa cấu trúc khung xương tế bào và tín hiệu nội bào giữa noãn và tế bào granulosa, góp phần neo tế bào granulosa với màng trong suốt và với noãn ở những giai đoạn sớm của nang tiền hốc [23]. Điều đặc biệt là các E-cadherin không được biểu hiện ở các tế bào có dấu hiệu apoptosis, chứng tỏ rằng E-cadherin quan trọng trong duy trì sự sống của tế bào và ngăn cản quá trình apoptosis ở nang noãn tiền hốc [19, 23].
3. Kết luận
Các liên kết giữa noãn và các tế bào sinh dưỡng có nguồn gốc từ nang noãn là thực sự cần thiết cho các quá trình biến dưỡng của noãn và nang noãn trong suốt sự phát triển của noãn và nang noãn. Thành phần đóng vai trò quan trọng nhất trong tương tác này chính là các TZP, qua đó hình thành hai loại liên kết chính là liên kết gap junction và liên kết dính. Mỗi loại liên kết lại được cấu tạo bởi các protein khác nhau, nhằm trao đổi các phân tử đích khác nhau giữa noãn và các tế bào sinh dưỡng của nang noãn giúp đồng bộ hoá sự phát triển của noãn và các tế bào sinh dưỡng của nang noãn, hỗ trợ tối ưu cho tiềm năng phát triển của noãn sau phóng noãn.
TÀI LIỆU THAM KHẢO
1. Arellano, R.O., A. Martinez-Torres, and E. Garay, Ionic currents activated via purinergic receptors in the cumulus cell-enclosed mouse oocyte. Biol Reprod, 2002. 67(3): p. 837-46.
2. Barrett, S.L., L.D. Shea, and T.K. Woodruff, Noninvasive index of cryorecovery and growth potential for human follicles in vitro. Biol Reprod, 2010. 82(6): p. 1180-9.
3. Bornslaeger, E.A. and R.M. Schultz, Regulation of mouse oocyte maturation: effect of elevating cumulus cell cAMP on oocyte cAMP levels. Biol Reprod, 1985. 33(3): p. 698-704.
4. Brower, P.T. and R.M. Schultz, Intercellular communication between granulosa cells and mouse oocytes: existence and possible nutritional role during oocyte growth. Dev Biol, 1982. 90(1): p. 144-53.
5. Dean, D.M. and J.R. Morgan, Cytoskeletal-mediated tension modulates the directed self-assembly of microtissues. Tissue Eng Part A, 2008. 14(12): p. 1989-97.
6. Dong, J., et al., Growth differentiation factor-9 is required during early ovarian folliculogenesis. Nature, 1996. 383(6600): p. 531-5.
7. Eppig, J.J., et al., Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod, 2005. 73(2): p. 351-7.
8. Farookhi, R., et al., Hormonal regulation of N-cadherin mRNA levels in rat granulosa cells. Ann N Y Acad Sci, 1997. 816: p. 165-72.
9. Galloway, S.M., et al., Mutations in an oocyte-derived growth factor gene (BMP15) cause increased ovulation rate and infertility in a dosage-sensitive manner. Nat Genet, 2000. 25(3): p. 279-83.
10. Heller, D.T., D.M. Cahill, and R.M. Schultz, Biochemical studies of mammalian oogenesis: metabolic cooperativity between granulosa cells and growing mouse oocytes. Dev Biol, 1981. 84(2): p. 455-64.
11. Hertig, A.T. and E.C. Adams, Studies on the human oocyte and its follicle. I. Ultrastructural and histochemical observations on the primordial follicle stage. J Cell Biol, 1967. 34(2): p. 647-75.
12. Larsen, W.J., S.E. Wert, and G.D. Brunner, Differential modulation of rat follicle cell gap junction populations at ovulation. Dev Biol, 1987. 122(1): p. 61-71.
13. Luciano, A.M., et al., Gap junction-mediated communications regulate chromatin remodeling during bovine oocyte growth and differentiation through cAMP-dependent mechanism(s). Biol Reprod, 2011. 85(6): p. 1252-9.
14. Moor, R.M., M.W. Smith, and R.M. Dawson, Measurement of intercellular coupling between oocytes and cumulus cells using intracellular markers. Exp Cell Res, 1980. 126(1): p. 15-29.
15. Mora, J.M., et al., Characterization and significance of adhesion and junction-related proteins in mouse ovarian follicles. Biol Reprod, 2012. 86(5): p. 153, 1-14.
16. Motta, P.M., et al., Oocyte follicle cells association during development of human ovarian follicle. A study by high resolution scanning and transmission electron microscopy. Arch Histol Cytol, 1994. 57(4): p. 369-94.
17. Norris, R.P., et al., Cyclic GMP from the surrounding somatic cells regulates cyclic AMP and meiosis in the mouse oocyte. Development, 2009. 136(11): p. 1869-78.
18. Packer, A.I., et al., The ligand of the c-kit receptor promotes oocyte growth. Dev Biol, 1994. 161(1): p. 194-205.
19. Peluso, J.J., A. Pappalardo, and M.P. Trolice, N-cadherin-mediated cell contact inhibits granulosa cell apoptosis in a progesterone-independent manner. Endocrinology, 1996. 137(4): p. 1196-203.
20. Plancha, C.E. and D.F. Albertini, Hormonal regulation of meiotic maturation in the hamster oocyte involves a cytoskeleton-mediated process. Biol Reprod, 1994. 51(5): p. 852-64.
21. Ponsaerts, R., et al., The contractile system as a negative regulator of the connexin 43 hemichannel. Biol Cell, 2012. 104(7): p. 367-77.
22. Salustri, A., et al., Effect of follicle-stimulating hormone on cyclic adenosine monophosphate level and on meiotic maturation in mouse cumulus cell-enclosed oocytes cultured in vitro. Biol Reprod, 1985. 33(4): p. 797-802.
23. Sundfeldt, K., et al., E-cadherin-catenin complex in the rat ovary: cell-specific expression during folliculogenesis and luteal formation. J Reprod Fertil, 2000. 118(2): p. 375-85.
24. Suzuki, H., B.S. Jeong, and X. Yang, Dynamic changes of cumulus-oocyte cell communication during in vitro maturation of porcine oocytes. Biol Reprod, 2000. 63(3): p. 723-9.
25. Trapphoff, T., et al., DNA integrity, growth pattern, spindle formation, chromosomal constitution and imprinting patterns of mouse oocytes from vitrified pre-antral follicles. Hum Reprod, 2010. 25(12): p. 3025-42.
26. Trolice, M.P., A. Pappalardo, and J.J. Peluso, Basic fibroblast growth factor and N-cadherin maintain rat granulosa cell and ovarian surface epithelial cell viability by stimulating the tyrosine phosphorylation of the fibroblast growth factor receptors. Endocrinology, 1997. 138(1): p. 107-13.
27. Zuccotti, M., et al., What does it take to make a developmentally competent mammalian egg? Hum Reprod Update, 2011. 17(4): p. 525-40.
TÀI LIỆU THAM KHẢO
1. Arellano, R.O., A. Martinez-Torres, and E. Garay, Ionic currents activated via purinergic receptors in the cumulus cell-enclosed mouse oocyte. Biol Reprod, 2002. 67(3): p. 837-46.
2. Barrett, S.L., L.D. Shea, and T.K. Woodruff, Noninvasive index of cryorecovery and growth potential for human follicles in vitro. Biol Reprod, 2010. 82(6): p. 1180-9.
3. Bornslaeger, E.A. and R.M. Schultz, Regulation of mouse oocyte maturation: effect of elevating cumulus cell cAMP on oocyte cAMP levels. Biol Reprod, 1985. 33(3): p. 698-704.
4. Brower, P.T. and R.M. Schultz, Intercellular communication between granulosa cells and mouse oocytes: existence and possible nutritional role during oocyte growth. Dev Biol, 1982. 90(1): p. 144-53.
5. Dean, D.M. and J.R. Morgan, Cytoskeletal-mediated tension modulates the directed self-assembly of microtissues. Tissue Eng Part A, 2008. 14(12): p. 1989-97.
6. Dong, J., et al., Growth differentiation factor-9 is required during early ovarian folliculogenesis. Nature, 1996. 383(6600): p. 531-5.
7. Eppig, J.J., et al., Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biol Reprod, 2005. 73(2): p. 351-7.
8. Farookhi, R., et al., Hormonal regulation of N-cadherin mRNA levels in rat granulosa cells. Ann N Y Acad Sci, 1997. 816: p. 165-72.
9. Galloway, S.M., et al., Mutations in an oocyte-derived growth factor gene (BMP15) cause increased ovulation rate and infertility in a dosage-sensitive manner. Nat Genet, 2000. 25(3): p. 279-83.
10. Heller, D.T., D.M. Cahill, and R.M. Schultz, Biochemical studies of mammalian oogenesis: metabolic cooperativity between granulosa cells and growing mouse oocytes. Dev Biol, 1981. 84(2): p. 455-64.
11. Hertig, A.T. and E.C. Adams, Studies on the human oocyte and its follicle. I. Ultrastructural and histochemical observations on the primordial follicle stage. J Cell Biol, 1967. 34(2): p. 647-75.
12. Larsen, W.J., S.E. Wert, and G.D. Brunner, Differential modulation of rat follicle cell gap junction populations at ovulation. Dev Biol, 1987. 122(1): p. 61-71.
13. Luciano, A.M., et al., Gap junction-mediated communications regulate chromatin remodeling during bovine oocyte growth and differentiation through cAMP-dependent mechanism(s). Biol Reprod, 2011. 85(6): p. 1252-9.
14. Moor, R.M., M.W. Smith, and R.M. Dawson, Measurement of intercellular coupling between oocytes and cumulus cells using intracellular markers. Exp Cell Res, 1980. 126(1): p. 15-29.
15. Mora, J.M., et al., Characterization and significance of adhesion and junction-related proteins in mouse ovarian follicles. Biol Reprod, 2012. 86(5): p. 153, 1-14.
16. Motta, P.M., et al., Oocyte follicle cells association during development of human ovarian follicle. A study by high resolution scanning and transmission electron microscopy. Arch Histol Cytol, 1994. 57(4): p. 369-94.
17. Norris, R.P., et al., Cyclic GMP from the surrounding somatic cells regulates cyclic AMP and meiosis in the mouse oocyte. Development, 2009. 136(11): p. 1869-78.
18. Packer, A.I., et al., The ligand of the c-kit receptor promotes oocyte growth. Dev Biol, 1994. 161(1): p. 194-205.
19. Peluso, J.J., A. Pappalardo, and M.P. Trolice, N-cadherin-mediated cell contact inhibits granulosa cell apoptosis in a progesterone-independent manner. Endocrinology, 1996. 137(4): p. 1196-203.
20. Plancha, C.E. and D.F. Albertini, Hormonal regulation of meiotic maturation in the hamster oocyte involves a cytoskeleton-mediated process. Biol Reprod, 1994. 51(5): p. 852-64.
21. Ponsaerts, R., et al., The contractile system as a negative regulator of the connexin 43 hemichannel. Biol Cell, 2012. 104(7): p. 367-77.
22. Salustri, A., et al., Effect of follicle-stimulating hormone on cyclic adenosine monophosphate level and on meiotic maturation in mouse cumulus cell-enclosed oocytes cultured in vitro. Biol Reprod, 1985. 33(4): p. 797-802.
23. Sundfeldt, K., et al., E-cadherin-catenin complex in the rat ovary: cell-specific expression during folliculogenesis and luteal formation. J Reprod Fertil, 2000. 118(2): p. 375-85.
24. Suzuki, H., B.S. Jeong, and X. Yang, Dynamic changes of cumulus-oocyte cell communication during in vitro maturation of porcine oocytes. Biol Reprod, 2000. 63(3): p. 723-9.
25. Trapphoff, T., et al., DNA integrity, growth pattern, spindle formation, chromosomal constitution and imprinting patterns of mouse oocytes from vitrified pre-antral follicles. Hum Reprod, 2010. 25(12): p. 3025-42.
26. Trolice, M.P., A. Pappalardo, and J.J. Peluso, Basic fibroblast growth factor and N-cadherin maintain rat granulosa cell and ovarian surface epithelial cell viability by stimulating the tyrosine phosphorylation of the fibroblast growth factor receptors. Endocrinology, 1997. 138(1): p. 107-13.
27. Zuccotti, M., et al., What does it take to make a developmentally competent mammalian egg? Hum Reprod Update, 2011. 17(4): p. 525-40.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








