Tin chuyên ngành
on Monday 23-12-2024 4:31am
Danh mục: Vô sinh & hỗ trợ sinh sản
BS. Phan Thị Thanh Thảo
Đơn vị hỗ trợ sinh sản IVFMD-BMT, Bệnh viện Đại học Y Dược Buôn Ma Thuột
Thất bại làm tổ nhiều lần (RIF, Recurrent implantation failure) hiện tại vẫn đang là thách thức lớn trong hỗ trợ sinh sản. Hai phần ba trường hợp RIF do không có sự tiếp nhận của nội mạc tử cung (NMTC), một phần ba còn lại liên quan đến chất lượng phôi chuyển. Do đó cải thiện chất lượng phôi chuyển cùng với việc tối ưu hoá tính tiếp nhận NMTC có vai trò đặc biệt quan trọng trong sự thành công của một chu kỳ chuyển phôi nói riêng, và của ngành hỗ trợ sinh sản nói chung.
Cửa sổ làm tổ là một khoảng thời gian NMTC có tính tiếp nhận cao nhất đối với phôi, đón nhận phôi làm tổ. Trên lâm sàng, quá trình chuẩn bị cửa sổ làm tổ sẽ tập trung vào việc kiểm soát sự xuất hiện tuần tự hai loại nội tiết tố steroids là estradiol và progesterone. Tuy nhiên, các hiểu biết hiện tại cho thấy cửa sổ làm tổ là hiện tượng sinh học phức tạp, liên quan mật thiết đến các yếu tố điều hoà miễn dịch nội tại như cytokines, tế bào diệt tự nhiên – (NK cells), yếu tố tăng trưởng – growth factors và phân tử kết dính. Do đó, nhiều biện pháp điều trị bổ trợ đã và đang được tích cực nghiên cứu nhằm tối ưu hóa cửa sổ làm tổ như chất giãn mạch (sildrenafil, nitroglycerine), chất chống kết tập tiểu cầu (aspirin), chất chống đông máu (heparin trọng lượng phân tử thấp – low molecular weight heparin), yếu tố kích thích dòng bạch cầu hạt (granulocyte colony-stimulating factors), immunoglobulin truyền tĩnh mạch, glucocorticoids (prednisolone), chất ức chế sự co bóp tử cung (atosiban), và một số phương pháp khác. Dù với nỗ lực rất lớn, từ lý thuyết đến ứng dụng thực tiễn các biện pháp này chưa thống nhất và hiệu quả chưa rõ ràng.
Bài viết dưới đây tập trung phân tích cơ chế nền tảng và bàn luận về hiệu quả, tính ứng dụng, và hướng nghiên cứu trong tương lai của một số biện pháp thường gặp bao gồm aspirin, heparin trọng lượng phân tử thấp, intralipid, atosiban và prednisolone.
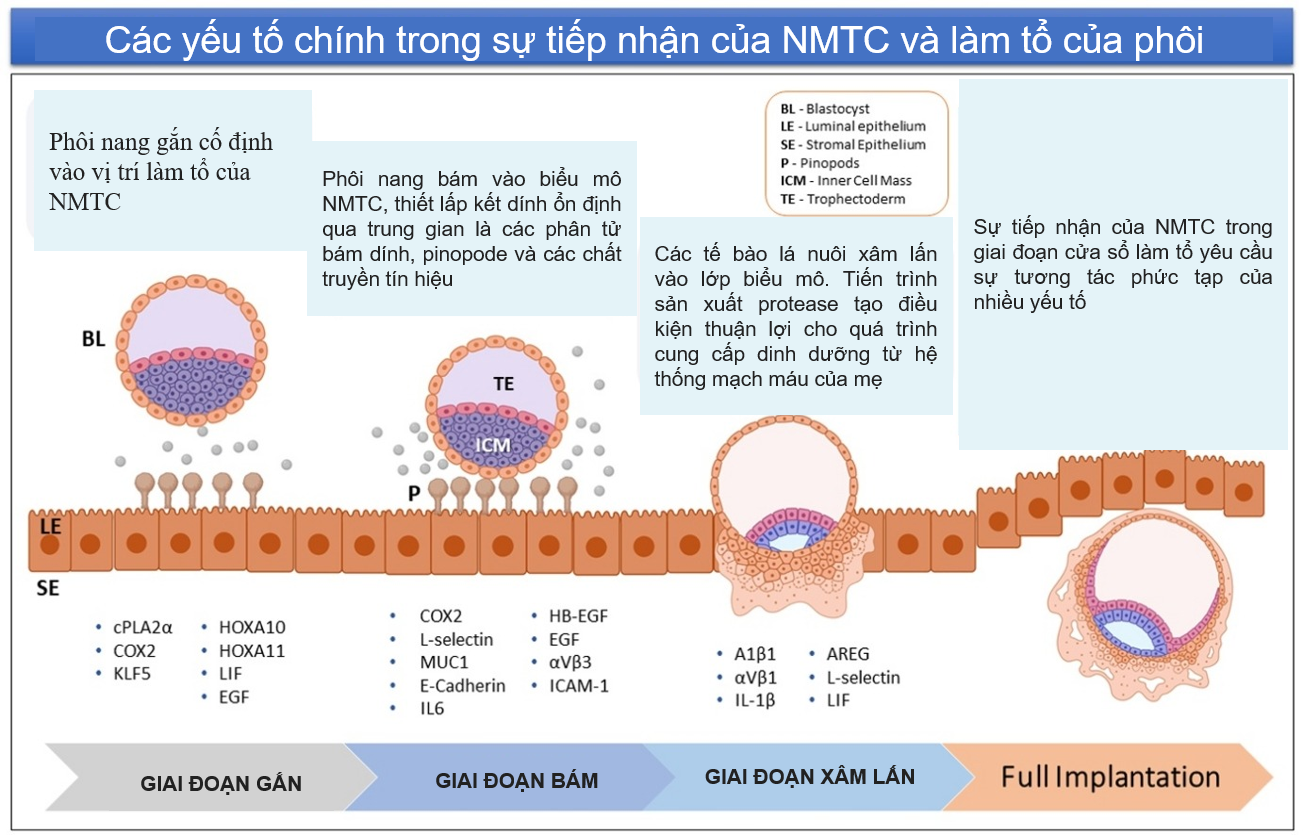
Hình 1: Quá trình làm tổ của phôi (Governini và cs.,2021
Phản ứng miễn dịch đóng vai trò quan trọng trong quá trình phôi làm tổ, giúp cơ thể người mẹ chấp nhận phôi bán dị ghép (2). Một số cytokine và các thụ thể của chúng được biểu hiện ở diện tiếp xúc giữa mẹ và phôi có chức năng điều hòa sự bám thai. Trong thai kỳ, có sự chuyển đổi từ sản xuất cytokine Th1 sang Th2, vì các cytokine 1 (IFN-g và TNF-a) có hại cho thai kỳ do ức chế quá trình làm tổ (3). Sẩy thai tái phát không rõ nguyên nhân có thể do sự mất cân bằng giữa hệ thống Th1/Th2. Nếu tăng sản xuất các cytokine Th1 gây độc tế bào (interleukin 2, TNFα), thay vì các cytokine Th2 (interleukin 4, 6 và 10) có vai trò ức chế miễn dịch, dẫn đến hiện tượng đào thải phôi bán dị ghép. Tế bào NK (Natural kill) trong tử cung chiếm khoảng 70% số lượng bạch cầu ở màng rụng và có khả năng tham gia vào quá trình hình thành nhau thai, tăng rõ rệt trong thời kỳ đầu mang thai. Để thoát khỏi sự ly giải bởi các tế bào uNK, các tế bào lá nuôi biểu hiện các kháng nguyên MHC Ib, HLA-E và HLA-G. Các thụ thể KillerIglike ức chế (KIR) tương tác với HLA-C của phôi trong những tuần đầu của thai kỳ và ngăn chặn sự ly giải của nguyên bào lá nuôi (4). Nguyên bào lá nuôi xâm nhập vào màng rụng để bao quanh và phá hủy lớp giữa của các động mạch xoắn, biến chúng thành các mạch máu có độ dẫn lưu cao. Vai trò của tế bào uNK trong việc làm tổ và tạo nhau thai được đề xuất bởi những phát hiện cho thấy hoạt động NK cao trước khi thụ thai có liên quan đến tỷ lệ sẩy thai và hiếm muộn hơn đáng kể (5). Để cải thiện khả năng làm tổ của NMTC, cần điều chỉnh các vấn đề tiềm ẩn có thể góp phần gây ra thất bại của quá trình làm tổ. Tuy nhiên, do các quá trình bệnh lý chưa được hiểu rõ nên một số phương pháp điều trị theo kinh nghiệm đã được thử nghiệm với tỷ lệ thành công hạn chế.
Nhiều phân tử khác đã được phát hiện có vai trò quan trọng trong quá trình phôi làm tổ. Những dấu ấn này bao gồm prostaglandin và cyclooxygenase, glycoprotein MUC-1, kinase huyết thanh và glucocorticoid cảm ứng, yếu tố tăng trưởng nhau thai... Tuy nhiên không có một dấu ấn sinh học phân tử đơn lẻ nào có thể xác định khả năng tiếp nhận của tử cung. Quá trình làm tổ là một chuỗi các sự kiện diễn ra liên tục, khả năng tiếp nhận của tử cung có thể được xác định rõ hơn bằng sự kết hợp của các dấu hiệu chính xảy ra trong một khoảng thời gian cửa sổ làm tổ (6).
Aspirin
Các nghiên cứu in vitro cho thấy heparin và aspirin làm giảm quá trình apotosis của nhau thai, cùng với chi phí thấp, dễ tiếp cận và ít tác dụng phụ đã phổ biến việc sử dụng aspirin liều thấp trong các chu kỳ điều trị TTTON. Axit acetylsalicylic liều thấp (aspirin) ức chế enzyme cyclo-oxygenase trong tiểu cầu, do đó ngăn chặn sự tổng hợp thromboxane gây co mạch và kết tập tiểu cầu, ức chế tác dụng tiêu cực của prostaglandin đối với quá trình làm tổ như gây ra các cơn co tử cung hoặc phản ứng viêm. Theo cơ chế này, aspirin liều thấp có thể tăng cường lưu lượng máu tử cung và tưới máu mô, do đó cải thiện khả năng tiếp nhận của NMTC đối với việc làm tổ. Aspirin có thể cải thiện tỷ lệ mang thai ở bệnh nhân có tự kháng thể/huyết thanh dương tính trong các trường hợp RIF (7). Tuy nhiên tổng quan của Cochrane năm 2011 kết luận rằng không có lợi ích khi sử dụng aspirin thường quy trong các chu kỳ TTTON (8).
Heparin và heparin trọng lượng phân tử thấp
Nhiều nghiên cứu đã báo cáo các tình trạng rối loạn đông máu bẩm sinh hoặc mắc phải được ghi nhận ở các trường hợp RIF(9). Điều này dẫn đến việc sử dụng thuốc chống đông máu, chủ yếu là heparin, trong quá trình điều trị hiếm muộn ở phụ nữ có kháng thể kháng phospholipid (10). Heparin là một polysaccharide polydisperse, với tính anion cao, heparin có thể liên kết với rất nhiều protein bao gồm chất chống đông, các yếu tố tăng trưởng, thụ thể của yếu tố tăng trưởng và các phân tử lưới ngoại bào. Những thay đổi về đông máu và tiêu sợi huyết quan sát thấy trong quá trình kích thích buồng trứng cũng tương tự như những thay đổi quan sát được trong thai kỳ dẫn đến những rối loạn đông máu do nồng độ estradiol tăng cao vượt ngưỡng sinh lý khi kích thích buồng trứng. Điều này cho thấy cơ chế đông cầm máu có vai trò quan trọng trong quá trình làm tổ. Ngoài tác dụng chống đông máu, heparin còn có vai trò trong quá trình phôi làm tổ, thông qua tương tác với một số phân tử bám dính, yếu tố tăng trưởng, cytokine và enzyme như lưới nội bào metallicoproteinase (MMP). Heparin cũng điều hòa nhiều quá trình sinh lý cơ bản cần thiết cho sự gắn kết, bám dính và xâm lấn của phôi nang qua quá trình tăng cường sự biệt hóa và xâm lấn của nguyên bào nuôi, có khả năng cải thiện tỷ lệ mang thai trong TTTON (11).
Heparin trọng lượng phân tử thấp (LMWH) cũng được cho rằng có tác dụng có lợi đối với quá trình làm tổ. LMWH làm tăng cường khả năng liên kết sHB-EGF và điều hòa tăng mức sHB-EGF thông qua tăng hoạt động MMP. Interleukin -1 (IL-1) làm tăng biểu hiện integrin β3 của tế bào biểu mô NMTC với sự cải thiện độ bám dính của phôi nang (12). LMWH được báo cáo là làm tăng biểu hiện IL-1 trong bạch cầu được kích hoạt. Do LMWH làm tăng yếu tố tăng trưởng giống insulin tự do, dẫn đến tăng cường sự di chuyển và xâm lấn của nguyên bào nuôi (13). Tuy nhiên việc sử dụng heparin và LMWH ở bệnh nhân RIF còn nhiều tranh cãi. Kết quả tổng quan của Cochrane về ba thử nghiệm ngẫu nhiên có đối chứng với tổng số 386 phụ nữ cho thấy LMWH có thể cải thiện tỷ lệ sinh sống. Tuy nhiên, quy mô của các nghiên cứu nhỏ, chất lượng thấp, có tính không đồng nhất đáng kể và còn phụ thuộc vào việc lựa chọn mô hình thống kê (14). Hơn nữa, có những tác dụng phụ được báo cáo khi sử dụng heparin bao gồm loãng xương, xuất huyết,... không có dữ liệu đáng tin cậy về tác dụng lâu dài. Cuối cùng, một nghiên cứu đoàn hệ hồi cứu, đa trung tâm, quy mô lớn gần đây cho thấy việc sử dụng LMWH không mang lại lợi ích ở những phụ nữ thất bại chuyển phôi từ hai chu kỳ trở lên (15).
Intralipid
Intralipid là một chất béo nhũ tương, tuy cơ chế miễn dịch của intralipid chưa được xác định đầy đủ, nhưng một số nghiên cứu cho thấy đặc tính ức chế miễn dịch, ức chế hoạt động gây độc tế bào NK và sản xuất các cytokine gây viêm như yếu tố hoại tử khối u-alpha, interleukin-6 và interleukin-8. Nhiều nghiên cứu cho thấy intralipid ảnh hưởng đến tế bào NK thông qua các thụ thể như thụ thể kết hợp protein G và thụ thể kích hoạt tăng sinh peroxisome (PPAR). Các axit béo trong intralipid và các chất chuyển hóa hoạt động như các phối tử kích hoạt PPAR được biểu hiện trong tế bào NK. Kích hoạt PPAR làm giảm độc tính tế bào của NK và do đó tăng cường khả năng làm tổ và duy trì thai kỳ. PPAR cũng đóng một vai trò quan trọng trong việc làm tổ, xâm lấn tế bào lá nuôi, phát triển phôi và hình thành nhau thai (16).
Một RCT nghiên cứu tác động của Intralipid đối với kết quả mang thai ở những phụ nữ RIF cho thấy lợi ích của liệu pháp Intralipid với tỷ số chênh được điều chỉnh là 3,1 đối với các trường hợp mang thai lâm sàng ở nhóm điều trị (17). Tuy nhiên, trong phân tích dưới nhóm, tác dụng có lợi chỉ thấy ở những bệnh nhân đã thất bại chuyển phôi trước đó. Tiềm năng sử dụng liệu pháp Intralipid như một chiến lược điều trị hợp lý về mặt kinh tế để cải thiện kết cục thai kỳ, nhưng chưa có bộ dữ liệu đáng tin cậy để đưa ra khuyến cáo cụ thể. Mặc dù vậy Intralipid thường được các bác sĩ lâm sàng coi là phương pháp điều trị an toàn và dễ dàng tiếp cận.

Hình 2: Một số cơ chế trong điều hòa miễn dịch chọn lọc ở NMTC (G Genest và cs., 2023)
Atosiban
Hoạt động co thắt của tử cung có thể ảnh hưởng xấu đến việc làm tổ. Các cơn co thắt tăng lên được thấy ở khoảng 30% bệnh nhân được chuyển phôi. Các thuốc chống co thắt tử cung có thể cải thiện tỷ lệ mang thai; tuy nhiên các thuốc nhắm mô đích vào thụ thể adrenergic tử cung, kênh canxi hoặc tổng hợp prostaglandin không có hiệu quả. Thuốc atosiban đối kháng oxytocin đang được sử dụng như thuốc chống co thắt để trì hoãn chuyển dạ sớm bằng cách ức chế các cơn co thắt của tử cung. Atosiban cũng được sử dụng tại thời điểm chuyển phôi cho những phụ nữ RIF tái phát nhắm làm giảm số cơn co tử cung sau chuyển phôi và tăng tỷ lệ làm tổ (18). Tác dụng có lợi của atosiban không chỉ được quan sát thấy ở những bệnh nhân có tần suất co bóp tử cung cao mà còn ở những bệnh nhân có tần suất co bóp thấp. Những phát hiện này cho thấy atosiban có thể có những lợi ích khác và có hiệu quả trong việc tạo điều kiện cho tử cung làm tổ, ngoài tác dụng lên các cơn co thắt của tử cung (19). Tỷ lệ làm tổ cao hơn đáng kể ở những người nhóm truyền atosiban trước chuyển phôi so với nhóm truyền atosiban ngay sau chuyển phôi (20). Cần có nhiều nghiên cứu hơn để tìm hiểu chính xác cách thức hoạt động và đánh giá vai trò của của atosiban ở những bệnh nhân RIF trong TTTON.
Glucocorticoid
Có giả thuyết cho rằng việc ức chế miễn dịch bằng glucorticoid như một phương pháp điều trị đồng thời hỗ trợ giai đoạn hoàng thể có thể được sử dụng để cải thiện tỷ lệ làm tổ của phôi và thai lâm sàng. Một số nghiên cứu báo cáo rằng liệu pháp glucocorticoid trong giai đoạn làm tổ đã cải thiện tỷ lệ sau thụ tinh ống nghiệm ở những phụ nữ có kháng thể kháng nhân, kháng thể kháng cardiolipin, kháng thể kháng giáp, hoặc kháng đông lupus. Tuy nhiên, các nghiên cứu khác cho rằng liệu pháp glucocorticoid không có thêm lợi ích trong quá trình làm tổ hay cải thiện tỷ lệ thai bất kể liều lượng có ý nghĩa thống kê. Một số nghiên cứu trên động vật ghi nhận việc tiếp xúc với glucocorticoid gây ra sự chậm phát triển của thai nhi, rối loạn tim mạch, chuyển hóa và thần kinh- nội tiết, và có thể gây quái thai. Một số nghiên cứu hạn chế trên người ghi nhận sử dụng glucocorticoid kéo dài trong tam cá nguyệt 1 có thể tăng nguy cơ sẩy thai, sinh non, tăng huyết áp và đái tháo đường thai kỳ. Mặc dù glucocorticoid không có nguy cơ gây các dị tật lớn ở người, nhưng các nghiên cứu đã nhận thấy mối quan hệ nhân quả có thể có giữa tật sứt môi, hở hàm ếch với việc sử dụng corticosteroid quanh giai đoạn phôi làm tổ. Vì vậy, cần cân nhắc giữa lợi ích và nguy cơ của liệu pháp glucocorticoid trong các chu kỳ thụ tinh trong ống nghiệm, có khả năng ảnh hưởng đến thời kỳ đầu mang thai.
Kết luận
Khả năng tiếp nhận của NMTC trong cửa sổ làm tổ đòi hỏi sự tương tác phức tạp của nhiều yếu tố. Bằng cách nghiên cứu các cơ chế điều hòa quá trình làm tổ nhờ các kỹ thuật y học phân tử mới nhất, trong tương lai sẽ có thể xác định được những trở ngại chưa biết của quá trình làm tổ và tiên lượng kết quả thử thai dương tính. Những phát hiện này có ý nghĩa thay đổi thực hành đối với hàng triệu bệnh nhân RIF trên toàn thế giới. Hiệp hội Sinh sản và Nam giới Canada và Hiệp hội Sinh sản Anh liên tiếp công bố các hướng dẫn về quản lý RIF vào năm 2020 và 2021, cả hai đều kết luận rằng các liệu pháp miễn dịch, bao gồm cả corticosteroid, phần lớn vẫn mang tính thực nghiệm đối với RIF và cần có thêm dữ liệu để đưa ra khuyến cáo có độ tin cậy cao. Các phương pháp bổ trợ như prednisolone, aspirin là không hiệu quả và không cần thiết, bên cạnh corticosteroid, các liệu pháp miễn dịch bổ trợ khác như intralipid hay heparin, heparin trọng lượng phân tử thấp cũng đã được điều trị cho bệnh nhân trong khi bằng chứng lâm sàng vẫn chưa đầy đủ. Do đó cần cá thể hóa các liệu pháp bổ trợ cho mỗi bệnh nhân nhằm hạn chế tốn kém và rủi ro tiềm ẩn, khi lợi ích chưa được rõ ràng. Các nghiên cứu trong tương lai hy vọng sẽ tập trung vào việc xác định rõ hơn về cơ chế cũng như căn nguyên RIF để tối ưu hóa khả năng làm tổ của phôi và nội mạc tử cung.
Tài liệu tham khảo chính
1. Governini L, Luongo FP, Haxhiu A, Piomboni P, Luddi A. Main actors behind the endometrial receptivity and successful implantation. Tissue Cell. 2021 Dec 1;73:101656.
2. Clark DA, Arck PC, Chaouat G. Why did your mother reject you? Immunogenetic determinants of the response to environmental selective pressure expressed at the uterine level. Am J Reprod Immunol N Y N 1989. 1999 Jan;41(1):5–22.
3. Chaouat G, Menu E, Clark DA, Dy M, Minkowski M, Wegmann TG. Control of fetal survival in CBA x DBA/2 mice by lymphokine therapy. J Reprod Fertil. 1990 Jul;89(2):447–58.
4. Verma S, King A, Loke YW. Expression of killer cell inhibitory receptors on human uterine natural killer cells. Eur J Immunol. 1997 Apr;27(4):979–83.
5. Aoki K, Kajiura S, Matsumoto Y, Ogasawara M, Okada S, Yagami Y, et al. Preconceptional natural-killer-cell activity as a predictor of miscarriage. Lancet Lond Engl. 1995 May 27;345(8961):1340–2.
6. Teh WT, McBain J, Rogers P. What is the contribution of embryo-endometrial asynchrony to implantation failure? J Assist Reprod Genet. 2016 Nov;33(11):1419–30.
7. Geva E, Amit A, Lerner-Geva L, Yaron Y, Daniel Y, Schwartz T, et al. Prednisone and aspirin improve pregnancy rate in patients with reproductive failure and autoimmune antibodies: a prospective study. Am J Reprod Immunol N Y N 1989. 2000 Jan;43(1):36–40.
8. Hurst BS, Bhojwani JT, Marshburn PB, Papadakis MA, Loeb TA, Matthews ML. Low-dose aspirin does not improve ovarian stimulation, endometrial response, or pregnancy rates for in vitro fertilization. J Exp Clin Assist Reprod. 2005 May 31;2:8.
9. Stern C, Chamley L, Norris H, Hale L, Baker HWG. A randomized, double-blind, placebo-controlled trial of heparin and aspirin for women with in vitro fertilization implantation failure and antiphospholipid or antinuclear antibodies. Fertil Steril. 2003 Aug;80(2):376–83.
10. Stern C, Chamley L. Antiphospholipid antibodies and coagulation defects in women with implantation failure after IVF and recurrent miscarriage. Reprod Biomed Online. 2006 Jul;13(1):29–37.
11. Nelson SM, Greer IA. The potential role of heparin in assisted conception. Hum Reprod Update. 2008;14(6):623–45.
12. Simón C, Gimeno MJ, Mercader A, O’Connor JE, Remohí J, Polan ML, et al. Embryonic regulation of integrins beta 3, alpha 4, and alpha 1 in human endometrial epithelial cells in vitro. J Clin Endocrinol Metab. 1997 Aug;82(8):2607–16.
13. Heparin and low-molecular-weight heparins modulate the decidualization of human endometrial stromal cells - PubMed [Internet]. [cited 2024 Jan 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/19962139/
14. Akhtar MA, Sur S, Raine-Fenning N, Jayaprakasan K, Thornton JG, Quenby S. Heparin for assisted reproduction. Cochrane Database Syst Rev. 2013 Aug 17;2013(8):CD009452.
15. Administration of low-molecular-weight heparin in patients with two or more unsuccessful IVF/ICSI cycles: a multicenter cohort study - PubMed [Internet]. [cited 2024 Jan 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/29465258/
16. PPARgamma and early human placental development - PubMed [Internet]. [cited 2024 Jan 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/19075649/
17. Singh N, Davis AA, Kumar S, Kriplani A. The effect of administration of intravenous intralipid on pregnancy outcomes in women with implantation failure after IVF/ICSI with non-donor oocytes: A randomised controlled trial. Eur J Obstet Gynecol Reprod Biol. 2019 Sep;240:45–51.
18. Lan VTN, Khang VN, Nhu GH, Tuong HM. Atosiban improves implantation and pregnancy rates in patients with repeated implantation failure. Reprod Biomed Online. 2012 Sep;25(3):254–60.
19. Moraloglu O, Tonguc E, Var T, Zeyrek T, Batioglu S. Treatment with oxytocin antagonists before embryo transfer may increase implantation rates after IVF. Reprod Biomed Online. 2010 Sep;21(3):338–43.
20. Chou PY, Wu MH, Pan HA, Hung KH, Chang FM. Use of an oxytocin antagonist in in vitro fertilization-embryo transfer for women with repeated implantation failure: a retrospective study. Taiwan J Obstet Gynecol. 2011 Jun;50(2):136–40.
Đơn vị hỗ trợ sinh sản IVFMD-BMT, Bệnh viện Đại học Y Dược Buôn Ma Thuột
Thất bại làm tổ nhiều lần (RIF, Recurrent implantation failure) hiện tại vẫn đang là thách thức lớn trong hỗ trợ sinh sản. Hai phần ba trường hợp RIF do không có sự tiếp nhận của nội mạc tử cung (NMTC), một phần ba còn lại liên quan đến chất lượng phôi chuyển. Do đó cải thiện chất lượng phôi chuyển cùng với việc tối ưu hoá tính tiếp nhận NMTC có vai trò đặc biệt quan trọng trong sự thành công của một chu kỳ chuyển phôi nói riêng, và của ngành hỗ trợ sinh sản nói chung.
Cửa sổ làm tổ là một khoảng thời gian NMTC có tính tiếp nhận cao nhất đối với phôi, đón nhận phôi làm tổ. Trên lâm sàng, quá trình chuẩn bị cửa sổ làm tổ sẽ tập trung vào việc kiểm soát sự xuất hiện tuần tự hai loại nội tiết tố steroids là estradiol và progesterone. Tuy nhiên, các hiểu biết hiện tại cho thấy cửa sổ làm tổ là hiện tượng sinh học phức tạp, liên quan mật thiết đến các yếu tố điều hoà miễn dịch nội tại như cytokines, tế bào diệt tự nhiên – (NK cells), yếu tố tăng trưởng – growth factors và phân tử kết dính. Do đó, nhiều biện pháp điều trị bổ trợ đã và đang được tích cực nghiên cứu nhằm tối ưu hóa cửa sổ làm tổ như chất giãn mạch (sildrenafil, nitroglycerine), chất chống kết tập tiểu cầu (aspirin), chất chống đông máu (heparin trọng lượng phân tử thấp – low molecular weight heparin), yếu tố kích thích dòng bạch cầu hạt (granulocyte colony-stimulating factors), immunoglobulin truyền tĩnh mạch, glucocorticoids (prednisolone), chất ức chế sự co bóp tử cung (atosiban), và một số phương pháp khác. Dù với nỗ lực rất lớn, từ lý thuyết đến ứng dụng thực tiễn các biện pháp này chưa thống nhất và hiệu quả chưa rõ ràng.
Bài viết dưới đây tập trung phân tích cơ chế nền tảng và bàn luận về hiệu quả, tính ứng dụng, và hướng nghiên cứu trong tương lai của một số biện pháp thường gặp bao gồm aspirin, heparin trọng lượng phân tử thấp, intralipid, atosiban và prednisolone.

Hình 1: Quá trình làm tổ của phôi (Governini và cs.,2021
Phản ứng miễn dịch đóng vai trò quan trọng trong quá trình phôi làm tổ, giúp cơ thể người mẹ chấp nhận phôi bán dị ghép (2). Một số cytokine và các thụ thể của chúng được biểu hiện ở diện tiếp xúc giữa mẹ và phôi có chức năng điều hòa sự bám thai. Trong thai kỳ, có sự chuyển đổi từ sản xuất cytokine Th1 sang Th2, vì các cytokine 1 (IFN-g và TNF-a) có hại cho thai kỳ do ức chế quá trình làm tổ (3). Sẩy thai tái phát không rõ nguyên nhân có thể do sự mất cân bằng giữa hệ thống Th1/Th2. Nếu tăng sản xuất các cytokine Th1 gây độc tế bào (interleukin 2, TNFα), thay vì các cytokine Th2 (interleukin 4, 6 và 10) có vai trò ức chế miễn dịch, dẫn đến hiện tượng đào thải phôi bán dị ghép. Tế bào NK (Natural kill) trong tử cung chiếm khoảng 70% số lượng bạch cầu ở màng rụng và có khả năng tham gia vào quá trình hình thành nhau thai, tăng rõ rệt trong thời kỳ đầu mang thai. Để thoát khỏi sự ly giải bởi các tế bào uNK, các tế bào lá nuôi biểu hiện các kháng nguyên MHC Ib, HLA-E và HLA-G. Các thụ thể KillerIglike ức chế (KIR) tương tác với HLA-C của phôi trong những tuần đầu của thai kỳ và ngăn chặn sự ly giải của nguyên bào lá nuôi (4). Nguyên bào lá nuôi xâm nhập vào màng rụng để bao quanh và phá hủy lớp giữa của các động mạch xoắn, biến chúng thành các mạch máu có độ dẫn lưu cao. Vai trò của tế bào uNK trong việc làm tổ và tạo nhau thai được đề xuất bởi những phát hiện cho thấy hoạt động NK cao trước khi thụ thai có liên quan đến tỷ lệ sẩy thai và hiếm muộn hơn đáng kể (5). Để cải thiện khả năng làm tổ của NMTC, cần điều chỉnh các vấn đề tiềm ẩn có thể góp phần gây ra thất bại của quá trình làm tổ. Tuy nhiên, do các quá trình bệnh lý chưa được hiểu rõ nên một số phương pháp điều trị theo kinh nghiệm đã được thử nghiệm với tỷ lệ thành công hạn chế.
Nhiều phân tử khác đã được phát hiện có vai trò quan trọng trong quá trình phôi làm tổ. Những dấu ấn này bao gồm prostaglandin và cyclooxygenase, glycoprotein MUC-1, kinase huyết thanh và glucocorticoid cảm ứng, yếu tố tăng trưởng nhau thai... Tuy nhiên không có một dấu ấn sinh học phân tử đơn lẻ nào có thể xác định khả năng tiếp nhận của tử cung. Quá trình làm tổ là một chuỗi các sự kiện diễn ra liên tục, khả năng tiếp nhận của tử cung có thể được xác định rõ hơn bằng sự kết hợp của các dấu hiệu chính xảy ra trong một khoảng thời gian cửa sổ làm tổ (6).
Aspirin
Các nghiên cứu in vitro cho thấy heparin và aspirin làm giảm quá trình apotosis của nhau thai, cùng với chi phí thấp, dễ tiếp cận và ít tác dụng phụ đã phổ biến việc sử dụng aspirin liều thấp trong các chu kỳ điều trị TTTON. Axit acetylsalicylic liều thấp (aspirin) ức chế enzyme cyclo-oxygenase trong tiểu cầu, do đó ngăn chặn sự tổng hợp thromboxane gây co mạch và kết tập tiểu cầu, ức chế tác dụng tiêu cực của prostaglandin đối với quá trình làm tổ như gây ra các cơn co tử cung hoặc phản ứng viêm. Theo cơ chế này, aspirin liều thấp có thể tăng cường lưu lượng máu tử cung và tưới máu mô, do đó cải thiện khả năng tiếp nhận của NMTC đối với việc làm tổ. Aspirin có thể cải thiện tỷ lệ mang thai ở bệnh nhân có tự kháng thể/huyết thanh dương tính trong các trường hợp RIF (7). Tuy nhiên tổng quan của Cochrane năm 2011 kết luận rằng không có lợi ích khi sử dụng aspirin thường quy trong các chu kỳ TTTON (8).
Heparin và heparin trọng lượng phân tử thấp
Nhiều nghiên cứu đã báo cáo các tình trạng rối loạn đông máu bẩm sinh hoặc mắc phải được ghi nhận ở các trường hợp RIF(9). Điều này dẫn đến việc sử dụng thuốc chống đông máu, chủ yếu là heparin, trong quá trình điều trị hiếm muộn ở phụ nữ có kháng thể kháng phospholipid (10). Heparin là một polysaccharide polydisperse, với tính anion cao, heparin có thể liên kết với rất nhiều protein bao gồm chất chống đông, các yếu tố tăng trưởng, thụ thể của yếu tố tăng trưởng và các phân tử lưới ngoại bào. Những thay đổi về đông máu và tiêu sợi huyết quan sát thấy trong quá trình kích thích buồng trứng cũng tương tự như những thay đổi quan sát được trong thai kỳ dẫn đến những rối loạn đông máu do nồng độ estradiol tăng cao vượt ngưỡng sinh lý khi kích thích buồng trứng. Điều này cho thấy cơ chế đông cầm máu có vai trò quan trọng trong quá trình làm tổ. Ngoài tác dụng chống đông máu, heparin còn có vai trò trong quá trình phôi làm tổ, thông qua tương tác với một số phân tử bám dính, yếu tố tăng trưởng, cytokine và enzyme như lưới nội bào metallicoproteinase (MMP). Heparin cũng điều hòa nhiều quá trình sinh lý cơ bản cần thiết cho sự gắn kết, bám dính và xâm lấn của phôi nang qua quá trình tăng cường sự biệt hóa và xâm lấn của nguyên bào nuôi, có khả năng cải thiện tỷ lệ mang thai trong TTTON (11).
Heparin trọng lượng phân tử thấp (LMWH) cũng được cho rằng có tác dụng có lợi đối với quá trình làm tổ. LMWH làm tăng cường khả năng liên kết sHB-EGF và điều hòa tăng mức sHB-EGF thông qua tăng hoạt động MMP. Interleukin -1 (IL-1) làm tăng biểu hiện integrin β3 của tế bào biểu mô NMTC với sự cải thiện độ bám dính của phôi nang (12). LMWH được báo cáo là làm tăng biểu hiện IL-1 trong bạch cầu được kích hoạt. Do LMWH làm tăng yếu tố tăng trưởng giống insulin tự do, dẫn đến tăng cường sự di chuyển và xâm lấn của nguyên bào nuôi (13). Tuy nhiên việc sử dụng heparin và LMWH ở bệnh nhân RIF còn nhiều tranh cãi. Kết quả tổng quan của Cochrane về ba thử nghiệm ngẫu nhiên có đối chứng với tổng số 386 phụ nữ cho thấy LMWH có thể cải thiện tỷ lệ sinh sống. Tuy nhiên, quy mô của các nghiên cứu nhỏ, chất lượng thấp, có tính không đồng nhất đáng kể và còn phụ thuộc vào việc lựa chọn mô hình thống kê (14). Hơn nữa, có những tác dụng phụ được báo cáo khi sử dụng heparin bao gồm loãng xương, xuất huyết,... không có dữ liệu đáng tin cậy về tác dụng lâu dài. Cuối cùng, một nghiên cứu đoàn hệ hồi cứu, đa trung tâm, quy mô lớn gần đây cho thấy việc sử dụng LMWH không mang lại lợi ích ở những phụ nữ thất bại chuyển phôi từ hai chu kỳ trở lên (15).
Intralipid
Intralipid là một chất béo nhũ tương, tuy cơ chế miễn dịch của intralipid chưa được xác định đầy đủ, nhưng một số nghiên cứu cho thấy đặc tính ức chế miễn dịch, ức chế hoạt động gây độc tế bào NK và sản xuất các cytokine gây viêm như yếu tố hoại tử khối u-alpha, interleukin-6 và interleukin-8. Nhiều nghiên cứu cho thấy intralipid ảnh hưởng đến tế bào NK thông qua các thụ thể như thụ thể kết hợp protein G và thụ thể kích hoạt tăng sinh peroxisome (PPAR). Các axit béo trong intralipid và các chất chuyển hóa hoạt động như các phối tử kích hoạt PPAR được biểu hiện trong tế bào NK. Kích hoạt PPAR làm giảm độc tính tế bào của NK và do đó tăng cường khả năng làm tổ và duy trì thai kỳ. PPAR cũng đóng một vai trò quan trọng trong việc làm tổ, xâm lấn tế bào lá nuôi, phát triển phôi và hình thành nhau thai (16).
Một RCT nghiên cứu tác động của Intralipid đối với kết quả mang thai ở những phụ nữ RIF cho thấy lợi ích của liệu pháp Intralipid với tỷ số chênh được điều chỉnh là 3,1 đối với các trường hợp mang thai lâm sàng ở nhóm điều trị (17). Tuy nhiên, trong phân tích dưới nhóm, tác dụng có lợi chỉ thấy ở những bệnh nhân đã thất bại chuyển phôi trước đó. Tiềm năng sử dụng liệu pháp Intralipid như một chiến lược điều trị hợp lý về mặt kinh tế để cải thiện kết cục thai kỳ, nhưng chưa có bộ dữ liệu đáng tin cậy để đưa ra khuyến cáo cụ thể. Mặc dù vậy Intralipid thường được các bác sĩ lâm sàng coi là phương pháp điều trị an toàn và dễ dàng tiếp cận.

Hình 2: Một số cơ chế trong điều hòa miễn dịch chọn lọc ở NMTC (G Genest và cs., 2023)
Atosiban
Hoạt động co thắt của tử cung có thể ảnh hưởng xấu đến việc làm tổ. Các cơn co thắt tăng lên được thấy ở khoảng 30% bệnh nhân được chuyển phôi. Các thuốc chống co thắt tử cung có thể cải thiện tỷ lệ mang thai; tuy nhiên các thuốc nhắm mô đích vào thụ thể adrenergic tử cung, kênh canxi hoặc tổng hợp prostaglandin không có hiệu quả. Thuốc atosiban đối kháng oxytocin đang được sử dụng như thuốc chống co thắt để trì hoãn chuyển dạ sớm bằng cách ức chế các cơn co thắt của tử cung. Atosiban cũng được sử dụng tại thời điểm chuyển phôi cho những phụ nữ RIF tái phát nhắm làm giảm số cơn co tử cung sau chuyển phôi và tăng tỷ lệ làm tổ (18). Tác dụng có lợi của atosiban không chỉ được quan sát thấy ở những bệnh nhân có tần suất co bóp tử cung cao mà còn ở những bệnh nhân có tần suất co bóp thấp. Những phát hiện này cho thấy atosiban có thể có những lợi ích khác và có hiệu quả trong việc tạo điều kiện cho tử cung làm tổ, ngoài tác dụng lên các cơn co thắt của tử cung (19). Tỷ lệ làm tổ cao hơn đáng kể ở những người nhóm truyền atosiban trước chuyển phôi so với nhóm truyền atosiban ngay sau chuyển phôi (20). Cần có nhiều nghiên cứu hơn để tìm hiểu chính xác cách thức hoạt động và đánh giá vai trò của của atosiban ở những bệnh nhân RIF trong TTTON.
Glucocorticoid
Có giả thuyết cho rằng việc ức chế miễn dịch bằng glucorticoid như một phương pháp điều trị đồng thời hỗ trợ giai đoạn hoàng thể có thể được sử dụng để cải thiện tỷ lệ làm tổ của phôi và thai lâm sàng. Một số nghiên cứu báo cáo rằng liệu pháp glucocorticoid trong giai đoạn làm tổ đã cải thiện tỷ lệ sau thụ tinh ống nghiệm ở những phụ nữ có kháng thể kháng nhân, kháng thể kháng cardiolipin, kháng thể kháng giáp, hoặc kháng đông lupus. Tuy nhiên, các nghiên cứu khác cho rằng liệu pháp glucocorticoid không có thêm lợi ích trong quá trình làm tổ hay cải thiện tỷ lệ thai bất kể liều lượng có ý nghĩa thống kê. Một số nghiên cứu trên động vật ghi nhận việc tiếp xúc với glucocorticoid gây ra sự chậm phát triển của thai nhi, rối loạn tim mạch, chuyển hóa và thần kinh- nội tiết, và có thể gây quái thai. Một số nghiên cứu hạn chế trên người ghi nhận sử dụng glucocorticoid kéo dài trong tam cá nguyệt 1 có thể tăng nguy cơ sẩy thai, sinh non, tăng huyết áp và đái tháo đường thai kỳ. Mặc dù glucocorticoid không có nguy cơ gây các dị tật lớn ở người, nhưng các nghiên cứu đã nhận thấy mối quan hệ nhân quả có thể có giữa tật sứt môi, hở hàm ếch với việc sử dụng corticosteroid quanh giai đoạn phôi làm tổ. Vì vậy, cần cân nhắc giữa lợi ích và nguy cơ của liệu pháp glucocorticoid trong các chu kỳ thụ tinh trong ống nghiệm, có khả năng ảnh hưởng đến thời kỳ đầu mang thai.
Kết luận
Khả năng tiếp nhận của NMTC trong cửa sổ làm tổ đòi hỏi sự tương tác phức tạp của nhiều yếu tố. Bằng cách nghiên cứu các cơ chế điều hòa quá trình làm tổ nhờ các kỹ thuật y học phân tử mới nhất, trong tương lai sẽ có thể xác định được những trở ngại chưa biết của quá trình làm tổ và tiên lượng kết quả thử thai dương tính. Những phát hiện này có ý nghĩa thay đổi thực hành đối với hàng triệu bệnh nhân RIF trên toàn thế giới. Hiệp hội Sinh sản và Nam giới Canada và Hiệp hội Sinh sản Anh liên tiếp công bố các hướng dẫn về quản lý RIF vào năm 2020 và 2021, cả hai đều kết luận rằng các liệu pháp miễn dịch, bao gồm cả corticosteroid, phần lớn vẫn mang tính thực nghiệm đối với RIF và cần có thêm dữ liệu để đưa ra khuyến cáo có độ tin cậy cao. Các phương pháp bổ trợ như prednisolone, aspirin là không hiệu quả và không cần thiết, bên cạnh corticosteroid, các liệu pháp miễn dịch bổ trợ khác như intralipid hay heparin, heparin trọng lượng phân tử thấp cũng đã được điều trị cho bệnh nhân trong khi bằng chứng lâm sàng vẫn chưa đầy đủ. Do đó cần cá thể hóa các liệu pháp bổ trợ cho mỗi bệnh nhân nhằm hạn chế tốn kém và rủi ro tiềm ẩn, khi lợi ích chưa được rõ ràng. Các nghiên cứu trong tương lai hy vọng sẽ tập trung vào việc xác định rõ hơn về cơ chế cũng như căn nguyên RIF để tối ưu hóa khả năng làm tổ của phôi và nội mạc tử cung.
Tài liệu tham khảo chính
1. Governini L, Luongo FP, Haxhiu A, Piomboni P, Luddi A. Main actors behind the endometrial receptivity and successful implantation. Tissue Cell. 2021 Dec 1;73:101656.
2. Clark DA, Arck PC, Chaouat G. Why did your mother reject you? Immunogenetic determinants of the response to environmental selective pressure expressed at the uterine level. Am J Reprod Immunol N Y N 1989. 1999 Jan;41(1):5–22.
3. Chaouat G, Menu E, Clark DA, Dy M, Minkowski M, Wegmann TG. Control of fetal survival in CBA x DBA/2 mice by lymphokine therapy. J Reprod Fertil. 1990 Jul;89(2):447–58.
4. Verma S, King A, Loke YW. Expression of killer cell inhibitory receptors on human uterine natural killer cells. Eur J Immunol. 1997 Apr;27(4):979–83.
5. Aoki K, Kajiura S, Matsumoto Y, Ogasawara M, Okada S, Yagami Y, et al. Preconceptional natural-killer-cell activity as a predictor of miscarriage. Lancet Lond Engl. 1995 May 27;345(8961):1340–2.
6. Teh WT, McBain J, Rogers P. What is the contribution of embryo-endometrial asynchrony to implantation failure? J Assist Reprod Genet. 2016 Nov;33(11):1419–30.
7. Geva E, Amit A, Lerner-Geva L, Yaron Y, Daniel Y, Schwartz T, et al. Prednisone and aspirin improve pregnancy rate in patients with reproductive failure and autoimmune antibodies: a prospective study. Am J Reprod Immunol N Y N 1989. 2000 Jan;43(1):36–40.
8. Hurst BS, Bhojwani JT, Marshburn PB, Papadakis MA, Loeb TA, Matthews ML. Low-dose aspirin does not improve ovarian stimulation, endometrial response, or pregnancy rates for in vitro fertilization. J Exp Clin Assist Reprod. 2005 May 31;2:8.
9. Stern C, Chamley L, Norris H, Hale L, Baker HWG. A randomized, double-blind, placebo-controlled trial of heparin and aspirin for women with in vitro fertilization implantation failure and antiphospholipid or antinuclear antibodies. Fertil Steril. 2003 Aug;80(2):376–83.
10. Stern C, Chamley L. Antiphospholipid antibodies and coagulation defects in women with implantation failure after IVF and recurrent miscarriage. Reprod Biomed Online. 2006 Jul;13(1):29–37.
11. Nelson SM, Greer IA. The potential role of heparin in assisted conception. Hum Reprod Update. 2008;14(6):623–45.
12. Simón C, Gimeno MJ, Mercader A, O’Connor JE, Remohí J, Polan ML, et al. Embryonic regulation of integrins beta 3, alpha 4, and alpha 1 in human endometrial epithelial cells in vitro. J Clin Endocrinol Metab. 1997 Aug;82(8):2607–16.
13. Heparin and low-molecular-weight heparins modulate the decidualization of human endometrial stromal cells - PubMed [Internet]. [cited 2024 Jan 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/19962139/
14. Akhtar MA, Sur S, Raine-Fenning N, Jayaprakasan K, Thornton JG, Quenby S. Heparin for assisted reproduction. Cochrane Database Syst Rev. 2013 Aug 17;2013(8):CD009452.
15. Administration of low-molecular-weight heparin in patients with two or more unsuccessful IVF/ICSI cycles: a multicenter cohort study - PubMed [Internet]. [cited 2024 Jan 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/29465258/
16. PPARgamma and early human placental development - PubMed [Internet]. [cited 2024 Jan 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/19075649/
17. Singh N, Davis AA, Kumar S, Kriplani A. The effect of administration of intravenous intralipid on pregnancy outcomes in women with implantation failure after IVF/ICSI with non-donor oocytes: A randomised controlled trial. Eur J Obstet Gynecol Reprod Biol. 2019 Sep;240:45–51.
18. Lan VTN, Khang VN, Nhu GH, Tuong HM. Atosiban improves implantation and pregnancy rates in patients with repeated implantation failure. Reprod Biomed Online. 2012 Sep;25(3):254–60.
19. Moraloglu O, Tonguc E, Var T, Zeyrek T, Batioglu S. Treatment with oxytocin antagonists before embryo transfer may increase implantation rates after IVF. Reprod Biomed Online. 2010 Sep;21(3):338–43.
20. Chou PY, Wu MH, Pan HA, Hung KH, Chang FM. Use of an oxytocin antagonist in in vitro fertilization-embryo transfer for women with repeated implantation failure: a retrospective study. Taiwan J Obstet Gynecol. 2011 Jun;50(2):136–40.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thành phố Đà Nẵng, thứ sáu và thứ bảy, ngày 6 - 7 . 3 . 2026
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








