Tin chuyên ngành
on Monday 25-12-2023 8:54am
Danh mục: Vô sinh & hỗ trợ sinh sản
CN. Nguyễn Trần Phương Duyên, CN. Nguyễn Thị Minh Anh, ThS. Phan Thị Kim Anh
IVFMD - Bệnh viện Đa khoa Mỹ Đức
Một nghiên cứu với cỡ mẫu lớn của Auger và cộng sự (2016), phân tích ba nhóm lớn nam giới: nam giới có khả năng sinh sản, nam giới vô sinh và nam giới có khối u tinh hoàn. Kết quả nghiên cứu thu được tỷ lệ bất thường acrosome và không bào đầu tinh trùng đều cao hơn so với những loại bất thường khác ở cả ba nhóm nam giới [2]. Trong bài báo này, chúng tôi đề cập đến bất thường acrosome và không bào ở tinh trùng đến kết quả điều trị TTTON.
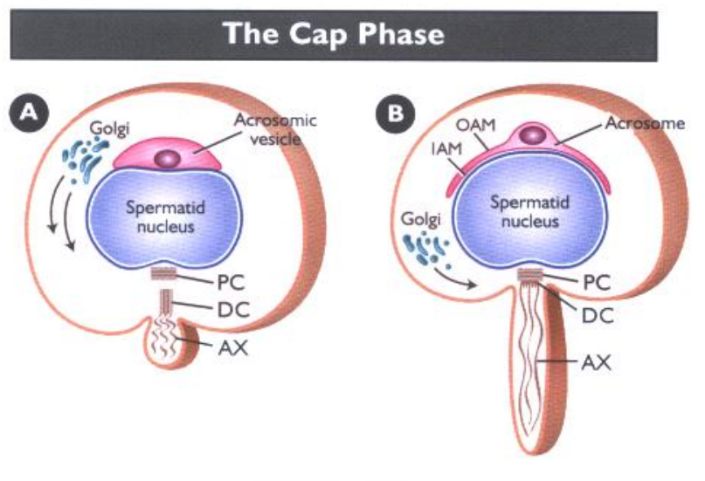
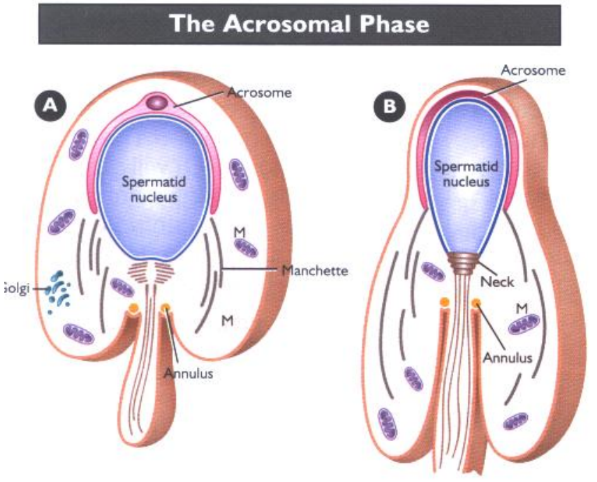
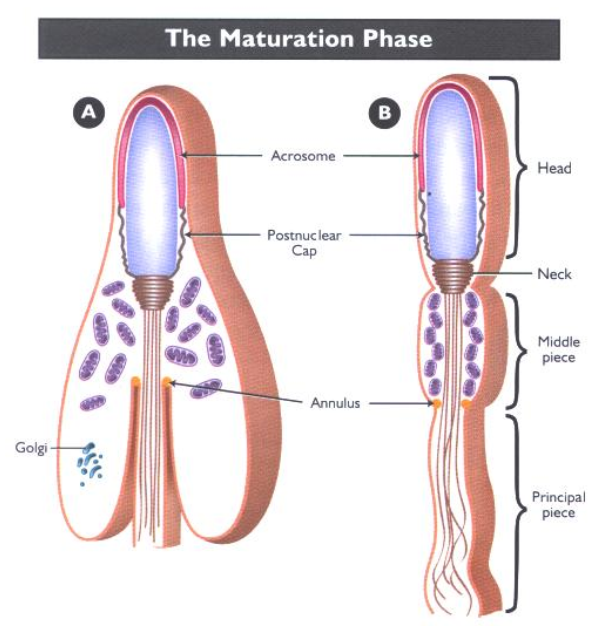
Acrosome được hình thành từ sự biệt hóa của thể Golgi thông qua quá trình biệt hóa của tinh trùng đoạn gồm 4 pha Golgi, pha Cap, pha Acrosome và pha trưởng thành [4]:
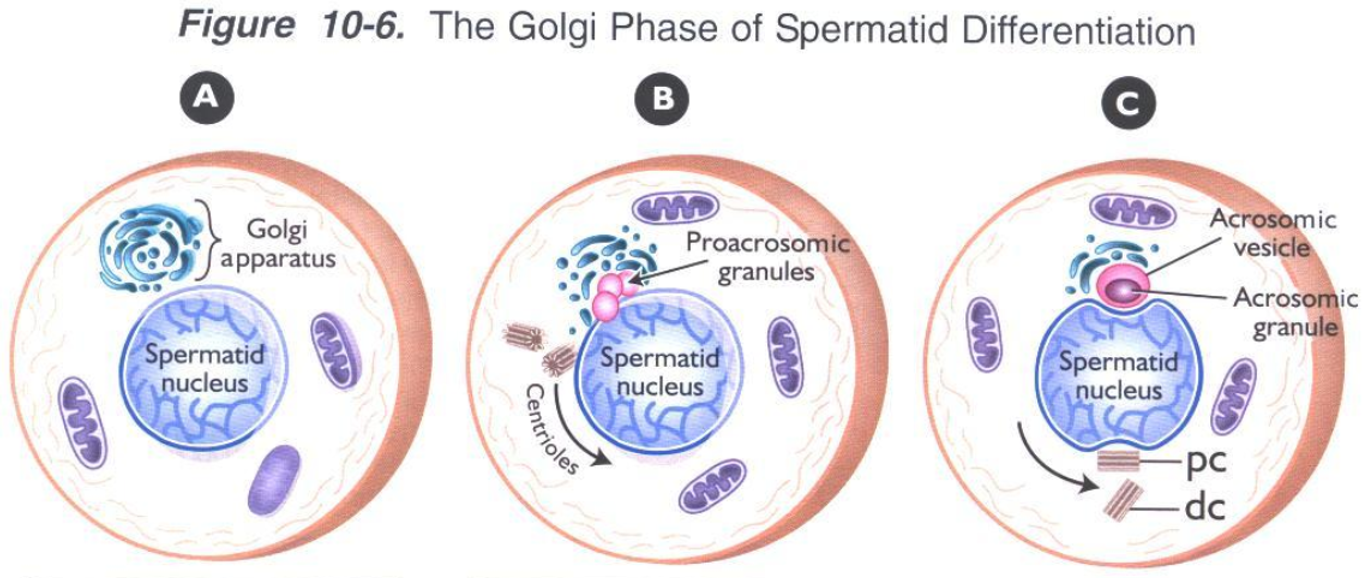
Hình 1: Quá trình hình thành acrosome [4]
Một số nghiên cứu đã xác định nguyên nhân di truyền gây ra các bất thường về acrosome ở tinh trùng, như tinh trùng đầu tròn, ít hoặc không acrosome [6]. Tuy nhiên, nguồn gốc chính xác của bất thường về tinh trùng nhiều acrosome ở người vẫn chưa được rõ ràng, những nghiên cứu về nhiều acrosome vẫn còn hạn chế.
Hiện nay có khoảng hơn 16 gene liên quan đến quá trình hình thành acrosome và hình dạng đầu tinh trùng được nghiên cứu trên mô hình động vật. Những nghiên cứu trên người cho thấy các gen liên quan đến sự bất thường acrosome ở người bao gồm SPATA16, PICK1, SPACA1, DPY19L2 [7].
Gene SPATA16 tham gia vào bước đầu quá trình hình thành acrosome, cụ thể gen này mã hóa protein có mặt trong PAGs giúp các protein vận chuyển được mã hóa bởi gene PICK1 nhận biết gắn vào nhằm định hướng PAGs tập hợp lại di chuyển đúng đến vùng nhân [7]. Gene SPACA1 mã hóa protein tương tác với ACTL7A (một thành phần quan trọng trong phức hợp acrosome – acrophlaxome) giúp acrosome định vị và gắn lên màng acrophlaxome trên nhân tinh trùng. Trong một nghiên cứu của Khawar và cộng sự (2019) cho thấy những tinh trùng đột biến gene SPACA1 bị bất thường trong giai đoạn tinh tử kéo dài, dẫn đến hiện tượng tinh trùng bị bất thường vùng đầu (đầu tròn) [8]. Gene DPY19L2 mã hóa các protein có chức năng liên kết acrosome gắn trên acrophlaxome và vùng nhân lại với nhau, giúp cho acrosome được cố định và bao phủ đầu của tinh trùng. Sự đột biến các gene này được cho là nguyên nhân chính gây nên trường hợp tinh trùng đầu tròn và không có acrosome, hay còn gọi là globozoospermia [9], [10].
Các nghiên cứu của các tác giả cho thấy tinh trùng bất thường acrosome ảnh hưởng đến kết quả điều trị TTTON. Trong một nghiên cứu của Menkveld và cộng sự (2003) trên 50 bệnh nhân nhằm khảo sát tỷ lệ sống của tinh trùng bất thường acrosome sau khi thực hiện phản ứng acrosome (phản ứng acrosome giúp tinh trùng xuyên qua được lớp tế bào hạt quanh noãn cũng như là màng trong suốt, tiến đến gặp bào tương noãn để thụ tinh) so với nhóm đối chứng có acrosome bình thường. Kết quả cho thấy tỷ lệ sống sau phản ứng acrosome ở nhóm ít acrosome thấp hơn đáng kể so với nhóm nhiều acrosome và acrosome bình thường. Dựa trên kết quả thu được, nhóm tác giả cho rằng những tinh trùng ít acrosome sau khi thực hiện phản ứng acrosome tỷ lệ sống thấp nên không thể tiếp tục tiến đến bào tương noãn thực hiện quá trình hòa màng để thụ tinh, dẫn đến trường hợp những tinh trùng ít acrosome có tỷ lệ thụ tinh cũng thấp hơn đáng kể so với nhiều hoặc acrosome bình thường [11].
Năm 2019, Ziba và cộng sự đã báo cáo một nghiên cứu thực hiện trên cỡ mẫu lớn đã được phân loại theo tiêu chuẩn WHO 2010: 1093 tinh trùng có acrosome bình thường từ 345 nam giới (nhóm đối chứng), 141 tinh trùng có acrosome nhỏ từ 25 nam giới, 134 tinh trùng có acrosome lớn từ 51 nam giới, 59 tinh trùng không có acrosome từ 27 nam giới. Kết quả thu được tỷ lệ thụ tinh ở nhóm nhiều, ít và không có acrosome đều thấp hơn đáng kể so với nhóm acrosome bình thường. Trong nghiên cứu này, ở nhóm không acrosome tỷ lệ thụ tinh rất thấp (0,01%), như vậy ở nhóm này không có phôi để sử dụng. Tỷ lệ phôi tốt không có sự khác biệt thống kê đối với tinh trùng ít hoặc không acrosome (54,42 hoặc 51,25%) so với acrosome bình thường (51,21%). Tuy nhiên, tỷ lệ thai làm tổ ở nhóm nhiều acrosome thấp hơn đáng kể so với nhóm ít hoặc acorosome bình thường (16,25% so với 52,38 hoặc 69,6%), cùng với đó nhóm nhiều acrosome làm gia tăng tỷ lệ sẩy thai nhiều hơn hai nhóm còn lại (15,3% so với 6,06 hoặc 5,23%). Như vậy, tinh trùng nhiều acrosome ảnh hưởng tiêu cực đến kết cục lâm sàng, nhưng những nghiên cứu về tinh trùng nhiều acrosome vẫn còn hạn chế, cần có thêm nhiều nghiên cứu khác mới có thể khẳng định ảnh hưởng của nhóm này đến kết quả điều trị [12].
Một trường hợp đặc biệt ở nhóm tinh trùng không acrosome là globozoospermia, đây là nguyên nhân vô sinh hiếm gặp, chiếm 0,1% trường hợp vô sinh do nam giới. Sự bất thường này dẫn đến tinh trùng hoàn toàn không có khả năng thực hiện phản ứng acrosome và thụ tinh bình thường với noãn. Globozoospermia được chia thành hai nhóm, globo một phần (chiếm 20-90% toàn bộ tinh trùng trong mẫu) và toàn phần (chiếm 100% toàn bộ tinh trùng trong mẫu) [13].
Tinh trùng globozoospermia là một dạng bất thường hiếm gặp, do đó các bài nghiên cứu về trường hợp này đa số dưới dạng báo cáo ca bệnh (case report). Một bài báo tổng hợp các dạng báo cáo ca bệnh liên quan đến trường hợp tinh trùng globozoospermia toàn phần và một phần từ năm 2011 đến năm 2021 của nhóm tác giả Andrea và cộng sự (2023) cho thấy sau khi ICSI, những trường hợp globozoospermia một phần có tỷ lệ thụ tinh trung bình cao khoảng 75%, cùng với đó tỷ trẻ sinh sống là tương đương nhau. Nhưng đối với trường hợp globozoospermia toàn phần thì tỷ lệ thụ tinh rất thấp và không có tỷ lệ trẻ sinh sống được ghi nhận. Hiện nay, có hai cách tiếp nhận nhóm bệnh nhân này, đó là áp dụng kỹ thuật IMSI (Intra Cytoplasmic Morphologically Selected Sperm Injection) tiêm tinh trùng có chọn lọc hình thái vào bào tương noãn dưới độ phóng đại cao 6,600 lần dựa theo tiêu chuẩn MSOME, giúp đánh giá hình dạng tinh trùng một cách chính xác nhất hoặc ICSI kết hợp với các phương pháp hỗ trợ hoạt hóa noãn (Artificial occyte activation – AOA) bằng các phương pháp khác nhau [14]. Trong báo cáo của Andrea và cộng sự, cho thấy việc IMSI giúp cải thiện tỷ lệ thụ tinh lên khoảng 50-70% và ghi nhận có trẻ sinh sống. Cùng với đó, ICSI - AOA cũng cho hiệu quả tương tự. Tuy nhiên, hiệu quả của IMSI đối với nhóm globo toàn phần ở các nghiên cứu vẫn còn hạn chế. Các trường hợp tinh trùng globozoospermia toàn phần là do tinh trùng không có khả năng hoạt hóa noãn. Vì vậy, thực hiện ICSI – AOA ở những trường hợp này nhằm giúp cải thiện tỷ lệ thụ tinh và trẻ sinh sống. Đến nay, đã có nhiều báo cáo về trường hợp trẻ sinh sống sau ICSI – AOA nhưng dữ liệu vẫn còn khá ít, nên cần có thêm những đánh giá khác trên cỡ mẫu lớn về sức khỏe sau sinh của trẻ từ nhóm ICSI – AOA [14].
Hiện nay, có hai giả thuyết về nguồn gốc của không bào. Theo giả thuyết của Zamboni (1987), sự hình thành các không bào trong vùng acrosome là do bất thường trong quá trình biệt hóa (spermiogenesis) của tinh trùng cụ thể là những biến đổi từ pha golgi, pha cap, pha acrosome và pha trưởng thành. Theo tác giả, tại pha golgi những thể PAGs trong quá trình hình thành acrosome không thể hợp nhất lại với nhau thành một thể thống nhất AG mà nằm rời rạc cho đến pha trưởng thành, đây là nguyên nhân gây nên sự xuất hiện của không bào ở vùng acrosome khi tinh trùng trưởng thành [15]. Ngoài ra, theo Chemes và cộng sự (2012) cho rằng các khoảng trống nhỏ được quan sát thấy trong nhân tế bào của tinh trùng là kết quả bất thường của quá trình chuyển đổi histone-protamine trong quá trình sinh tinh do hệ thống proteasome-ubiquitin hoạt động quá mức, khiến cho một số vùng nhiễm sắc chất trong nhân không được nén chặt, từ đó xuất hiện như những khoảng trống trong nhân. Đây cũng có thể là nguồn gốc của việc không bào xuất hiện trong nhân [17].
Một số giả thuyết được đặt ra rằng sự hiện diện của không bào có ảnh hưởng đối với kết quả quá trình thụ tinh, sự phát triển của phôi thai, quá trình mang thai và sẩy thai hay không, từ đó dẫn đến những ảnh hưởng trong quá trình điều trị TTON.
Trong một bài báo của nhóm tác giả Pierre (2008) cho thấy tỷ lệ tạo phôi nang ở nhóm tinh trùng không có không bào hoặc ít hơn hai không bào nhỏ (nhóm A) cao hơn so với nhóm có từ một không bào lớn hoặc không bào lớn kèm với những bất thường khác (nhóm B) (56,3 hoặc 61,4% so với 37,5 hoặc 37,1%). Và tỷ lệ phôi nang chất lượng tốt ở nhóm A cũng cao hơn so với nhóm B (5,1 hoặc 0% so với 1,7 hoặc 0%). Tác giả kết luận sự xuất hiện của các không bào lớn làm giảm tỷ lệ phôi đạt đến giai đoạn phôi nang và tỷ lệ phôi nang tốt. Điều này chứng minh rằng kích thước và số lượng không bào ở tinh trùng ảnh hưởng tiêu cực đến sự phát triển phôi nang [18].
Vào năm 2014, tác giác giả Amanda và cs phân tích mẫu tinh dịch của 200 cặp vợ chồng vô sinh do yếu tố nam giới. Kết quả cho thấy không có mối tương quan giữa tỷ lệ xuất hiện không bào lớn với tỷ lệ thụ tinh và tỷ lệ phôi tốt ngày 3. Tuy nhiên, tỷ lệ không bào lớn lại có mối tương quan nghịch với tỷ lệ hình thành phôi nang và làm tổ. [19].
Một phân tích về tác động của các tế bào tinh trùng có không bào lớn được thực hiện bởi Berkovitz và cộng sự (2006), trên hai nhóm bệnh nhân gồm 28 bệnh nhân mỗi nhóm. Tinh trùng được lựa chọn dưới độ phóng đại cao (6,600x) dựa theo tiêu chuẩn MSOME, phân loại 2 nhóm khác nhau: nhóm tinh trùng có hình dạng thường nhưng có không bào lớn (có kích thước lớn hơn 4% thể tích vùng đầu) được chọn để ICSI và so sánh với nhóm đối chứng bao gồm tinh trùng có hình dạng bình thường. Yếu tố vô sinh không được đề cập trong nghiên cứu này. Kết quả không có sự khác biệt trong tỷ lệ thụ tinh và phát triển phôi ở giai đoạn phôi phân chia. Tuy nhiên, việc ICSI tinh trùng có không bào lớn làm giảm đáng kể tỷ lệ thai lâm sàng (5% so với 14%) và có liên quan đến tỷ lệ sẩy thai sớm (4% so với 1%) [20]. Từ kết quả thu được, nhóm tác giả đưa ra kết luận những tinh trùng có không bào lớn ảnh hưởng tiêu cực đến kết quả lâm sàng, cụ thể làm giảm tỷ lệ thai làm tổ và tăng tỷ lệ sẩy thai sớm.
TÀI LIỆU THAM KHẢO
[1] E. Moretti, C. Signorini, D. Noto, R. Corsaro, and G. Collodel, “The relevance of sperm morphology in male infertility,” Front. Reprod. Heal., vol. 4, 2022, doi: 10.3389/FRPH.2022.945351.
[2] J. Auger, P. Jouannet, and F. Eustache, “Another look at human sperm morphology,” Hum. Reprod., vol. 31, no. 1, pp. 10–23, Jan. 2016, doi: 10.1093/HUMREP/DEV251.
[3] J. Auger, “Spermatozoa and Sperm Structure,” Encycl. Reprod., pp. 62–67, Jan. 2018, doi: 10.1016/B978-0-12-801238-3.64563-4.
[4] K. Yoshinaga and K. Toshimori, “Organization and modifications of sperm acrosomal molecules during spermatogenesis and epididymal maturation,” Microsc. Res. Tech., vol. 61, no. 1, pp. 39–45, May 2003, doi: 10.1002/JEMT.10315.
[5] World Health Organization, “World Health Organization. WHO laboratory manual for the examination and processing of human semen. 6th ed.,” WHO Press, p. 276, 2021, Accessed: Aug. 01, 2023. [Online]. Available: https://www.who.int/publications/i/item/9789240030787
[6] M. R. Guichaoua, C. Geoffroy-Siraudin, G. Mercier, V. Achard, O. Paulmyer-Lacroix, and C. Metzler-Guillemain, “[Genetic aspects of the teratozoospermia],” Gynecol. Obstet. Fertil., vol. 37, no. 6, pp. 540–545, 2009, doi: 10.1016/J.GYOBFE.2009.04.014.
[7] F. Faja et al., “Molecular analysis of dpy19l2, pick1 and spata16 in italian unrelated globozoospermic men,” Life, vol. 11, no. 7, Jul. 2021, doi: 10.3390/LIFE11070641/S1.
[8] M. B. Khawar, H. Gao, and W. Li, “Mechanism of Acrosome Biogenesis in Mammals,” Front. Cell Dev. Biol., vol. 7, p. 470641, Sep. 2019, doi: 10.3389/FCELL.2019.00195/BIBTEX.
[9] M. Tavalaee, M. Nomikos, F. A. Lai, and M. H. Nasr-Esfahani, “Expression of sperm PLCζ and clinical outcomes of ICSI-AOA in men affected by globozoospermia due to DPY19L2 deletion,” Reprod. Biomed. Online, vol. 36, no. 3, pp. 348–355, Mar. 2018, doi: 10.1016/J.RBMO.2017.12.013.
[10] P. Chen et al., “Loss of SPACA1 function causes autosomal recessive globozoospermia by damaging the acrosome–acroplaxome complex,” Hum. Reprod., vol. 36, no. 9, pp. 2587–2596, Aug. 2021, doi: 10.1093/HUMREP/DEAB144.
[11] R. Menkveld, Y. El-Garem, W. B. Schill, and R. Henkel, “Relationship Between Human Sperm Morphology and Acrosomal Function,” J. Assist. Reprod. Genet., vol. 20, no. 10, p. 432, Oct. 2003, doi: 10.1023/A:1026288710638.
[12] Z. Zahiri and F. Ghasemian, “Is it necessary to focus on morphologically normal acrosome of sperm during intracytoplasmic sperm injection?,” Indian J. Med. Res., vol. 150, no. 5, p. 477, Nov. 2019, doi: 10.4103/IJMR.IJMR_866_18.
[13] Z. ÇANKIRI et al., “INVESTIGATION OF GLOBOZOOSPERMIA’S MORPHOLOGICAL STRUCTURE AND DNA FRAGMENTATION IN OLIGOZOOSPERMIA CASES IN INFERTILE MALES,” Middle East J. Sci., vol. 8, no. 1, pp. 56–63, Jun. 2022, doi: 10.51477/MEJS.1095136.
[14] A. Crafa, R. A. Condorelli, S. La Vignera, A. E. Calogero, and R. Cannarella, “Globozoospermia: A Case Report and Systematic Review of Literature,” World J. Mens. Health, vol. 41, no. 1, p. 49, 2023, doi: 10.5534/WJMH.220020.
[15] L. Zamboni, “The ultrastructural pathology of the spermatozoon as a cause of infertility: the role of electron microscopy in the evaluation of semen quality,” Fertil. Steril., vol. 48, no. 5, pp. 711–734, 1987, doi: 10.1016/S0015-0282(16)59520-X.
[16] F. Boitrelle et al., “Large human sperm vacuoles observed in motile spermatozoa under high magnification: nuclear thumbprints linked to failure of chromatin condensation,” Hum. Reprod., vol. 26, no. 7, pp. 1650–1658, 2011, doi: 10.1093/HUMREP/DER129.
[17] H. E. Chemes and C. Alvarez Sedo, “Tales of the Tail and Sperm Head AchesChanging concepts on the prognostic significance of sperm pathologies affecting the head, neck and tail,” Asian J. Androl., vol. 14, no. 1, p. 14, Jan. 2012, doi: 10.1038/AJA.2011.168.
[18] P. Vanderzwalmen et al., “Blastocyst development after sperm selection at high magnification is associated with size and number of nuclear vacuoles,” Reprod. Biomed. Online, vol. 17, no. 5, pp. 617–627, Jan. 2008, doi: 10.1016/S1472-6483(10)60308-2.
[19] A. S. Setti, D. P. De Almeida Ferreira Braga, L. Vingris, R. De Cassia Savio Figueira, A. Iaconelli, and E. Borges, “The prevalence of sperm with large nuclear vacuoles is a prognostic tool in the prediction of ICSI success,” J. Assist. Reprod. Genet., vol. 31, no. 3, p. 307, 2014, doi: 10.1007/S10815-013-0157-0.
[20] A. Berkovitz, F. Eltes, A. Ellenbogen, S. Peer, D. Feldberg, and B. Bartoov, “Does the presence of nuclear vacuoles in human sperm selected for ICSI affect pregnancy outcome?,” Hum. Reprod., vol. 21, no. 7, pp. 1787–1790, Jul. 2006, doi: 10.1093/HUMREP/DEL049.
IVFMD - Bệnh viện Đa khoa Mỹ Đức
- Giới thiệu
Một nghiên cứu với cỡ mẫu lớn của Auger và cộng sự (2016), phân tích ba nhóm lớn nam giới: nam giới có khả năng sinh sản, nam giới vô sinh và nam giới có khối u tinh hoàn. Kết quả nghiên cứu thu được tỷ lệ bất thường acrosome và không bào đầu tinh trùng đều cao hơn so với những loại bất thường khác ở cả ba nhóm nam giới [2]. Trong bài báo này, chúng tôi đề cập đến bất thường acrosome và không bào ở tinh trùng đến kết quả điều trị TTTON.
- Ảnh hưởng của bất thường acrosome đến kết quả điều trị TTTON
Acrosome được hình thành từ sự biệt hóa của thể Golgi thông qua quá trình biệt hóa của tinh trùng đoạn gồm 4 pha Golgi, pha Cap, pha Acrosome và pha trưởng thành [4]:

Hình 1: Quá trình hình thành acrosome [4]
- Pha Golgi: Những thể Proacrosomic granules (PAGs) xung quanh thể Golgi tập hợp lại với nhau di chuyển đến gắn vào vùng nhân tạo thành một thể thống nhất Acrosomic granule (AG), sau đó thể AG bắt đầu gia tăng kích thước thành Acrosomic vesicle (AV).


- Pha Cap: Thể AV tiếp tục gia tăng kích thước và có xu hướng dàn đều sang hai bên vùng nhân như một cái mũ, cấu trúc acrosome bước đầu được hình thành, màng ngoài và màng trong acrosome xuất hện.
- Pha Acrosome: Tinh tử lúc này đang ở giai đoạn kéo dài, vùng nhân và acrosome bắt đầu quá trỉnh kéo dài, kích thước acrosome đồng bộ với kích thước vùng đầu sau kéo dài.

- Pha trưởng thành: Sau khi hoàn tất quá trình kéo dài, hình thành màng sau vùng acrosome, cấu trúc acrosome đã hoàn chỉnh.
Một số nghiên cứu đã xác định nguyên nhân di truyền gây ra các bất thường về acrosome ở tinh trùng, như tinh trùng đầu tròn, ít hoặc không acrosome [6]. Tuy nhiên, nguồn gốc chính xác của bất thường về tinh trùng nhiều acrosome ở người vẫn chưa được rõ ràng, những nghiên cứu về nhiều acrosome vẫn còn hạn chế.
Hiện nay có khoảng hơn 16 gene liên quan đến quá trình hình thành acrosome và hình dạng đầu tinh trùng được nghiên cứu trên mô hình động vật. Những nghiên cứu trên người cho thấy các gen liên quan đến sự bất thường acrosome ở người bao gồm SPATA16, PICK1, SPACA1, DPY19L2 [7].
Gene SPATA16 tham gia vào bước đầu quá trình hình thành acrosome, cụ thể gen này mã hóa protein có mặt trong PAGs giúp các protein vận chuyển được mã hóa bởi gene PICK1 nhận biết gắn vào nhằm định hướng PAGs tập hợp lại di chuyển đúng đến vùng nhân [7]. Gene SPACA1 mã hóa protein tương tác với ACTL7A (một thành phần quan trọng trong phức hợp acrosome – acrophlaxome) giúp acrosome định vị và gắn lên màng acrophlaxome trên nhân tinh trùng. Trong một nghiên cứu của Khawar và cộng sự (2019) cho thấy những tinh trùng đột biến gene SPACA1 bị bất thường trong giai đoạn tinh tử kéo dài, dẫn đến hiện tượng tinh trùng bị bất thường vùng đầu (đầu tròn) [8]. Gene DPY19L2 mã hóa các protein có chức năng liên kết acrosome gắn trên acrophlaxome và vùng nhân lại với nhau, giúp cho acrosome được cố định và bao phủ đầu của tinh trùng. Sự đột biến các gene này được cho là nguyên nhân chính gây nên trường hợp tinh trùng đầu tròn và không có acrosome, hay còn gọi là globozoospermia [9], [10].
Các nghiên cứu của các tác giả cho thấy tinh trùng bất thường acrosome ảnh hưởng đến kết quả điều trị TTTON. Trong một nghiên cứu của Menkveld và cộng sự (2003) trên 50 bệnh nhân nhằm khảo sát tỷ lệ sống của tinh trùng bất thường acrosome sau khi thực hiện phản ứng acrosome (phản ứng acrosome giúp tinh trùng xuyên qua được lớp tế bào hạt quanh noãn cũng như là màng trong suốt, tiến đến gặp bào tương noãn để thụ tinh) so với nhóm đối chứng có acrosome bình thường. Kết quả cho thấy tỷ lệ sống sau phản ứng acrosome ở nhóm ít acrosome thấp hơn đáng kể so với nhóm nhiều acrosome và acrosome bình thường. Dựa trên kết quả thu được, nhóm tác giả cho rằng những tinh trùng ít acrosome sau khi thực hiện phản ứng acrosome tỷ lệ sống thấp nên không thể tiếp tục tiến đến bào tương noãn thực hiện quá trình hòa màng để thụ tinh, dẫn đến trường hợp những tinh trùng ít acrosome có tỷ lệ thụ tinh cũng thấp hơn đáng kể so với nhiều hoặc acrosome bình thường [11].
Năm 2019, Ziba và cộng sự đã báo cáo một nghiên cứu thực hiện trên cỡ mẫu lớn đã được phân loại theo tiêu chuẩn WHO 2010: 1093 tinh trùng có acrosome bình thường từ 345 nam giới (nhóm đối chứng), 141 tinh trùng có acrosome nhỏ từ 25 nam giới, 134 tinh trùng có acrosome lớn từ 51 nam giới, 59 tinh trùng không có acrosome từ 27 nam giới. Kết quả thu được tỷ lệ thụ tinh ở nhóm nhiều, ít và không có acrosome đều thấp hơn đáng kể so với nhóm acrosome bình thường. Trong nghiên cứu này, ở nhóm không acrosome tỷ lệ thụ tinh rất thấp (0,01%), như vậy ở nhóm này không có phôi để sử dụng. Tỷ lệ phôi tốt không có sự khác biệt thống kê đối với tinh trùng ít hoặc không acrosome (54,42 hoặc 51,25%) so với acrosome bình thường (51,21%). Tuy nhiên, tỷ lệ thai làm tổ ở nhóm nhiều acrosome thấp hơn đáng kể so với nhóm ít hoặc acorosome bình thường (16,25% so với 52,38 hoặc 69,6%), cùng với đó nhóm nhiều acrosome làm gia tăng tỷ lệ sẩy thai nhiều hơn hai nhóm còn lại (15,3% so với 6,06 hoặc 5,23%). Như vậy, tinh trùng nhiều acrosome ảnh hưởng tiêu cực đến kết cục lâm sàng, nhưng những nghiên cứu về tinh trùng nhiều acrosome vẫn còn hạn chế, cần có thêm nhiều nghiên cứu khác mới có thể khẳng định ảnh hưởng của nhóm này đến kết quả điều trị [12].
Một trường hợp đặc biệt ở nhóm tinh trùng không acrosome là globozoospermia, đây là nguyên nhân vô sinh hiếm gặp, chiếm 0,1% trường hợp vô sinh do nam giới. Sự bất thường này dẫn đến tinh trùng hoàn toàn không có khả năng thực hiện phản ứng acrosome và thụ tinh bình thường với noãn. Globozoospermia được chia thành hai nhóm, globo một phần (chiếm 20-90% toàn bộ tinh trùng trong mẫu) và toàn phần (chiếm 100% toàn bộ tinh trùng trong mẫu) [13].
Tinh trùng globozoospermia là một dạng bất thường hiếm gặp, do đó các bài nghiên cứu về trường hợp này đa số dưới dạng báo cáo ca bệnh (case report). Một bài báo tổng hợp các dạng báo cáo ca bệnh liên quan đến trường hợp tinh trùng globozoospermia toàn phần và một phần từ năm 2011 đến năm 2021 của nhóm tác giả Andrea và cộng sự (2023) cho thấy sau khi ICSI, những trường hợp globozoospermia một phần có tỷ lệ thụ tinh trung bình cao khoảng 75%, cùng với đó tỷ trẻ sinh sống là tương đương nhau. Nhưng đối với trường hợp globozoospermia toàn phần thì tỷ lệ thụ tinh rất thấp và không có tỷ lệ trẻ sinh sống được ghi nhận. Hiện nay, có hai cách tiếp nhận nhóm bệnh nhân này, đó là áp dụng kỹ thuật IMSI (Intra Cytoplasmic Morphologically Selected Sperm Injection) tiêm tinh trùng có chọn lọc hình thái vào bào tương noãn dưới độ phóng đại cao 6,600 lần dựa theo tiêu chuẩn MSOME, giúp đánh giá hình dạng tinh trùng một cách chính xác nhất hoặc ICSI kết hợp với các phương pháp hỗ trợ hoạt hóa noãn (Artificial occyte activation – AOA) bằng các phương pháp khác nhau [14]. Trong báo cáo của Andrea và cộng sự, cho thấy việc IMSI giúp cải thiện tỷ lệ thụ tinh lên khoảng 50-70% và ghi nhận có trẻ sinh sống. Cùng với đó, ICSI - AOA cũng cho hiệu quả tương tự. Tuy nhiên, hiệu quả của IMSI đối với nhóm globo toàn phần ở các nghiên cứu vẫn còn hạn chế. Các trường hợp tinh trùng globozoospermia toàn phần là do tinh trùng không có khả năng hoạt hóa noãn. Vì vậy, thực hiện ICSI – AOA ở những trường hợp này nhằm giúp cải thiện tỷ lệ thụ tinh và trẻ sinh sống. Đến nay, đã có nhiều báo cáo về trường hợp trẻ sinh sống sau ICSI – AOA nhưng dữ liệu vẫn còn khá ít, nên cần có thêm những đánh giá khác trên cỡ mẫu lớn về sức khỏe sau sinh của trẻ từ nhóm ICSI – AOA [14].
- Ảnh hưởng của không bào đến kết quả điều trị TTTON
Hiện nay, có hai giả thuyết về nguồn gốc của không bào. Theo giả thuyết của Zamboni (1987), sự hình thành các không bào trong vùng acrosome là do bất thường trong quá trình biệt hóa (spermiogenesis) của tinh trùng cụ thể là những biến đổi từ pha golgi, pha cap, pha acrosome và pha trưởng thành. Theo tác giả, tại pha golgi những thể PAGs trong quá trình hình thành acrosome không thể hợp nhất lại với nhau thành một thể thống nhất AG mà nằm rời rạc cho đến pha trưởng thành, đây là nguyên nhân gây nên sự xuất hiện của không bào ở vùng acrosome khi tinh trùng trưởng thành [15]. Ngoài ra, theo Chemes và cộng sự (2012) cho rằng các khoảng trống nhỏ được quan sát thấy trong nhân tế bào của tinh trùng là kết quả bất thường của quá trình chuyển đổi histone-protamine trong quá trình sinh tinh do hệ thống proteasome-ubiquitin hoạt động quá mức, khiến cho một số vùng nhiễm sắc chất trong nhân không được nén chặt, từ đó xuất hiện như những khoảng trống trong nhân. Đây cũng có thể là nguồn gốc của việc không bào xuất hiện trong nhân [17].
Một số giả thuyết được đặt ra rằng sự hiện diện của không bào có ảnh hưởng đối với kết quả quá trình thụ tinh, sự phát triển của phôi thai, quá trình mang thai và sẩy thai hay không, từ đó dẫn đến những ảnh hưởng trong quá trình điều trị TTON.
Trong một bài báo của nhóm tác giả Pierre (2008) cho thấy tỷ lệ tạo phôi nang ở nhóm tinh trùng không có không bào hoặc ít hơn hai không bào nhỏ (nhóm A) cao hơn so với nhóm có từ một không bào lớn hoặc không bào lớn kèm với những bất thường khác (nhóm B) (56,3 hoặc 61,4% so với 37,5 hoặc 37,1%). Và tỷ lệ phôi nang chất lượng tốt ở nhóm A cũng cao hơn so với nhóm B (5,1 hoặc 0% so với 1,7 hoặc 0%). Tác giả kết luận sự xuất hiện của các không bào lớn làm giảm tỷ lệ phôi đạt đến giai đoạn phôi nang và tỷ lệ phôi nang tốt. Điều này chứng minh rằng kích thước và số lượng không bào ở tinh trùng ảnh hưởng tiêu cực đến sự phát triển phôi nang [18].
Vào năm 2014, tác giác giả Amanda và cs phân tích mẫu tinh dịch của 200 cặp vợ chồng vô sinh do yếu tố nam giới. Kết quả cho thấy không có mối tương quan giữa tỷ lệ xuất hiện không bào lớn với tỷ lệ thụ tinh và tỷ lệ phôi tốt ngày 3. Tuy nhiên, tỷ lệ không bào lớn lại có mối tương quan nghịch với tỷ lệ hình thành phôi nang và làm tổ. [19].
Một phân tích về tác động của các tế bào tinh trùng có không bào lớn được thực hiện bởi Berkovitz và cộng sự (2006), trên hai nhóm bệnh nhân gồm 28 bệnh nhân mỗi nhóm. Tinh trùng được lựa chọn dưới độ phóng đại cao (6,600x) dựa theo tiêu chuẩn MSOME, phân loại 2 nhóm khác nhau: nhóm tinh trùng có hình dạng thường nhưng có không bào lớn (có kích thước lớn hơn 4% thể tích vùng đầu) được chọn để ICSI và so sánh với nhóm đối chứng bao gồm tinh trùng có hình dạng bình thường. Yếu tố vô sinh không được đề cập trong nghiên cứu này. Kết quả không có sự khác biệt trong tỷ lệ thụ tinh và phát triển phôi ở giai đoạn phôi phân chia. Tuy nhiên, việc ICSI tinh trùng có không bào lớn làm giảm đáng kể tỷ lệ thai lâm sàng (5% so với 14%) và có liên quan đến tỷ lệ sẩy thai sớm (4% so với 1%) [20]. Từ kết quả thu được, nhóm tác giả đưa ra kết luận những tinh trùng có không bào lớn ảnh hưởng tiêu cực đến kết quả lâm sàng, cụ thể làm giảm tỷ lệ thai làm tổ và tăng tỷ lệ sẩy thai sớm.
- Kết luận
TÀI LIỆU THAM KHẢO
[1] E. Moretti, C. Signorini, D. Noto, R. Corsaro, and G. Collodel, “The relevance of sperm morphology in male infertility,” Front. Reprod. Heal., vol. 4, 2022, doi: 10.3389/FRPH.2022.945351.
[2] J. Auger, P. Jouannet, and F. Eustache, “Another look at human sperm morphology,” Hum. Reprod., vol. 31, no. 1, pp. 10–23, Jan. 2016, doi: 10.1093/HUMREP/DEV251.
[3] J. Auger, “Spermatozoa and Sperm Structure,” Encycl. Reprod., pp. 62–67, Jan. 2018, doi: 10.1016/B978-0-12-801238-3.64563-4.
[4] K. Yoshinaga and K. Toshimori, “Organization and modifications of sperm acrosomal molecules during spermatogenesis and epididymal maturation,” Microsc. Res. Tech., vol. 61, no. 1, pp. 39–45, May 2003, doi: 10.1002/JEMT.10315.
[5] World Health Organization, “World Health Organization. WHO laboratory manual for the examination and processing of human semen. 6th ed.,” WHO Press, p. 276, 2021, Accessed: Aug. 01, 2023. [Online]. Available: https://www.who.int/publications/i/item/9789240030787
[6] M. R. Guichaoua, C. Geoffroy-Siraudin, G. Mercier, V. Achard, O. Paulmyer-Lacroix, and C. Metzler-Guillemain, “[Genetic aspects of the teratozoospermia],” Gynecol. Obstet. Fertil., vol. 37, no. 6, pp. 540–545, 2009, doi: 10.1016/J.GYOBFE.2009.04.014.
[7] F. Faja et al., “Molecular analysis of dpy19l2, pick1 and spata16 in italian unrelated globozoospermic men,” Life, vol. 11, no. 7, Jul. 2021, doi: 10.3390/LIFE11070641/S1.
[8] M. B. Khawar, H. Gao, and W. Li, “Mechanism of Acrosome Biogenesis in Mammals,” Front. Cell Dev. Biol., vol. 7, p. 470641, Sep. 2019, doi: 10.3389/FCELL.2019.00195/BIBTEX.
[9] M. Tavalaee, M. Nomikos, F. A. Lai, and M. H. Nasr-Esfahani, “Expression of sperm PLCζ and clinical outcomes of ICSI-AOA in men affected by globozoospermia due to DPY19L2 deletion,” Reprod. Biomed. Online, vol. 36, no. 3, pp. 348–355, Mar. 2018, doi: 10.1016/J.RBMO.2017.12.013.
[10] P. Chen et al., “Loss of SPACA1 function causes autosomal recessive globozoospermia by damaging the acrosome–acroplaxome complex,” Hum. Reprod., vol. 36, no. 9, pp. 2587–2596, Aug. 2021, doi: 10.1093/HUMREP/DEAB144.
[11] R. Menkveld, Y. El-Garem, W. B. Schill, and R. Henkel, “Relationship Between Human Sperm Morphology and Acrosomal Function,” J. Assist. Reprod. Genet., vol. 20, no. 10, p. 432, Oct. 2003, doi: 10.1023/A:1026288710638.
[12] Z. Zahiri and F. Ghasemian, “Is it necessary to focus on morphologically normal acrosome of sperm during intracytoplasmic sperm injection?,” Indian J. Med. Res., vol. 150, no. 5, p. 477, Nov. 2019, doi: 10.4103/IJMR.IJMR_866_18.
[13] Z. ÇANKIRI et al., “INVESTIGATION OF GLOBOZOOSPERMIA’S MORPHOLOGICAL STRUCTURE AND DNA FRAGMENTATION IN OLIGOZOOSPERMIA CASES IN INFERTILE MALES,” Middle East J. Sci., vol. 8, no. 1, pp. 56–63, Jun. 2022, doi: 10.51477/MEJS.1095136.
[14] A. Crafa, R. A. Condorelli, S. La Vignera, A. E. Calogero, and R. Cannarella, “Globozoospermia: A Case Report and Systematic Review of Literature,” World J. Mens. Health, vol. 41, no. 1, p. 49, 2023, doi: 10.5534/WJMH.220020.
[15] L. Zamboni, “The ultrastructural pathology of the spermatozoon as a cause of infertility: the role of electron microscopy in the evaluation of semen quality,” Fertil. Steril., vol. 48, no. 5, pp. 711–734, 1987, doi: 10.1016/S0015-0282(16)59520-X.
[16] F. Boitrelle et al., “Large human sperm vacuoles observed in motile spermatozoa under high magnification: nuclear thumbprints linked to failure of chromatin condensation,” Hum. Reprod., vol. 26, no. 7, pp. 1650–1658, 2011, doi: 10.1093/HUMREP/DER129.
[17] H. E. Chemes and C. Alvarez Sedo, “Tales of the Tail and Sperm Head AchesChanging concepts on the prognostic significance of sperm pathologies affecting the head, neck and tail,” Asian J. Androl., vol. 14, no. 1, p. 14, Jan. 2012, doi: 10.1038/AJA.2011.168.
[18] P. Vanderzwalmen et al., “Blastocyst development after sperm selection at high magnification is associated with size and number of nuclear vacuoles,” Reprod. Biomed. Online, vol. 17, no. 5, pp. 617–627, Jan. 2008, doi: 10.1016/S1472-6483(10)60308-2.
[19] A. S. Setti, D. P. De Almeida Ferreira Braga, L. Vingris, R. De Cassia Savio Figueira, A. Iaconelli, and E. Borges, “The prevalence of sperm with large nuclear vacuoles is a prognostic tool in the prediction of ICSI success,” J. Assist. Reprod. Genet., vol. 31, no. 3, p. 307, 2014, doi: 10.1007/S10815-013-0157-0.
[20] A. Berkovitz, F. Eltes, A. Ellenbogen, S. Peer, D. Feldberg, and B. Bartoov, “Does the presence of nuclear vacuoles in human sperm selected for ICSI affect pregnancy outcome?,” Hum. Reprod., vol. 21, no. 7, pp. 1787–1790, Jul. 2006, doi: 10.1093/HUMREP/DEL049.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...
FACEBOOK








