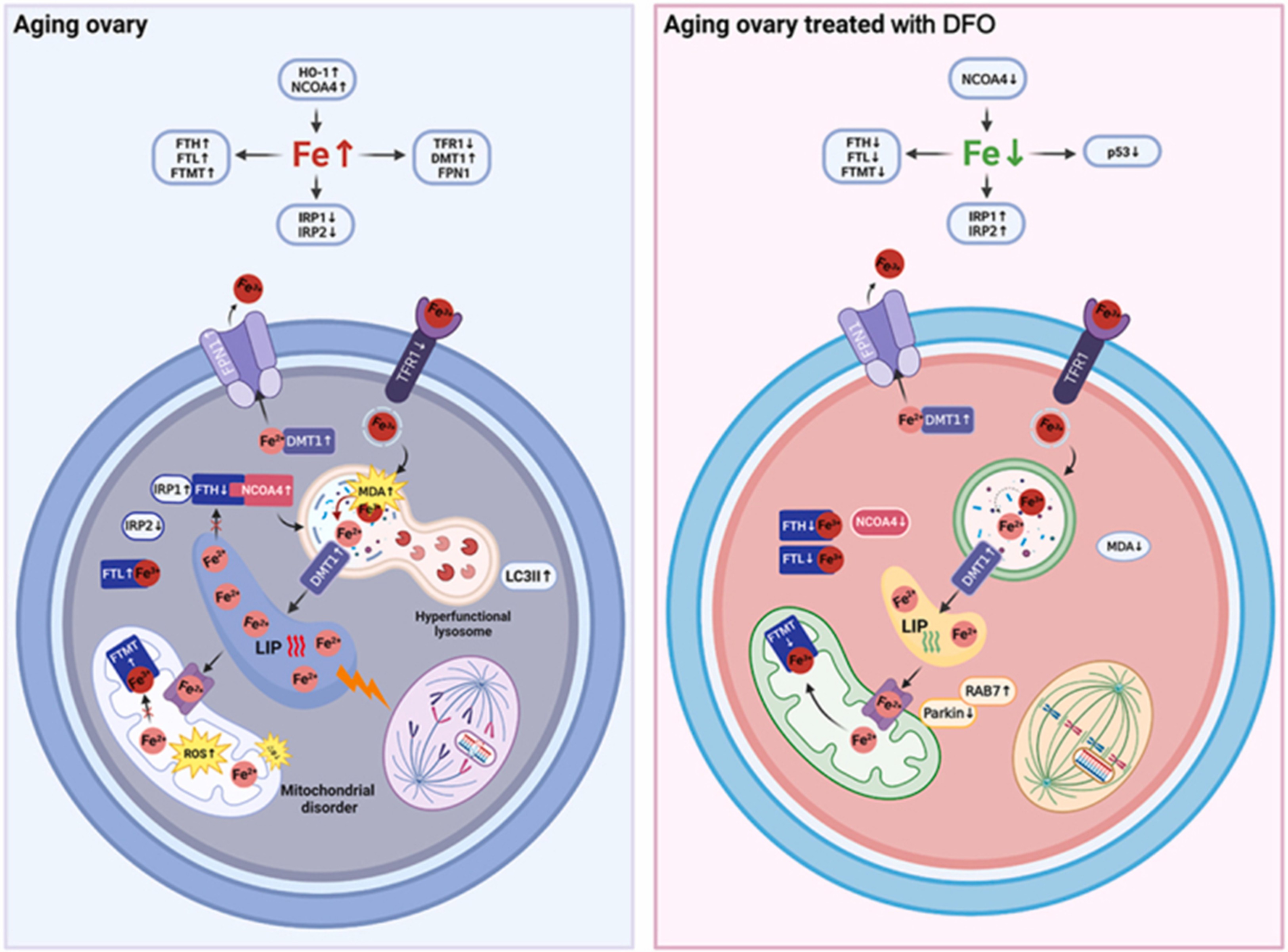
ThS. Hồ Lan Trâm - Bệnh viện Mỹ Đức
- Giới thiệu
Vô sinh là một vấn đề sức khỏe sinh sản toàn cầu, trong đó, yếu tố nam giới chiếm khoảng 20–30% các trường hợp [1]. Vô tinh là tình trạng nghiêm trọng trong vô sinh nam giới, được định nghĩa là tình trạng hoàn toàn không phát hiện tinh trùng trong tinh dịch sau khi ly tâm, và chia thành hai nhóm chính: vô tinh do tắc nghẽn (Obstructive azoospermia – OA) và vô tinh không do tắc nghẽn (non-obstructive azoospermia – NOA). Trong các trường hợp NOA, nguyên nhân thường liên quan đến suy giảm hoặc ngừng quá trình sinh tinh trong tinh hoàn. Hiện nay, lựa chọn điều trị chủ yếu cho nhóm bệnh nhân này là vi phẫu lấy tinh trùng từ tinh hoàn (Microdissection Testicular Sperm Extraction – mTESE). Tuy nhiên, tỷ lệ tìm thấy tinh trùng đạt khoảng 50%. Trong trường hợp thất bại với mTESE, bệnh nhân không còn lựa chọn nào khác ngoài việc sử dụng tinh trùng hiến tặng. Điều này không chỉ ảnh hưởng đến quyền có con sinh học của người nam, mà còn tạo ra những gánh nặng tâm lý và xã hội. Các liệu pháp tái tạo nhằm khôi phục khả năng sinh tinh có thể được tiếp cận theo hai hướng: in vivo và in vitro [2]. Các chiến lược in vivo, chẳng hạn như cấy ghép tế bào gốc sinh tinh trở lại tinh hoàn, đối mặt với nguy cơ tái đưa tế bào ác tính (ở bệnh nhân ung thư) cũng như khó kiểm soát vi môi trường sinh tinh. Ngược lại, các chiến lược tạo tinh trùng in vitro (In vitro spermatogenesis – IVS) cho phép kiểm soát chặt chẽ điều kiện nuôi cấy, tránh nguy cơ tái nhiễm tế bào ung thư và mở ra cơ hội nghiên cứu sâu cơ chế sinh tinh ở người, là một hướng tiếp cận đầy hứa hẹn.

Hình: Chiến lược tạo tinh trùng in vitro (In vitro spermatogenesis – IVS) [3]
- Quá trình sinh tinh ở người
Đây là một quá trình sinh học phức tạp, được kiểm soát chặt chẽ, diễn ra trong các ống sinh tinh của tinh hoàn. Quá trình này bắt đầu từ tế bào gốc sinh tinh (Spermatogonial stem cells – SSCs), trải qua các giai đoạn tăng sinh, giảm phân và cuối cùng là biệt hoá để hình thành tinh trùng trưởng thành. Sinh tinh đòi hỏi sự phối hợp tinh vi giữa nhiều loại tế bào, bao gồm tế bào Sertoli, tế bào Leydig, tế bào cơ quanh ống sinh tinh và các tín hiệu nội tiết như testosterone nội tinh hoàn, FSH và LH. Tế bào Sertoli đóng vai trò trung tâm trong việc tạo hàng rào máu – tinh hoàn, nuôi dưỡng và điều hòa sự phát triển của tế bào dòng mầm. Bất kỳ rối loạn nào trong vi môi trường này đều có thể dẫn đến suy sinh tinh hoặc vô tinh. Chính sự phức tạp này khiến việc tái tạo sinh tinh in vitro trở thành một thách thức lớn về mặt sinh học và công nghệ.
- Các hệ thống IVS hiện nay
3.1. Hệ thống nuôi cấy tế bào 2 chiều (2D)
Đây là phương pháp truyền thống, trong đó các tế bào phát triển thành một lớp đơn trên bề mặt phẳng như đĩa nuôi cấy hoặc bình nhựa. Hệ thống này đã được sử dụng rộng rãi để nuôi cấy và tăng sinh SSCs, thường kết hợp với tế bào feeder hoặc đồng nuôi với tế bào sinh dưỡng ở tinh hoàn [4]. Mặc dù một số nghiên cứu ghi nhận sự xuất hiện của tế bào dòng mầm đơn bội trong hệ thống 2D, phương pháp này vẫn tồn tại hạn chế lớn do thiếu cấu trúc không gian và tương tác tế bào – tế bào, dẫn đến quá trình biệt hóa không hoàn chỉnh. Cho đến nay, hệ thống 2D chưa thể tái tạo thành công toàn bộ quá trình sinh tinh ở người.
3.2. Hệ thống nuôi cấy 3 chiều (3D)
Để khắc phục hạn chế của nuôi cấy 2D, các hệ thống nuôi cấy ba chiều (3D) đã được phát triển nhằm mô phỏng tốt hơn kiến trúc và vi môi trường tự nhiên của tinh hoàn. Theo đó, nuôi cấy 3D có khả năng mô phỏng tốt hơn các tương tác vật lý giữa tế bào, sự tổ chức mô, quá trình truyền tín hiệu và chức năng của tế bào tinh hoàn [5]. Trong khung nuôi cấy 3D, các tế bào có thể bám dính và tương tác trực tiếp với nhau, qua đó hỗ trợ việc thực hiện các chức năng sinh học đặc hiệu như bám dính, tăng sinh và apoptosis.
Công nghệ in sinh học ba chiều (3D bioprinting) được xem là một giải pháp tiềm năng nhằm khắc phục những hạn chế này, nhờ khả năng sắp xếp chính xác các lớp tế bào và sử dụng các bioink mô phỏng chất nền ngoại bào cũng như vi môi trường sinh lý tự nhiên. Bên cạnh các phương pháp có scaffold, các kỹ thuật nuôi cấy 3D không sử dụng scaffold cũng đã được phát triển, điển hình là mô hình organoid 3D. Trong hệ thống này, các cấu trúc nâng đỡ không còn hiện diện; thay vào đó, các organoid được treo lơ lửng trong môi trường nuôi cấy và có khả năng tự tổ chức để hình thành các cấu trúc tương tự mô hoặc cơ quan.
Scaffold 3D
Scaffold 3D đóng vai trò là vật liệu sinh học và cấu trúc nâng đỡ cho sự phát triển của tế bào. Các cấu trúc nâng đỡ này có thể có nguồn gốc tự nhiên hoặc tổng hợp, phổ biến nhất là Matrigel, hydrogel, các giá đỡ cứng, cũng như các kỹ thuật chế tạo như đông khô (lyophilization), kéo sợi điện (electrospinning) và quang khắc lập thể (stereolithography) [5]. Các hệ thống scaffold 3D truyền thống cho phép tạo ra nhiều cấu trúc đa dạng về độ xốp, hình dạng và kích thước. Trong đó, Scaffold từ chất nền ngoại bào khử tế bào (Decellularized extracellular matrix – dECM), cho phép tái tạo cấu trúc tương tự ống sinh tinh. Nghiên cứu cho thấy scaffold dECM kết hợp với các yếu tố tăng trưởng có thể cải thiện khả năng sống và biệt hóa của SSCs [6].
Tuy nhiên, việc kiểm soát kiến trúc vi mô của scaffold cũng như sự phân bố đồng đều của tế bào bên trong cấu trúc vẫn là một thách thức lớn [7].
Nuôi cấy organotypic 3D
Mô hình này đã được chứng minh hiệu quả cao trong mô hình động vật, đặc biệt là trên chuột.
Một nghiên cứu tiêu biểu của tác giả Perrard và cộng sự (2016) đã thực hiện trên mô hình động vật và trên người trong mô hình nuôi cấy organotypic 3D. Trên chuột, các mẫu ống sinh tinh được lấy từ sinh thiết tinh hoàn đông lạnh hoặc tươi của chuột đực 8 hoặc 20 ngày tuổi, cũng như từ các bệnh nhân người trưởng thành, và nuôi cấy trong bioreactor dạng hình trụ rỗng được làm từ hydrogel chitosan. Trên người, mẫu tinh hoàn người được thu nhận từ bệnh nhân. Sau tối đa 60 ngày nuôi cấy trong môi trường DMEM/F12 có bổ sung, tinh tử xuất hiện từ ngày 25 và tinh trùng được ghi nhận vào khoảng ngày 55, với tỷ lệ lên đến 3,8% [8]. Tuy nhiên, vẫn chưa thể loại trừ khả năng các tế bào dòng mầm trưởng thành đã tồn tại sẵn trong mô trước nuôi cấy, do đó cần thêm các nghiên cứu lặp lại để xác nhận sinh tinh de novo.
Một nghiên cứu khác sử dụng mô tuyến sinh dục thai nhi người (12–19 tuần tuổi thai) nuôi cấy trong điều kiện giao diện khí–lỏng cũng ghi nhận tiềm năng hình thành cơ quan và sinh tinh. Tinh bào được quan sát từ ngày 10 và tinh tử tròn xuất hiện sau ngày 30, chiếm khoảng 7,2% quần thể tế bào. Các tinh tử này cho thấy khả năng thụ tinh hạn chế khi được tiêm vào noãn, với một phôi phát triển đến giai đoạn 8 tế bào và một phôi đạt giai đoạn phôi nang [9]. Mặc dù các kết quả này cho thấy tiềm năng của nuôi cấy organotypic 3D, tỷ lệ apoptosis cao và hiện tượng tăng tốc bất thường của quá trình sinh tinh cho thấy mô hình này vẫn cần được tối ưu hóa thêm trước khi hướng tới ứng dụng lâm sàng.
Organoid tinh hoàn 3D
Organoid tinh hoàn là cấu trúc 3D tự tổ chức từ các tế bào tinh hoàn, có khả năng tái tạo một phần vi môi trường sinh tinh và được xem là một hướng tiếp cận tiềm năng trong IVS. Các nghiên cứu bước đầu cho thấy organoid có thể duy trì hoạt động nội tiết và biểu hiện các dấu ấn biệt hóa của tế bào dòng mầm.
Trong nghiên cứu chứng minh nguyên lý, các organoid được tạo từ SSCs, tế bào Leydig và tế bào quanh ống sinh tinh có khả năng sản xuất testosterone và ghi nhận sự gia tăng biểu hiện DAZL cùng các dấu ấn hậu giảm phân, mặc dù chưa có bằng chứng rõ ràng về tiến trình giảm phân hoàn chỉnh [10]. Điều này cho thấy organoid có thể phần nào tái tạo sinh tinh in vivo, song vẫn cần tối ưu hóa điều kiện nuôi cấy. Các nghiên cứu khác cho thấy việc sắp xếp tế bào trong vi giếng hoặc sử dụng hydrogel lai agarose–laminin giúp cải thiện cấu trúc 3D, hỗ trợ sự sống sót và biệt hóa của SSCs; trong đó, tinh trùng có hình thái học đã được ghi nhận khi đồng nuôi cấy SSCs và tế bào Sertoli trong hydrogel lai [11]. Tuy nhiên, chất lượng giao tử và khả năng ứng dụng lâm sàng của các hệ thống organoid này vẫn cần được đánh giá thêm.
In sinh học 3D (3D bioprinting)
In sinh học 3D là một hướng tiếp cận mới, hướng đến việc tái tạo vi môi trường sinh tinh thích hợp thông qua in các cấu trúc mô được tạo từ tế bào người, mô phỏng chính xác kiến trúc tế bào của ống sinh tinh. Trong một nghiên cứu gần đây, các tế bào tinh hoàn người từ bệnh nhân NOA đã được in sinh học 3D thành các cấu trúc tương tự ống sinh tinh người. Các SSCs được nuôi cấy song song với tế bào soma, sau đó phối trộn với bioink alginate–collagen và nuôi cấy trong môi trường StemPro-34 trong 12 ngày. Tỷ lệ sống của tế bào sau in đạt khoảng 93,4%. Nhuộm miễn dịch huỳnh quang cho thấy sự hiện diện của các kiểu hình tế bào soma chủ yếu (Sertoli, Leydig, tế bào cơ quanh ống) và tế bào dòng mầm giảm phân trong suốt 12 ngày nuôi cấy. Phân tích RT-qPCR ghi nhận sự tăng biểu hiện các gen liên quan đến sinh tinh và duy trì SSCs, bao gồm FGFR3, KIT, STRA8, SYCP3, TNP1 và PRM2 [12]. Những kết quả này cho thấy in sinh học 3D có khả năng duy trì tính sống và chức năng của tế bào tinh hoàn người, qua đó mở ra tiềm năng ứng dụng trong nghiên cứu vô sinh và y học cá thể hóa. Tuy nhiên, các mô tinh hoàn được in sinh học vẫn cần được tối ưu hóa thêm để hỗ trợ biệt hóa hoàn chỉnh thành tinh trùng. Các hướng cải tiến được đề xuất bao gồm chức năng hóa bioink, hoàn thiện kiến trúc tế bào và tối ưu điều kiện nuôi cấy nhằm tăng cường tương tác tế bào–chất nền, vốn đóng vai trò thiết yếu trong việc duy trì ổ sinh tinh.
Hệ thống tinh hoàn trên chip (Testis on a chip -ToC)
Đây là một nền tảng 3D khác sử dụng công nghệ vi lưu nhằm mô phỏng vi môi trường tinh hoàn. Trong một nghiên cứu trên chuột của AbuMadighem và cộng sự (2022) trên các tế bào tinh hoàn được phân lập bằng enzyme từ ống sinh tinh, gieo trong gel methylcellulose và nuôi cấy trên chip vi lưu. Sau 7 tuần nuôi cấy, tỷ lệ sống của tế bào vượt quá 95% [13]. Tuy nhiên, phần lớn các nghiên cứu ToC hiện nay mới chỉ được thực hiện trên mô hình động vật, do đó cần thêm dữ liệu để khẳng định hiệu quả của hệ thống này trên người.
4. Thách thức kỹ thuật, sinh học và đạo đức
Các vấn đề cần giải quyết trước khi IVS có thể ứng dụng lâm sàng bao gồm: đảm bảo tính toàn vẹn nhiễm sắc thể, chất lượng DNA, lập trình biểu sinh của tinh trùng tạo ra in vitro, cũng như khả năng thụ tinh và phát triển phôi bình thường. Bên cạnh đó, các vấn đề đạo đức liên quan đến nguồn tế bào, sự đồng thuận của bệnh nhân, nguy cơ dài hạn cho thế hệ sau và khả năng tiếp cận công bằng với công nghệ mới cũng cần được cân nhắc kỹ lưỡng.
5. Kết luận
Những tiến bộ gần đây trong lĩnh vực sinh tinh in vitro đã mở ra một hướng đi mới đầy tiềm năng cho điều trị vô sinh nam, đặc biệt là các trường hợp NOA thất bại với các phương pháp hiện tại. Mặc dù còn nhiều thách thức về kỹ thuật, sinh học và đạo đức, IVS vẫn được xem là một chiến lược đầy triển vọng trong y học sinh sản và y học tái tạo. Sự hợp tác liên ngành giữa sinh học sinh sản, kỹ thuật mô và lâm sàng nam khoa sẽ đóng vai trò then chốt trong việc đưa IVS từ phòng thí nghiệm đến thực hành lâm sàng trong tương lai.
TÀI LIỆU THAM KHẢO
1. Harris, E., Infertility Affects 1 in 6 People Globally. Jama, 2023. 329(17): p. 1443.
2. Roshandel, E., et al., Cell-Based Therapy Approaches in Treatment of Non-obstructive Azoospermia. Reprod Sci, 2023. 30(5): p. 1482-1494.
3. Rahimian, N., et al., Advancing in vitro spermatogenesis: a comparative review of static and dynamic culture systems for reproductive biology and infertility treatmentAvances en la espermatogénesis in vitro: una revisión comparativa de los sistemas de cultivo estáticos y dinámicos para la biología reproductiva y el tratamiento de la infertilidad. Revista Internacional de Andrología, 2025. 23(3): p. 1-21.
4. Diao, L., et al., Roles of Spermatogonial Stem Cells in Spermatogenesis and Fertility Restoration. Front Endocrinol (Lausanne), 2022. 13: p. 895528.
5. Habanjar, O., et al., 3D Cell Culture Systems: Tumor Application, Advantages, and Disadvantages. Int J Mol Sci, 2021. 22(22).
6. Sun, M., et al., Efficient generation of functional haploid spermatids from human germline stem cells by three-dimensional-induced system. Cell Death Differ, 2018. 25(4): p. 749-766.
7. Bishop, E.S., et al., 3-D bioprinting technologies in tissue engineering and regenerative medicine: Current and future trends. Genes Dis, 2017. 4(4): p. 185-195.
8. Perrard, M.H., et al., Complete Human and Rat Ex Vivo Spermatogenesis from Fresh or Frozen Testicular Tissue. Biol Reprod, 2016. 95(4): p. 89.
9. Yuan, Y., et al., In vitro testicular organogenesis from human fetal gonads produces fertilization-competent spermatids. Cell Res, 2020. 30(3): p. 244-255.
10. Pendergraft, S.S., et al., Three-dimensional testicular organoid: a novel tool for the study of human spermatogenesis and gonadotoxicity in vitro. Biol Reprod, 2017. 96(3): p. 720-732.
11. Sakib, S., et al., Formation of organotypic testicular organoids in microwell culture†. Biol Reprod, 2019. 100(6): p. 1648-1660.
12. Robinson, M., et al., Using clinically derived human tissue to 3-dimensionally bioprint personalized testicular tubules for in vitro culturing: first report. F S Sci, 2022. 3(2): p. 130-139.
13. AbuMadighem, A., et al., Testis on a chip-a microfluidic three-dimensional culture system for the development of spermatogenesisin-vitro. Biofabrication, 2022. 14(3).