CNSH Liên Mỹ Dinh1, ThS. Đặng Thị Huyền Trang2, ThS.BS. Dương Công Bằng1
1 Bệnh viện Phụ sản Quốc tế Sài Gòn
2 Bệnh viện Mỹ Đức
I. GIỚI THIỆU
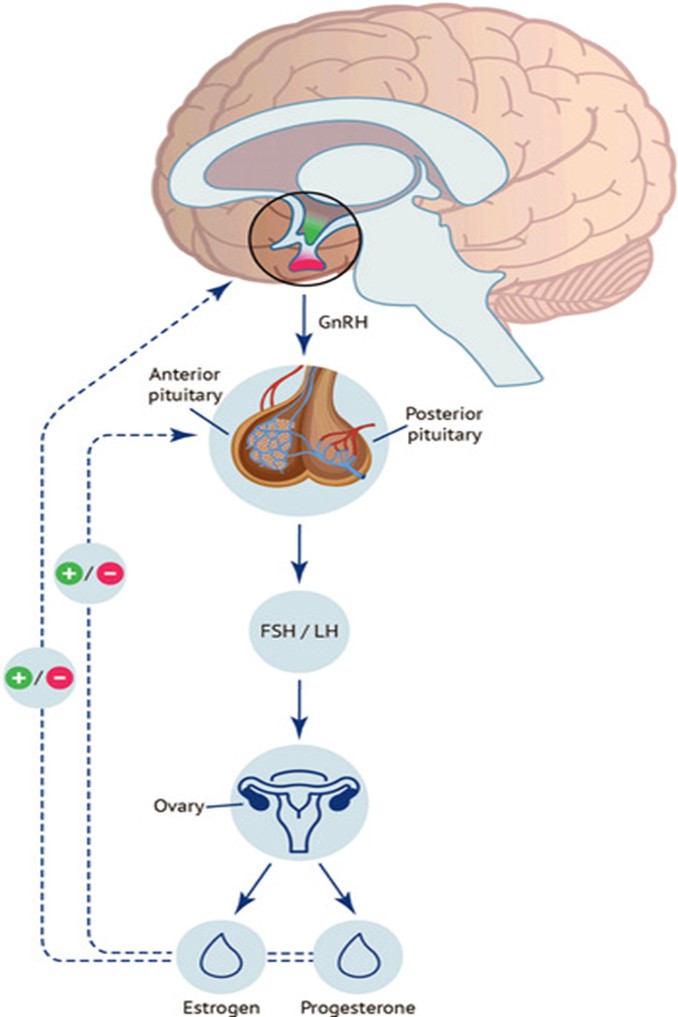
Hệ thống nội tiết đóng một vai trò rất quan trọng trong sinh lý nữ, giúp duy trì và ổn định quá trình sản xuất giao tử, thụ tinh và hình thành hợp tử. Hệ thống này thực hiện chức năng điều hoà sinh sản bằng cách kiểm soát chặt chẽ, nhịp nhàng hoạt động của các cơ quan, tạo thành một thể thống nhất gọi là trục sinh sản. Trục sinh sản bao gồm: vùng hạ đồi, tuyến yên và buồng trứng. Thông qua cơ chế phản hồi (feedback), trục hạ đồi – tuyến yên – buồng trứng kiểm soát sự tổng hợp và bài tiết hormone phù hợp. Sự điều hoà các hormone sinh sản này bắt đầu từ tuổi dậy thì, khi mà các hormone sinh dục (Estrogen và Progesterone) được sản xuất nhờ cơ chế feedback dương từ kích thích của gonadotropin - loại hormone glycoprotein được tiết ra chủ yếu bởi tuyến yên bao gồm hormone kích thích nang noãn (Follicle-Stimulating Hormone – FSH) và hormone tạo hoàng thể (Luteinizing Hormone – LH) [1]. Cơ chế điều hòa là khi nồng độ estradiol (E2) thấp có tác động không đáng kể đến sự tiết LH nhưng lại có xu hướng ức chế sự tiết FSH. Ngược lại, nồng độ E2 tăng cao lại là yếu tố kích hoạt sự tăng vọt LH (LH surge) vào giữa chu kỳ trước khi rụng trứng ở nữ, trong khi nồng độ E2 cao và ổn định lại duy trì sự tiết LH ở mức cao. Những thay đổi nồng độ hormone theo chu kỳ này sẽ giúp cân bằng sự tiết FSH/LH từ đó duy trì khả năng sinh sản ở nữ giới [1].
Trong hỗ trợ sinh sản (HTSS), việc kích thích buồng trứng (KTBT) có kiểm soát (Controlled Ovarian Stimulation – COS) sử dụng gonadotropin giúp phát triển nhiều nang noãn trưởng thành cùng lúc, tăng số lượng noãn thu hồi thay vì chỉ một nang trưởng thành như trong chu kỳ tự nhiên. Các nghiên cứu đều chỉ ra rằng nồng độ E2 trong các chu kỳ IVF có thể tăng gấp hơn 10 lần so với các chu kỳ tự nhiên, cụ thể hơn là nồng độ E2 huyết thanh đạt mức 500–10.000 pg/mL trong chu kỳ COS so với mức E2 chỉ là 200–400 pg/mL trong các chu kỳ tự nhiên – đây mức E2 thích hợp giúp duy trì khả năng tiếp nhận của nội mạc tử cung (NMTC) [2] [3] [4]. Việc nồng độ E2 tăng cao tại thời điểm chọc hút có tác động tới kết quả điều trị của chu kỳ HTSS đã được thực hiện trong nhiều nghiên cứu trước đây nhưng vẫn còn tồn tại nhiều mâu thuẫn. Mục tiêu của bài báo này nhằm tổng hợp lại các nhận định về nồng độ E2 tại thời điểm chọc hút đến kết quả điều trị của chu kỳ HTSS để từ đó đưa ra góc nhìn giúp cải thiện kết quả điều trị cho bệnh nhân.
II. CƠ SỞ SINH HỌC VÀ CƠ CHẾ TÁC ĐỘNG
Quá trình sản xuất Estradiol
Estradiol được tạo ra thông qua con đường bài tiết hai tế bào vào đầu chu kỳ kinh nguyệt. Vào lúc này, sự tăng nồng độ FSH là yếu tố kích thích sự phát triển và biệt hoá của các tế bào hạt trong nang noãn. Các enzyme sinh tổng hợp steroids ở các tế bào hạt được kích thích bởi FSH cũng kích thích sự hiện diện các thụ thể LH trên tế bào vỏ. LH sau đó kích thích các tế bào vỏ sản xuất androgen – là một tiền chất của E2. Androgen sẽ được chuyển hoá thành E2 bởi các enzyme được biểu hiện ở các tế bào hạt dưới ảnh hưởng của FSH. Nồng độ E2 tăng cao sau đó sẽ ức chế sự tiết FSH, tạo ra một feedback âm. Nang noãn trội tiếp tục phát triển nhờ nồng độ thụ thể FSH tăng cao, trong khi các nang noãn thứ cấp có ít thụ thể FSH hơn sẽ trải qua quá trình thoái triển (atresia) [1]. Tóm lại, E2 được tiết ra chủ yếu từ các tế bào hạt của nang buồng trứng trong pha nang noãn của chu kỳ kinh nguyệt, đạt đỉnh vào thời điểm rụng trứng trước khi LH tăng vọt, sau đó sẽ giảm và duy trì ở mức ổn định [4]. E2 có thể được định lượng thông qua nguồn E2 trong dịch nang noãn (Follicular Fluid – FF) thu được trong quá trình chọc hút trứng hoặc trong huyết thanh (E2 huyết thanh). Hiện nay việc định lượng nồng độ E2 chủ yếu được thực hiện thông qua nồng độ E2 trong huyết thanh. Nghiên cứu của Yan và cộng sự (2020) đã chỉ ra rằng nồng độ E2 huyết thanh vào ngày chọc hút thấp hơn 400 lần so với nồng độ của chúng trong dịch nang noãn. Tuy nhiên, nhược điểm của định lượng E2 trong FF là quy trình định lượng, pha loãng hoá chất tương đối phức tạp, dễ dẫn đến sai số [5].
Sự tác động của estradiol đến sự hình thành và phát triển nang noãn
Nhiều nghiên cứu cho rằng nồng độ E2 và Progesterone cao hơn trong dịch nang dẫn đến số noãn thu được ít hơn đáng kể. Tuy nhiên, điều này chỉ được quan sát thấy ở phụ nữ lớn tuổi. Trong nghiên cứu của Aslih và cộng sự (2021) trên 2461 noãn thu được từ 391 bệnh nhân nhận thấy rằng ở những bệnh nhân lớn tuổi, dự trữ buồng trứng (DTBT) giảm, điều trị với liều gonadotropin cao thì mức E2/MII > 204, cho kết quả phôi học và kết cục lâm sàng kém hơn so với nhóm phụ nữ trẻ tuổi [6]. Ở phụ nữ lớn tuổi, DTBT giảm, sự chuyển hoá nang noãn, các chất chuyển hoá trong dịch nang và sự sản xuất steroids khác biệt so với phụ nữ trẻ tuổi, gây ra sự suy giảm phát triển nang noãn và phôi sau đó. Ngoài ra, do những thay đổi về các hoạt động chuyển hoá và sản xuất hormones steroid dẫn đến sự thiếu biệt hóa để đáp ứng với đỉnh LH ở những phụ nữ lớn tuổi nên mặc dù nồng độ E2 huyết thanh cao nhưng số lượng, chất lượng noãn và phôi thu được lại kém hơn so với phụ nữ trẻ tuổi [6] [7]. Bên cạnh đó, nồng độ E2 cao còn cho thấy ảnh hưởng đến chu kỳ tế bào. Cũng trong nghiên cứu của Aslih và cộng sự (2021) cho thấy khi nồng độ E2 ở mức thấp (E2/MII < 204) dẫn đến noãn hoàn thành giảm phân II nhanh hơn, tuy nhiên phôi lại chậm hơn trong suốt quá trình phân chia tại t7 – t8; đây là khoảng thời gian phôi thực hiện xong lần phân chia thứ 7 và thứ 8. Các nghiên cứu đã đưa ra giả định về sự phân chia tế bào chậm hơn tương quan với thời gian sửa chữa tế bào lâu hơn, dẫn đến phôi chất lượng cao hơn và có thể là yếu tố dự đoán khả năng làm tổ. Thời gian sửa chữa lâu hơn là thời gian phôi cần ở các giai đoạn tế bào tổng hợp DNA để có thể tổng hợp nên các phân tử có cấu trúc ổn định, từ đó tạo nên một chu kỳ tế bào hiệu quả [6]. Nghiên cứu của Voros và cộng sự (2025) cho thấy việc kích thích gonadotropin quá mức trong quá trình điều trị HTSS dẫn đến nồng độ hormone tăng cao cũng sẽ gây ra stress oxy hoá tế bào (Oxidative Stress – OS) gây mất cân bằng giữa nồng độ các gốc oxy hóa (Reactive Oxygen Species – ROS) và hệ thống chống oxy hoá theo hướng tiêu cực. Sự hình thành nang noãn và phóng noãn bình thường diễn ra ở mức ROS tối ưu nên khi OS quá mức có thể dẫn đến phân mảnh DNA, làm suy yếu tính toàn vẹn của thoi vô sắc, và kích hoạt quá trình chết tế bào theo chương trình (apoptosis) trong các tế bào cumulus và tế bào hạt. Những tổn thương phân tử này làm suy giảm sự trưởng thành nhân và tế bào chất, từ đó ảnh hưởng đến khả năng thụ tinh và sự phát triển của phôi [8].
III. ẢNH HƯỞNG CỦA NỒNG ĐỘ E2 ĐẾN KẾT QUẢ PHÔI HỌC
Kỹ thuật hỗ trợ sinh sản (Assisted Reproductive Technology - ART) đã trở thành phương pháp điều trị được lựa chọn trong các trường hợp vô sinh nữ và vô sinh nam. Việc sử dụng ART đang ngày càng tăng và số lượng chu kỳ IVF/ICSI cũng đã tăng theo cấp số nhân trong thập kỷ qua [9]. Thụ tinh trong ống nghiệm sử dụng phương pháp KTBT có kiểm soát giúp tạo ra nhiều nang noãn trội trong buồng trứng và thu được một lượng lớn noãn trưởng thành trong chu kỳ, do đó tăng cơ hội thành công của điều trị. Vì E2 được tiết ra chủ yếu từ các tế bào hạt của nang noãn, nên nồng độ estradiol huyết thanh cũng sẽ tăng đáng kể trong suốt quá trình điều trị bằng COS do thu được nhiều nang noãn cùng lúc. Do đó, theo dõi nồng độ E2 huyết thanh trở thành chỉ số quan trọng giúp đánh giá đáp ứng buồng trứng, đồng thời hỗ trợ dự đoán nguy cơ hội chứng quá kích buồng trứng (Ovarian Hyperstimulation Syndrome - OHSS). Mức estradiol tối ưu cũng giữ vai trò thiết yếu trong quá trình chuẩn bị NMTC cho sự làm tổ của phôi, bao gồm kích thích tăng sinh nội mạc, cải thiện tưới máu và duy trì tính tiếp nhận của nội mạc. Tuy nhiên, nồng độ E2 quá cao tại thời điểm làm tổ có thể làm giảm khả năng tiếp nhận NMTC, gây ra sự không đồng bộ giữa sự phát triển của phôi và nội mạc, làm thay đổi cửa sổ làm tổ và ảnh hưởng tiêu cực đến kết cục thai kỳ, đặc biệt trong các chu kỳ chuyển phôi tươi ngày 5 sau chọc hút noãn [10] [11]. Các bằng chứng về tác động của nồng độ E2 trong các chu kỳ IVF-ICSI đối với kết quả mang thai như chất lượng noãn, tỉ lệ thụ tinh, chất lượng phôi, khả năng làm tổ và thai lâm sàng vẫn còn mâu thuẫn. Vậy, nồng độ E2 tại thời điểm chọc hút có thể là một chỉ số để dự đoán hiệu quả của một chu kỳ điều trị HTSS hay không?
Số lượng noãn thu được
Theo nghiên cứu của Pillai và cộng sự (2019) đã chia đối tượng nghiên cứu thành bốn nhóm theo nồng độ estradiol huyết thanh vào ngày kích thích rụng trứng (tiêm hCG): Nhóm I: <2.000 pg/ml, Nhóm II: 2.000-3.000 pg/ml, Nhóm III: 3.000-4.000 pg/ml và Nhóm IV: >4.000 pg/ml. Kết quả cho thấy là số lượng noãn thu được ở nhóm 4 cao hơn đáng kể so với các nhóm khác. Tổng số noãn trưởng thành tăng đáng kể từ nhóm 1 đến nhóm 4 cho thấy mối tương quan thuận giữa nồng độ E2 và số lượng noãn thu được [4]. Điều này cũng tương quan trong các nghiên cứu khác. Nghiên cứu Joo và cộng sự (2010) đã thực hiện nghiên cứu hồi cứu về nồng độ E2 vào ngày tiêm hCG và kết quả cho thấy trong 455 chu kỳ IVF chuyển phôi tươi (fresh embryo transfer - ET) thì số lượng noãn thu được cao hơn đáng kể ở nhóm có nồng độ E2 trong huyết thanh > 4.000 pg/ml (15,3 ± 6,6) so với các nhóm khác [12]. Hay Kara và cộng sự (2012) cũng đã thực hiện một nghiên cứu cắt ngang về mối liên quan giữa nồng độ E2 trong huyết thanh vào ngày tiêm hCG với kết quả IVF/ICSI và nhận ra rằng những phụ nữ có nồng độ E2 > 4.000 pg/ml có số lượng noãn thu được cao hơn đáng kể (17,2 ± 4,4) so với các nhóm khác [13]. Các bằng chứng nhất quán từ nhiều nghiên cứu cho thấy nồng độ estradiol huyết thanh cao vào ngày tiêm hCG, đặc biệt > 4.000 pg/mL, có liên quan chặt chẽ với số lượng noãn thu được và số noãn trưởng thành cao hơn. Điều này phản ánh rằng nồng độ E2 tăng tương ứng với mức độ đáp ứng buồng trứng trong chu kỳ KTBT có kiểm soát. Tuy nhiên, mối liên quan này chỉ phản ánh số lượng noãn, không đồng nghĩa với cải thiện chắc chắn về chất lượng noãn hay kết quả thai kỳ, do đó cần đánh giá thận trọng khi diễn giải trên lâm sàng.
Tỉ lệ thụ tinh
Mặc dù các nhóm bệnh nhân có nồng độ estradiol cao vào ngày tiêm hCG có xu hướng thu được nhiều noãn và noãn trưởng thành hơn, song nhiều nghiên cứu cho thấy tỉ lệ thụ tinh không bị ảnh hưởng đáng kể bởi mức E2. Trong nghiên cứu của Wu và cộng sự (2007) trên 274 chu kỳ IVF, bệnh nhân được chia thành năm nhóm theo mức E2 vào ngày trigger. Kết quả cho thấy mặc dù nhóm 5 (> 5.000 pg/mL) thu được số lượng noãn nhiều hơn, tỉ lệ thụ tinh và tỉ lệ tạo phôi ngày 3 vẫn tương đương giữa các nhóm, không có sự khác biệt có ý nghĩa thống kê giữa năm nhóm này [14]. Kết quả cũng được ghi nhận bởi Mittal và cộng sự (2014), khi tính nồng độ E2 trên mỗi nang noãn trưởng thành có đường kính >14 mm thì vẫn không khác biệt giữa các mức E2, khẳng định rằng nồng độ estradiol dù cao hay thấp đều không ảnh hưởng đáng kể đến khả năng thụ tinh [15]. Điều này tương đương với nghiên cứu của Pillai và cộng sự (2019) trong đó tỉ lệ thụ tinh giữa bốn nhóm (<2.000 pg/ml, 2.000-3.000 pg/ml, 3.000-4.000 pg/ml, >4.000 pg/ml) đều không khác biệt có ý nghĩa thống kê, cho thấy E2 tăng chủ yếu phản ánh mức đáp ứng buồng trứng hơn là ảnh hưởng chất lượng noãn hay khả năng thụ tinh [4].
Tỉ lệ phôi chất lượng tốt
Tỉ lệ thụ tinh là tương đương giữa tất cả các nhóm và không có sự khác biệt có ý nghĩa thống kê. Tuy nhiên, có sự gia tăng đáng kể phôi chất lượng tốt (loại A+B) khi nồng độ E2 tăng vào ngày tiêm trigger và số lượng phôi loại B lại cao hơn đáng kể ở nhóm E2 cao (số lượng phôi loại A lại tăng không đáng kể từ nhóm E2 thấp nhất đến cao nhất). Điều này dẫn đến tổng số phôi chất lượng tốt (loại A+B) cao nhất ở nhóm E2 cao (p = 0,009) [4]. Các nghiên cứu trước đây đều cho thấy rằng, nồng độ E2 tăng cao có liên quan đến số lượng noãn và phôi nhiều hơn, cũng như phôi chất lượng tốt, cho thấy đáp ứng buồng trứng quá mức không làm ảnh hưởng đến chất lượng noãn và phôi, đặc biệt trong các chu kỳ hiến noãn hoặc các chu kỳ có đáp ứng mạnh [16].
Trái ngược với các kết quả trên, một số bằng chứng sinh học phân tử cho rằng nồng độ E2 tăng quá mức có thể ảnh hưởng tiêu cực đến sự phát triển của noãn. Nghiên cứu của Sreerangaraja và cộng sự (2020) cho thấy nồng độ E2 cao có thể thay đổi hoạt động ty thể của tế bào hạt, làm rối loạn quá trình tổng hợp steroid và từ đó ảnh hưởng đến trưởng thành noãn, gián tiếp làm giảm chất lượng phôi [17]. Những nghiên cứu gần đây của Liu (2025) và Yan (2025) cũng báo cáo rằng mặc dù nhóm có E2 cao thu được số lượng noãn và noãn trưởng thành nhiều hơn, tỉ lệ phôi hữu dụng lại thấp hơn so với nhóm có nồng độ E2 thấp hơn [18], [19]. Tóm lại, E2 cao mang lại số lượng phôi nhiều hơn, nhưng tác động lên chất lượng phôi vẫn còn gây tranh cãi. Các dữ liệu hiện tại cho thấy “nhiều phôi” không đồng nghĩa với “phôi tốt hơn”, và E2 cao không thể được xem là chỉ dấu độc lập của chất lượng phôi.
IV. ẢNH HƯỞNG CỦA NỒNG ĐỘ E2 ĐẾN KẾT QUẢ LÂM SÀNG
Nồng độ estradiol vào ngày tiêm trigger được xem là một trong các chỉ dấu phản ánh mức độ đáp ứng buồng trứng trong chu kỳ kích thích, tuy nhiên ảnh hưởng của nó lên kết cục lâm sàng vẫn còn nhiều tranh luận. Trong nghiên cứu của Pillai và cộng sự (2019), tỉ lệ mang thai cộng dồn tăng dần từ nhóm E2 thấp đến trung bình nhưng giảm trở lại ở nhóm có E2 cao nhất (>4.000 pg/mL). Mặc dù số lượng noãn và số phôi chuyển tăng dần theo nồng độ E2, tỉ lệ làm tổ lại thấp nhất ở nhóm E2 cao, cho thấy nồng độ E2 cao không mang lại lợi ích về kết quả lâm sàng [4]. Xu hướng này tương tự trong nghiên cứu của Wang và cộng sự (2023), khi nhóm bệnh nhân có E2 ≥ 5.000 pg/mL cho thấy tỉ lệ thai lâm sàng và tỉ lệ trẻ sinh sống thấp hơn so với nhóm E2 < 1.000 pg/mL trong các chu kỳ chuyển phôi tươi, mặc dù sự khác biệt không có ý nghĩa thống kê [3].
Các bằng chứng mới hơn tiếp tục cho thấy nồng độ E2 cao có thể ảnh hưởng tiêu cực đến kết quả làm tổ của phôi, đặc biệt khi chuyển phôi nang. Nghiên cứu của Meng và cộng sự (2023) cho thấy ở các chu kỳ chuyển phôi tươi, nồng độ E2 > 4.000 pg/mL không ảnh hưởng đến tỉ lệ có thai lâm sàng (clinical pregnancy rate - CPR) ở phôi ngày 3, nhưng làm giảm đáng kể CPR ở phôi nang (OR hiệu chỉnh = 0,43; p = 0,039) [2]. Nguyên nhân gây ra sự khác biệt về kết quả giữa phôi tươi ở giai đoạn phân chia và phôi nang vẫn chưa rõ ràng. Một trong những cơ chế có thể là tình trạng siêu sinh lý sau COS, làm tăng thời gian làm tổ, do đó làm giảm khả năng tiếp nhận của NMTC trong ngày thứ năm sau khi lấy noãn. Việc kích hoạt cửa sổ làm tổ một phần có tác động trực tiếp đến sự làm tổ của phôi nang nhưng lại ít hoặc không ảnh hưởng đến giai đoạn phôi phân chia dẫn đến nồng độ E2 sẽ có tác động lớn hơn đến CPR của phôi nang khi chuyển phôi tươi [20].
Với bằng chứng cho đến hiện tại, chỉ ra rằng đối với những bệnh nhân trải qua IVF/ICSI với phác đồ KTBT kéo dài, khi nồng độ E2 huyết thanh vào ngày trigger đạt hoặc vượt quá 5.000 pg/mL, tỉ lệ mang thai lâm sàng giảm đáng kể, đặc biệt ở những bệnh nhân được chuyển phôi nang. Đồng thời, nguy cơ OHSS từ trung bình đến nặng tăng rõ rệt ở những bệnh nhân trên. Tại thời điểm này, đối với những bệnh nhân như vậy, việc bảo quản đông lạnh phôi theo chỉ định có thể là lựa chọn ưu tiên [20].
V. KẾT LUẬN
Ảnh hưởng của nồng độ E2 vào ngày tiêm mũi rụng trứng lên chất lượng noãn, phôi, khả năng tiếp nhận nội mạc tử cung và ngưỡng nồng độ estradiol ảnh hưởng đến kết quả IVF vẫn còn gây tranh cãi. Tổng hợp các bằng chứng hiện tại cho thấy nồng độ E2 cao vào ngày tiêm hCG, đặc biệt ≥ 4.000 – 5.000 pg/mL, có thể làm giảm khả năng làm tổ và tỉ lệ thai lâm sàng trong chu kỳ chuyển phôi tươi, nhất là với phôi nang, đồng thời làm tăng nguy cơ OHSS. Mặc dù E2 cao phản ánh đáp ứng buồng trứng mạnh, nhưng lại gây suy giảm khả năng tiếp nhận nội mạc tử cung, dẫn đến kết quả lâm sàng kém. Vì vậy, trong các trường hợp E2 tăng quá mức, chiến lược trữ phôi toàn bộ và chuyển phôi trong chu kỳ FET được xem là tối ưu hơn để cải thiện kết cục thai kỳ và đảm bảo an toàn cho bệnh nhân.
Từ khóa: Estradiol/ hormone/ kích thích buồng trứng có kiểm soát/COS/kết quả điều trị.
TÀI LIỆU THAM KHẢO
(1) Girsh, E. (2021). A textbook of clinical embryology. Cambridge University Press.
(2) Meng, Y., Tao, L., Xia, T., Zhu, J., Lin, X., Zhou, W., ... & Xing, W. (2023). Elevated estradiol levels on hCG trigger day adversely effects on the clinical pregnancy rates of blastocyst embryo transfer but not cleavage-stage embryo transfer in fresh cycles: a retrospective cohort study. PeerJ, 11, e15709.
(3) Wang, M., Jin, L., Shi, J., Mao, Y., Zhang, C., Huang, R., & Liang, X. (2023). Estradiol on trigger day: Irrelevant to live birth rates of fresh cycles but positively associated with cumulative live birth rates. International Journal of Gynecology & Obstetrics, 163(2), 627-638.
(4) Pillai, A., Fessylouis, T., Ramesh, P., Parvathy, T., & Aparna, N. (2019). Serum estradiol level on the day of ovulation trigger and pregnancy outcomes in in-vitro fertilisation-intracytoplasmic sperm injection cycles. International Journal of Reproduction, Contraception, Obstetrics and Gynecology, 8(10), 3835.
(5) Lv, Y., Du, S., Huang, X., & Hao, C. (2020). Follicular fluid estradiol is an improved predictor of in vitro fertilization/intracytoplasmic sperm injection and embryo transfer outcomes. Experimental and Therapeutic Medicine, 20(6), 131.
(6) Aslih, N., Michaeli, M., Mashenko, D., Ellenbogen, A., Lebovitz, O., Atzmon, Y., & Shalom-Paz, E. (2021). More is not always better–lower estradiol to mature oocyte ratio improved IVF outcomes. Endocrine Connections, 10(2), 146-153.
(7) Pacella L, Zander-Fox DL, Armstrong DT & Lane M. Women with reduced ovarian reserve or advanced maternal age have an altered follicular environment. Fertility and Sterility 2012 98 986–94.e1. (https://doi.org/10.1016/j.fertnstert.2012.06.025).
(8) Voros, C., Athanasiou, D., Papapanagiotou, I., Mavrogianni, D., Varthaliti, A., Bananis, K., ... & Daskalakis, G. (2025). Cracking the code of oocyte quality: The oxidative stress link to IVF success. International Journal of Molecular Sciences, 26(13), 6377.
(9) De Geyter C. 2019. Assisted reproductive technology: impact on society and need for surveillance. Best Practice & Research Clinical Endocrinology & Metabolism 33:3–8 DOI 10.1016/j.beem.2019.01.004).
(10) Li L, Wang P, Liu S, Bai X, Zou B, Li Y. Transcriptome sequencing of endometrium revealed alterations in mRNAs and lncRNAs after ovarian stimulation. J Assist Reprod Genet. 2020;37(1):21- 32.
(11) Manvelyan E, Houshdaran S, Irwin JC, Giudice LC, Aghajanova L. 2022. Patterns of sex hormone receptor expression in stimulated endometrium from oocyte donors.Human Fertility 25:662–669 DOI 10.1080/14647273.2021.1871783.
(12) Joo BS, Park SH, An BM, Kim KS, Moon SE, Moon HS. Serum estradiol levels during controlled ovarian hyperstimulation influence the pregnancy outcome of in vitro fertilization in a concentration-dependent manner. Fertil Steril. 2010;93:442-6.
(13) Kara M, Kutlu T, Sofuoglu K, Devranoglu B, Cetinkaya T. Association between serum estradiol level on the hCG administration day and IVF-ICSI outcome. Iran J Reprod Med. 2012;10:53-8.
(14) Wu CH, Kuo TC, Wu HH, Yeh GP, Tsai HD. High serum estradiol levels are not detrimental to in vitro fertilization outcome. Taiwan J Obstet Gynecol. 2007;46:54-9.
(15) Mittal S, Gupta P, Malhotra N, Singh N. Serum estradiol as a predictor of success of in vitro fertilization. J Obstet Gynaecol India. 2014;64:124-9.
(16) Ng EH, Lau EY, Yeung WS, Ho PC. Oocyte and embryo quality in patients with excessive ovarian response during in vitro fertilization treatment. J Assist Reprod Genet. 2003;20(5):186-91.
(17) Sreerangaraja Urs DB, Wu WH, Komrskova K, et al. Mitochondrial function in modulating human granulosa cell steroidogenesis and female fertility. Int J Mol Sci. 2020;21(10):3592. doi: 10.3390/ijms21103592.
(18) Liu, Y., Li, S., Wang, T., Zhang, S., Li, Y., Lin, X., Zhou, W., Ou, J., & Xing, W. (2025). Impact of Elevated Oestrogen Levels on hCG Trigger Day on Clinical Pregnancy Outcome and OHSS Incidence in Long-Acting GnRHa Down-Regulated IVF/ICSI-ET Cycles. Patient Preference and Adherence, 19, 167–176.
(19) Yan, Y., Jiang, J., Mei, J., Shen, X., Jiang, Y., Xing, J., & Huang, C. (2025). Impact of Elevated Oestrogen Levels on hCG Trigger Day on Clinical Pregnancy Outcome and OHSS Incidence in Long-Acting GnRHa Down-Regulated IVF/ICSI-ET Cycles. International Journal of Women's Health, 2075-2084.
(20) Wei D, Liu JY, Sun Y, Shi Y, Zhang B, Liu JQ, Tan J, Liang X, Cao Y, Wang Z, Qin Y, Zhao H, Zhou Y, Ren H, Hao G, Ling X, Zhao J, Zhang Y, Qi X, Zhang L, Deng X, Chen X, Zhu Y, Wang X, Tian LF, Lv Q, Ma X, Zhang H, Legro RS, Chen ZJ. 2019. Frozen versus fresh single blastocyst transfer in ovulatory women: a multicentre, randomised controlled trial. Lancet 393:1310–1318 DOI 10.1016/S0140-6736(18)32843-5.