CNSH. Phan Thị Thanh Loan - Bệnh viện đa khoa Mỹ Đức Tân Bình
Giới thiệu
Trong quá trình phát triển nang noãn, noãn bào và các tế bào cumulus bao quanh tạo thành phức hợp cumulus noãn bào (cumulus-oocyte complex, COC), sự tương tác tế bào trong COC đóng vai trò quyết định chất lượng noãn và quá trình rụng trứng. Các cấu trúc như TZP (transzonal projections) và các liên kết khe (gap junctions) đảm nhiệm việc cung cấp chất dinh dưỡng, hỗ trợ chuyển hóa và trung gian cho nhiều con đường điều hòa tín hiệu. Bên cạnh đó, các yếu tố do noãn bào tiết ra như GDF9 và BMP15 góp phần duy trì cân bằng nội môi của nang noãn. Gần đây, nhiều cơ chế mới đã được phát hiện như: sự tham gia của các túi ngoại bào, vi nhung mao và hiện tượng dung hợp màng tế bào cho thấy sự chia sẻ bào tương giữa noãn bào và tế bào cumulus. Những phát hiện này không chỉ mở rộng hiểu biết về sinh lý sinh sản mà còn mở ra các hướng tiếp cận mới trong nghiên cứu bệnh lý sinh sản và tối ưu hóa hệ thống nuôi cấy. Do đó, tổng quan này cập nhật những hiểu biết hiện tại về cơ chế tương tác giữa các tế bào, chức năng của COC và ứng dụng trong nuôi cấy trưởng thành noãn.
Các cấu trúc tham gia tương tác trong COC
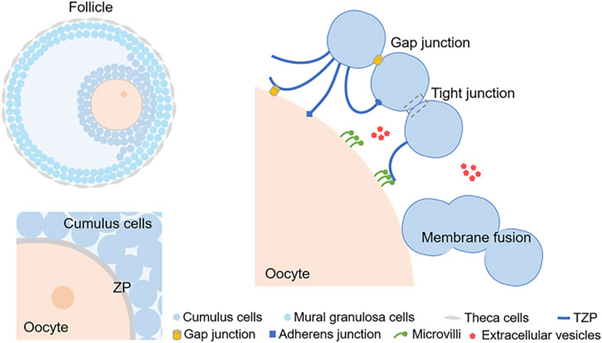
Sự giao tiếp chức năng giữa noãn bào và tế bào cumulus được duy trì nhờ một hệ thống cấu trúc chuyên biệt, cho phép tiếp xúc trực tiếp và trao đổi tín hiệu liên tục trong suốt quá trình phát triển nang noãn. Cấu trúc này là các nhánh xuyên bào tương (transzonal projections, TZP), được hình thành từ tế bào cumulus để tiếp xúc trực tiếp với noãn bào. Về mặt cấu trúc, TZP chủ yếu là các filopodia giàu F-actin, xuất hiện sớm từ giai đoạn nang sơ cấp và được duy trì trong suốt quá trình hình thành và phát triển nang noãn. Các nghiên cứu hình ảnh ba chiều cho thấy chỉ một phần TZP tiếp xúc trực tiếp với noãn bào, trong khi phần lớn tạo thành mạng lưới liên kết giữa các tế bào cumulus, góp phần tổ chức không gian và ổn định cấu trúc của COC [1].
Tại các vị trí TZP tiếp xúc với noãn bào, các liên kết khe (gap junctions) được hình thành từ connexin đặc hiệu, chủ yếu là CX37, CX43 tạo điều kiện cho sự trao đổi trực tiếp các phân tử giữa noãn bào và tế bào cumulus. Ngoài liên kết khe, các liên kết bám dính và liên kết chặt cũng đã được ghi nhận trong COC, cho thấy sự tồn tại của một hệ thống liên kết màng bào tương noãn đa dạng, dù vai trò sinh học cụ thể của các liên kết này trong điều hòa chức năng noãn vẫn cần được làm sáng tỏ thêm.
Bên cạnh TZP, vi nhung mao của noãn bào đóng vai trò quan trọng trong việc mở rộng diện tích tiếp xúc và tổ chức các vùng tương tác với tế bào cumulus. Hình thái và sự phân bố của vi nhung mao thay đổi theo giai đoạn giảm phân, phản ánh trạng thái chức năng của noãn bào. Các TZP thường tiếp xúc đồng thời với nhiều vi nhung mao, tạo nên các vùng tiếp xúc đặc hiệu nhưng không hình thành liên kết khe, cho thấy sự đa dạng về hình thức giao tiếp cấu trúc trong COC. Các nghiên cứu theo dõi huỳnh quang nội sinh cho thấy vi nhung mao có hình dạng giống nấm, gồm một trục mảnh và đầu phình dạng túi, được hình thành dần trong quá trình phát triển nang noãn. Thành phần của vi nhung mao có nguồn gốc từ lưới nội chất và hiện tượng vỡ túi ở đầu vi nhung mao diễn ra một cách năng động, gợi ý rằng vi nhung mao cho phép noãn bào chủ động giao tiếp với các tế bào lân cận, thay vì chỉ tiếp nhận tín hiệu một cách thụ động [2].
Ngoài các tiếp xúc trực tiếp, giao tiếp giữa noãn bào và tế bào cumulus còn được mở rộng thông qua các túi ngoại bào hiện diện trong dịch nang và phân bố quanh các TZP. Các túi này chứa RNA và protein có khả năng điều hòa hoạt động của tế bào đích, góp phần bổ sung cho hệ thống giao tiếp tại chỗ. Bên cạnh đó, hiện tượng dung hợp màng giữa noãn bào và tế bào cumulus đã được ghi nhận trong quá trình phát triển nang, cho phép chia sẻ trực tiếp bào tương và các đại phân tử, qua đó mở rộng đáng kể phạm vi và mức độ tương tác trong COC [3].
Tổng hợp các bằng chứng trên cho thấy COC không đơn thuần là một tập hợp tế bào tiếp xúc thụ động, mà là một hệ thống tổ chức cao, trong đó các tương tác tế bào đóng vai trò nền tảng cho việc duy trì và điều hòa chức năng của noãn bào.
Vai trò của các tương tác tế bào trong COC
- Tăng sinh và biệt hóa
Sinh noãn phụ thuộc vào sự phối hợp chuyển hóa chặt chẽ giữa noãn bào và tế bào cumulus. Tế bào cumulus truyền ATP cho noãn bào qua các cầu nối liên bào và đảm nhiệm phần lớn chuyển hóa glucose thông qua các con đường như: đường phân, pentose phosphate (PPP) và polyol. Hoạt tính phosphofructokinase (PFK) cao ở tế bào cumulus thúc đẩy tạo pyruvate cung cấp cho noãn bào, trong khi PPP tạo NADPH và ribose-5-phosphate phục vụ cân bằng oxy hóa-khử và tổng hợp nucleotide. Con đường polyol có thể cung cấp cơ chất năng lượng thay thế, song tích lũy sorbitol quá mức có thể làm giảm chất lượng noãn, đặc biệt trong nuôi cấy in vitro. Ngược lại, noãn bào điều hòa chuyển hóa năng lượng của tế bào cumulus thông qua các yếu tố do noãn bào tiết ra (OSFs), phản ánh tính hai chiều của tương tác chuyển hóa trong COC [4].
Các yếu tố do noãn bào tiết ra (OSFs) là cơ chế tương tác tế bào chủ yếu trong COC, được giải phóng qua vi nhung mao nhằm điều hòa chính xác tín hiệu và duy trì vai trò trung tâm của noãn bào trong quá trình sinh noãn. Các OSFs tiêu biểu như GDF-9, BMP-15 và FGF-8 tham gia điều hòa tăng sinh, biệt hóa, apoptosis và hoàng thể hóa của tế bào hạt, đồng thời thúc đẩy chuyển hóa năng lượng và kiểm soát tốc độ phát triển nang.
- Giảm phân
Các liên kết khe đóng vai trò trung tâm trong điều hòa giảm phân của noãn bào thông qua việc truyền các chất truyền tin thứ cấp như cAMP và cGMP từ tế bào cumulus. cAMP, được tổng hợp tại chỗ và cung cấp qua GJs, duy trì trạng thái ngừng giảm phân bằng cách ức chế CDK1 thông qua PKA, trong khi cGMP hiệp đồng bằng cách ức chế phosphodiesterase. Trục tín hiệu NPPC/NPR2 làm tăng cGMP nội bào ở tế bào cumulus, qua đó góp phần duy trì sự ngừng giảm phân của noãn bào [5].
Sự tái khởi động giảm phân còn liên quan đến điều hòa RNA, trong đó các túi ngoại bào (Extracellular Vesicles - EVs) vận chuyển RNA từ tế bào cumulus đến noãn bào qua TZP. Các RNA này được tích hợp vào polyribosome của noãn bào, hỗ trợ phát triển noãn ngay cả trong giai đoạn ngừng phiên mã, và có thể được dự trữ trong các kho mRNA không màng quanh ty thể ở giai đoạn túi mầm để nhanh chóng huy động khi tái khởi động giảm phân [6]. Dù cơ chế còn tranh luận, EVs được xem là yếu tố quan trọng trong sinh noãn và cần được nghiên cứu sâu hơn.
- Các chức năng sinh lý khác
Ngoài chuyển hóa carbohydrate, tế bào cumulus còn tham gia tích cực vào chuyển hóa lipid và điều hòa cân bằng ion trong vi môi trường nang noãn. Các acid béo trong dịch nang được tế bào cumulus thu nhận và chuyển hóa nhằm cung cấp năng lượng cho noãn bào, trong khi sự trao đổi ion thông qua các cầu nối liên bào đáp ứng nhu cầu chuyển hóa và chức năng ty thể, đặc biệt trong giai đoạn cuối của phát triển nang noãn và giảm phân. Những chức năng này góp phần duy trì môi trường tối ưu cho sinh noãn và nhấn mạnh vai trò đa chức năng của tế bào cumulus trong COC.
Ứng dụng tương tác trong COC vào nuôi cấy noãn trưởng thành trong ống nghiệm (IVM)
Các tương tác tế bào trong phức hợp cumulus-noãn bào (COC) đã được ứng dụng trong nuôi cấy noãn theo hai hướng chính: (1) duy trì tương tác trực tiếp giữa noãn bào và tế bào cumulus, (2) mô phỏng các tín hiệu sinh học được trao đổi trong vi môi trường nang noãn. Theo đó, các hệ thống trưởng thành noãn trong ống nghiệm (In Vitro Maturation - IVM) hiện đại ưu tiên nuôi cấy COC nguyên vẹn hoặc đồng nuôi với các tế bào hỗ trợ buồng trứng nhằm bảo tồn và tái tạo các tương tác chức năng trong COC. Các mô hình IVM hai pha, tiêu biểu như CAPA-IVM, sử dụng các chất truyền tin thứ cấp như cAMP, cGMP để kéo dài trạng thái ngừng giảm phân, qua đó duy trì tương tác cumulus-noãn bào, cho phép tế bào cumulus tiếp tục cung cấp các chất dinh dưỡng, yếu tố chống stress oxy hóa, cũng như đồng bộ quá trình trưởng thành nhân và tế bào chất của noãn.
Bên cạnh đó, việc bổ sung các yếu tố do noãn bào tiết ra, bao gồm GDF-9, BMP-15 và phức hợp cumulin vào môi trường IVM đã cho thấy hiệu quả trong việc thúc đẩy giãn nở cumulus, điều hòa biểu hiện gen chức năng của COC và cải thiện chất lượng noãn [7]. Gần đây, các túi ngoại bào có nguồn gốc từ tế bào cumulus hoặc ống dẫn trứng cũng được khai thác như một phương tiện truyền tín hiệu bổ trợ. Việc bổ sung túi ngoại bào cho thấy tăng tỉ lệ trưởng thành, giãn nở cumulus (HAS2, GREM1), tăng biểu hiện liên kết khe (CX37, CX43) và giảm stress oxy hoá, từ đó cải thiện phát triển phôi [8].
Nhìn chung, các hệ thống nuôi cấy noãn tiên tiến hiện nay tập trung đồng thời vào bảo tồn cấu trúc COC và mô phỏng các tín hiệu sinh học của vi môi trường nang noãn nhằm cải thiện chất lượng noãn.
Kết luận
Tương tác tế bào trong COC rất đa dạng và phức tạp, trong đó các cấu trúc TZP và GJs đóng vai trò nền tảng, bảo đảm sự duy trì và phát triển của noãn bào. Bên cạnh đó, các cấu trúc và cơ chế khác như vi nhung mao, túi ngoại bào, sự dung hợp màng tế bào cùng nhiều hình thức tương tác mới được phát hiện đã mở rộng đáng kể mạng lưới điều hòa giữa noãn bào và tế bào cumulus, giúp COC hoạt động như một đơn vị thống nhất.
Từ khóa: COC, tương tác tế bào, TZP, liên kết khe, EV
Tài liệu tham khảo
- Baena, V., & Terasaki, M. (2019). Three-dimensional organization of transzonal projections and other cytoplasmic extensions in the mouse ovarian follicle. Scientific reports, 9(1), 1262.
- Inoue, N., Saito, T., & Wada, I. (2020). Unveiling a novel function of CD9 in surface compartmentalization of oocytes. Development, 147(15), dev189985.
- Komatsu, K., & Masubuchi, S. (2018). Mouse oocytes connect with granulosa cells by fusing with cell membranes and form a large complex during follicle development. Biology of Reproduction, 99(3), 527-535.
- Xie, J., Xu, X., & Liu, S. (2023). Intercellular communication in the cumulus–oocyte complex during folliculogenesis: A review. Frontiers in Cell and Developmental Biology, 11, 1087612.
- Jaffe, L. A., & Egbert, J. R. (2017). Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual review of physiology, 79(1), 237-260.
- Cheng, S., Altmeppen, G., So, C., Welp, L. M., Penir, S., Ruhwedel, T., ... & Schuh, M. (2022). Mammalian oocytes store mRNAs in a mitochondria-associated membraneless compartment. Science, 378(6617), eabq4835.
- Cava-Cami, B., Galvao, A., Van Ranst, H., Stocker, W. A., Harrison, C. A., Smitz, J., ... & Anckaert, E. (2025). Pro-cumulin addition in a biphasic in vitro oocyte maturation system modulates human oocyte and cumulus cell transcriptomes. Molecular Human Reproduction, 31(1), gaaf001.
- Wei, Y., Idrees, M., Sidrat, T., Joo, M., Xu, L., Ko, J., & Kong, I. (2022). BOEC–Exo addition promotes in vitro maturation of bovine oocyte and enhances the developmental competence of early embryos. Animals, 12(4), 424.