KS. Nguyễn Thị Nguyệt, KS. Cao Vân Anh, ThS. Nguyễn Thị Liên Thi
IVFMD FAMILY - Bệnh viện Đa khoa Gia Đình Đà Nẵng
1. Giới thiệu
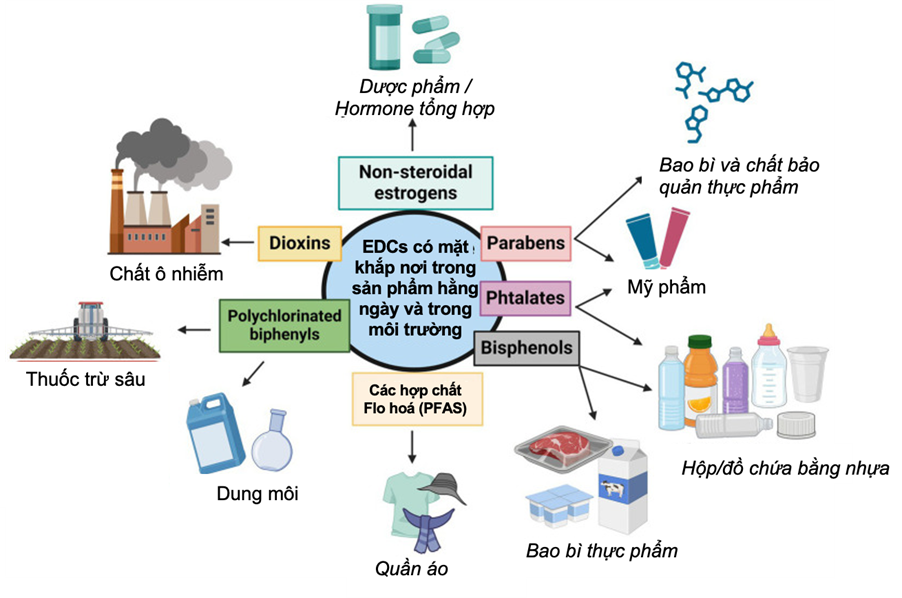
Các hợp chất gây rối loạn nội tiết (Endocrine Disrupting Chemicals – EDCs) là những chất hóa học có khả năng tương tác với hệ thống nội tiết thông qua cơ chế giả lập hoạt động hormone, đối kháng với thụ thể nội tiết, hoặc can thiệp vào quá trình tổng hợp, chuyển hóa và điều hòa tín hiệu nội tiết [1]. Các EDCs phổ biến như bisphenol A (BPA), phthalates, polychlorinated biphenyls (PCBs), dioxins, DDT và các chất perfluoroalkyl (PFAS) hiện diện rộng rãi trong môi trường sống, bao gồm bao bì nhựa thực phẩm, nước uống, mỹ phẩm, thuốc trừ sâu và sản phẩm chăm sóc cá nhân. Điều này dẫn đến khả năng phơi nhiễm liên tục ở người [2,3].
Ở nữ giới, EDCs được chứng minh có ảnh hưởng đến trục hạ đồi – tuyến yên – buồng trứng (HPG), làm rối loạn bài tiết GnRH, FSH/LH, rối loạn rụng trứng, đồng thời làm suy giảm dự trữ buồng trứng, thay đổi tính tiếp nhận nội mạc tử cung và ảnh hưởng đến sự phát triển của phôi [2]. Trong bối cảnh tỷ lệ vô sinh toàn cầu ngày càng gia tăng, cùng sự phổ biến của các bệnh lý như buồng trứng đa nang, suy buồng trứng sớm và lạc nội mạc tử cung, việc đánh giá vai trò của EDCs trở nên đặc biệt quan trọng trong lĩnh vực hỗ trợ sinh sản hiện đại, đặc biệt là trong các quy trình thụ tinh trong ống nghiệm (TTTON) [4].
2. Các nhóm hợp chất gây rối loạn nội tiết phổ biến ở nữ giới
Năm nhóm EDCs chính bao gồm Bisphenol A (BPA), Phthalates, Polychlorinated Biphenyls (PCBs), Dioxin/DDT, Per và Polyfluoroalkyl Substances (PFAS) đã được nghiên cứu rộng rãi về mối liên quan đến khả năng sinh sản ở nữ giới, đặc biệt trong lĩnh vực hỗ trợ sinh sản (HTSS).
2.1. Bisphenol A (BPA)
Bisphenol A (BPA) là một hợp chất tổng hợp phổ biến trong nhựa polycarbonate và lớp phủ epoxy của thực phẩm đóng hộp. BPA chủ yếu phơi nhiễm qua đường ăn uống và có khả năng bắt chước estrogen, gây rối loạn trục hạ đồi – tuyến yên – buồng trứng.
Nghiên cứu của Mínguez-Alarcón và cộng sự (2019) trên 420 chu kỳ TTTON cho thấy, nồng độ BPA trong nước tiểu liên quan đáng kể đến sự suy giảm khả năng sinh sản. Cụ thể, nhóm bệnh nhân có nồng độ BPA trong nước tiểu cao có số noãn MII giảm 12,3%, tỷ lệ phôi phân mảnh ngày 3 cao hơn 18,6% và tỷ lệ làm tổ giảm còn 22,1% so với 33,4% ở nhóm phơi nhiễm thấp.
Cơ chế tác động của BPA bao gồm gây stress oxy hóa, rối loạn methyl hóa DNA và giảm biểu hiện thụ thể nội tiết tại buồng trứng và nội mạc tử cung. Những phát hiện này khẳng định vai trò tiêu cực của BPA đối với chất lượng noãn và kết quả TTTON, từ đó nhấn mạnh tầm quan trọng của việc hạn chế phơi nhiễm BPA trong hỗ trợ sinh sản [5].
2.2. Phthalates
Phthalates như di(2-ethylhexyl) phthalate (DEHP) và dibutyl phthalate (DBP) thường có mặt trong mỹ phẩm, bao bì nhựa và vật liệu chăm sóc cá nhân.
Trong nghiên cứu của Hauser và cộng sự (2016), 550 phụ nữ đến khám tại trung tâm điều trị vô sinh được đánh giá nồng độ phthalates trong nước tiểu. Kết quả cho thấy nồng độ monoethyl phthalate (MEP) và mono-n-butyl phthalate (MBP) cao hơn có liên quan đến giảm chỉ số dự trữ buồng trứng và số nang thứ cấp ở đầu chu kỳ. Tăng nồng độ MEHP có liên quan đến giảm trung bình 10% số lượng noãn thu được sau chọc hút [6].
2.3. Polychlorinated Biphenyls (PCBs)
PCBs là nhóm hợp chất công nghiệp đã bị cấm nhưng vẫn tồn tại trong môi trường không khí, đất và sinh vật nhờ khả năng tích tụ sinh học và phân hủy chậm. PCBs được biết đến như các chất gây rối loạn nội tiết mạnh mẽ, có khả năng tương tác với nhiều cơ quan sinh sản của nữ giới thông qua cơ chế bắt chước hoặc đối kháng estrogen, và tương tác với thụ thể aryl hydrocarbon (AhR).
Theo Ziv-Gal và Flaws (2021), các nghiên cứu trên mô hình động vật và tế bào cho thấy PCB 153 – một trong những đồng phân phổ biến – làm giảm sự phát triển của nang noãn thứ cấp, tăng tỷ lệ chết tế bào hạt (granulosa cells), và giảm biểu hiện các gen quan trọng trong quá trình phát triển nang noãn như FSHR và CYP19A1. Ngoài ra, PCBs còn ảnh hưởng đến nội mạc tử cung thông qua việc làm giảm biểu hiện của các yếu tố tiếp nhận phôi như HOXA10 và LIF, từ đó làm giảm khả năng làm tổ của phôi sau chuyển [7].
2.4. Dioxin và Dichlorodiphenyltrichloroethane
Dioxin (TCDD) và Dichlorodiphenyltrichloroethane (DDT) là hai hợp chất hữu cơ tồn lưu (Persistent organic pollutants – POPs) có khả năng bắt chước nội tiết tố và kích hoạt thụ thể AhR, dẫn đến viêm mạn tính, rối loạn biểu hiện gen nội tiết và ảnh hưởng đến hệ sinh sản nữ.
Phân tích tổng hợp của Zhang và cộng sự (2023) trên 8.430 phụ nữ cho thấy phơi nhiễm PCB-153, DDE (chất chuyển hóa của DDT và dioxin đều làm tăng nguy cơ mắc lạc nội mạc tử cung.
Ngoài ra, các hợp chất hữu cơ tồn lưu này còn làm giảm biểu hiện gen tiếp nhận phôi như LIF và HOXA10, gây giảm khả năng làm tổ, tăng nguy cơ sảy thai và thất bại TTTON. Điều này cho thấy vai trò nguy cơ tiềm ẩn của dioxin và DDT trong vô sinh nữ không rõ nguyên nhân [7].
2.5. Các hợp chất Flo hóa (Per- and Polyfluoroalkyl Substances -PFAS)
PFAS là nhóm hóa chất tổng hợp phổ biến trong chảo chống dính, bao bì thực phẩm, vải chống nước. Các hợp chất như PFOA và PFOS có đặc tính tích tụ sinh học và thời gian bán huỷ kéo dài, dễ xâm nhập vào dịch nang noãn, môi trường vi mô quan trọng cho sự trưởng thành của noãn và phát triển phôi.
Một nghiên cứu đoàn hệ mới của Xu và cộng sự (2025) trên 96 phụ nữ thực hiện TTTON cho thấy nồng độ PFOA cao trong dịch nang noãn làm tăng nguy cơ tạo phôi kém chất lượng gấp 2,21 lần (OR = 2,21, 95% CI: 1,32-3,68). PFOA liên quan đến rối loạn chuyển hóa lipid, giảm phosphatidylcholine - chất thiết yếu cho phát triển phôi. Ngoài ra, PFOA còn làm giảm chất lượng phôi nang và giảm tỷ lệ làm tổ, dù chưa đạt ngưỡng thống kê rõ rệt cho tất cả các chỉ số. Nghiên cứu này cung cấp bằng chứng trực tiếp về tác động bất lợi của PFAS đến môi trường nang noãn và kết quả TTTON, cho thấy sự cần thiết của chiến lược hạn chế phơi nhiễm PFAS ở phụ nữ trong độ tuổi sinh sản [8].
3. Cơ chế bệnh sinh của EDCS đối với hệ sinh sản nữ
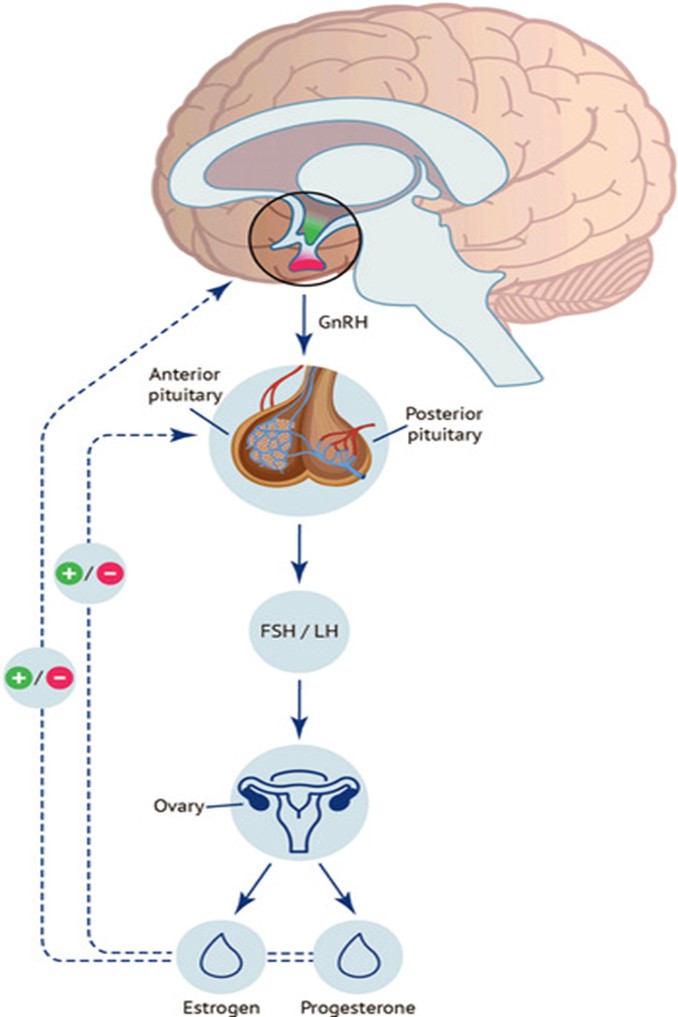
Các hóa chất gây rối loạn nội tiết (EDCs) can thiệp vào hoạt động nội tiết qua nhiều tầng mức độ, từ tác động đến hormone tuần hoàn, thụ thể, sinh tổng hợp steroid đến gây biến đổi biểu sinh, qua đó phá vỡ cân bằng nội môi suốt vòng đời [9,10]. Ở nữ giới, do hệ sinh sản phụ thuộc mạnh vào dao động nhịp nhàng của hormone theo chu kỳ kinh, trục hạ đồi-tuyến yên-buồng trứng trở thành mục tiêu tác động đặc biệt nhạy cảm của EDCs[11].
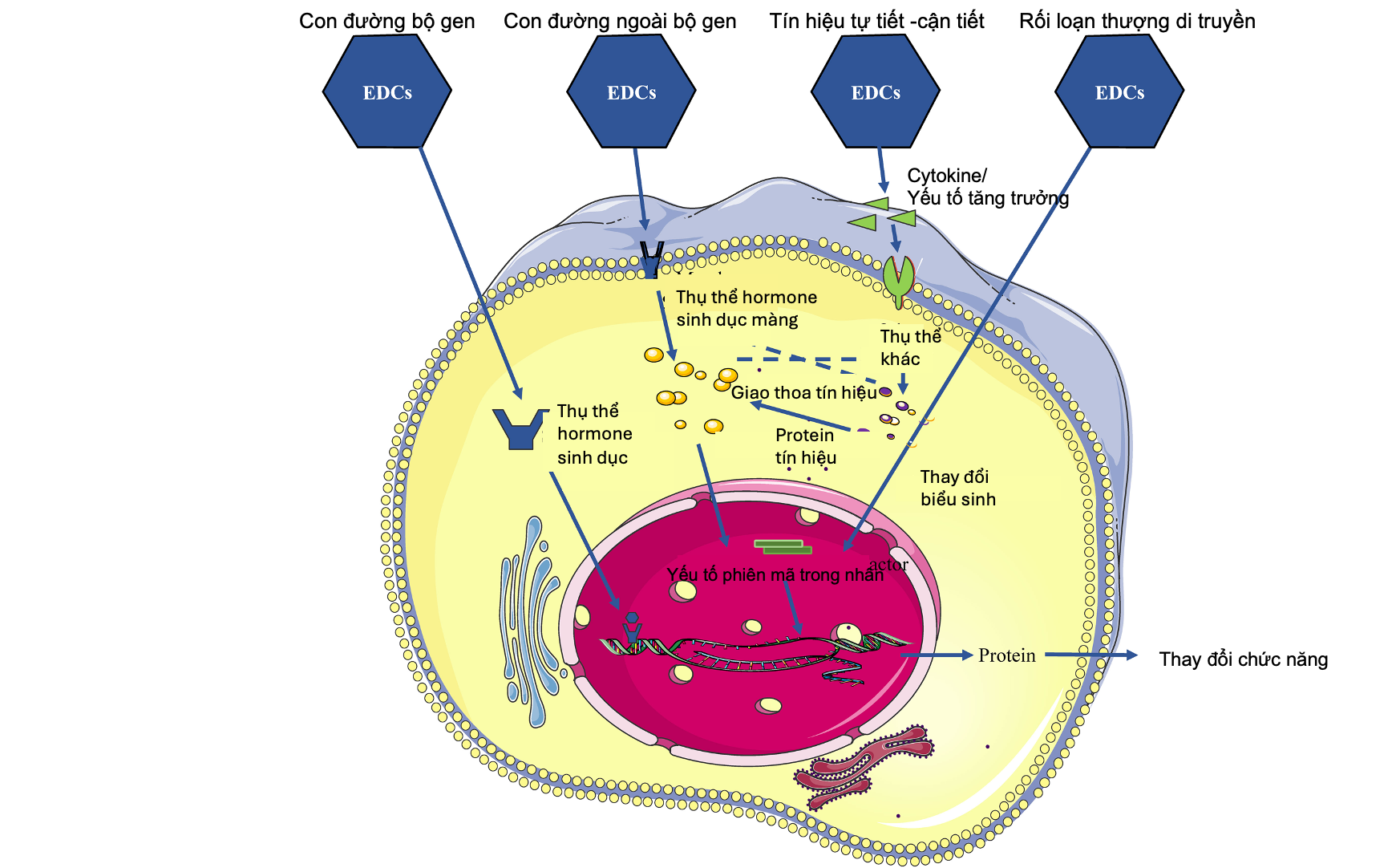
Hình 2. Bốn con đường chính EDCs can thiệp vào tế bào và dẫn tới rối loạn nội tiết/sinh sản [11]
3.1. Con đường bộ gen (Genomic pathway)
Ở mức phân tử, nhiều EDCs có cấu trúc tương đồng estrogen, cho phép chúng gắn vào thụ thể estrogen nhân ERα/ERβ và hoạt động như chất đồng vận hoặc đối kháng. Sự gắn kết này gây thay đổi phiên mã gen liên quan đến sự tăng sinh, biệt hóa và chức năng của tế bào sinh sản [12,14]. Ngay cả khi nồng độ hormone tuần hoàn vẫn bình thường, tín hiệu tại mô có thể bị lệch pha do sự hiện diện của “estrogen giả” dẫn đến rối loạn chức năng nội tiết [13]. Đồng thời, EDCs còn điều hòa số lượng thụ thể theo hướng tăng hoặc giảm nhạy cảm tùy mô đích, khiến buồng trứng và nội mạc tử cung phản ứng bất thường với tín hiệu nội sinh [12].
3.2. Con đường ngoài bộ gen (Non-genomic pathway)
Ngoài vai trò tại thụ thể nhân, EDCs còn kích hoạt hoặc ức chế các con đường tín hiệu nhanh ngoài bộ gen như thụ thể estrogen kết hợp protein G (G protein – coupled estrogen receptor T - GPER) và các con đường truyền tín hiệu nhanh MAPK/ERK và PI3K–AKT. Những tín hiệu này gây biến đổi tức thời sự tăng sinh, biệt hóa, viêm, stress oxy hóa và chết theo chu trình tại các mô sinh sản [11,14]. Vì buồng trứng, nội mạc tử cung, vòi tử cung và tuyến vú đều chứa mật độ ER và GPER cao, phụ nữ dễ bị ảnh hưởng mạnh bởi các tín hiệu lệch hướng này, dẫn đến rối loạn phóng noãn, tăng sinh nội mạc bất thường và giảm chất lượng noãn [11].
3.3. Tín hiệu tự tiết – cận tiết (Autocrine/Paracrine signaling)
EDCs can thiệp vào mạng lưới giao tiếp cục bộ vốn điều phối sự trưởng thành nang noãn, phóng noãn, chức năng thể vàng và khả năng tiếp nhận phôi của nội mạc. Nhiều nghiên cứu cho thấy phthalate, BPA và PFAS làm rối loạn biểu hiện của các hormone AMH, inhibin, activin, VEGF và cytokines trong môi trường nang noãn, dẫn đến suy giảm phát triển nang noãn, rối loạn chất lượng noãn và giảm khả năng làm tổ của phôi [5,15]. Tại nội mạc tử cung, EDCs gây thay đổi tín hiệu cận tiết chuẩn bị cho quá trình làm tổ, bao gồm LIF, HOXA10 và integrin αvβ3, dẫn đến khả năng tiếp nhận phôi kém và tăng nguy cơ thất bại TTTON [7].
3.4. Rối loạn thượng di truyền (Epigenetic alterations)
Nhiều EDCs gây biến đổi thượng di truyền thông qua cơ chế methyl hóa DNA, thay đổi histone, hoặc thay đổi biểu hiện microRNA trong các mô sinh sản. Những biến đổi này có thể xảy ra trong các “cửa sổ phát triển nhạy cảm” (developmental windows of susceptibility) như giai đoạn bào thai, sơ sinh, dậy thì hoặc quanh thời điểm rụng trứng, có khả năng dẫn đến những thay đổi bền vững về cấu trúc, chức năng của cơ quan sinh sản. Đáng chú ý, một số dấu ấn thượng di truyền do EDCs gây ra có thể truyền sang thế hệ tiếp theo, góp phần giải thích hiện tượng giảm khả năng sinh sản mang tính xuyên thế hệ [10,14].
Tổng hợp bốn con đường trên cho thấy EDCs không chỉ tác động qua một cơ chế đơn lẻ mà gây nhiễu loạn toàn bộ mạng lưới điều hòa nội tiết, đặc biệt tại trục hạ đồi - tuyến yên - buồng trứng, vốn kiểm soát chu kỳ kinh, sự rụng trứng, phát triển nang noãn và điều hòa nội mạc tử cung. Hậu quả là bệnh sinh của nhiều rối loạn sinh sản đặc trưng ở nữ, bao gồm buồng trứng đa nang, suy giảm dự trữ buồng trứng, suy buồng trứng sớm, rối loạn rụng trứng, bất thường nội mạc tử cung và kết quả HTSS kém [2,11]. Sự dễ tổn thương đặc thù của phụ nữ trước phơi nhiễm EDCs do cấu trúc sinh lý hệ sinh sản và sự nhạy cảm trong suốt giai đoạn sinh sản, nhấn mạnh nhu cầu cấp thiết về chiến lược giảm thiểu phơi nhiễm và bảo vệ sức khỏe sinh sản nữ giới.
5. Đề xuất chiến lược phòng ngừa và giảm phơi nhiễm
5.1. Giảm phơi nhiễm từ môi trường và tiêu dùng
EDCs tồn tại dưới nhiều dạng khác nhau và được sử dụng rộng rãi trong nhiều sản phẩm, có thể xâm nhập vào cơ thể qua đường hô hấp và đường tiêu hóa, gây ảnh hưởng đáng kể đến sức khỏe sinh sản. Trong đó, các bằng chứng dịch tễ cho thấy đường ăn uống là một trong những nguồn phơi nhiễm EDCs chính. Vì vậy, có thể khuyến nghị: ưu tiên thực phẩm tươi, hạn chế thực phẩm chế biến, đóng hộp; rửa kỹ rau quả để giảm dư lượng thuốc trừ sâu; tránh hâm nóng thức ăn trong hộp nhựa; ưu tiên vật dụng, bao bì ít hoặc không chứa BPA và các chất thay thế có nguy cơ cao [4,11,16].
5.2. Tăng cường chính sách và nhận thức cộng đồng
Ở cấp độ cộng đồng, cần siết chặt quản lý EDCs trong sản phẩm tiêu dùng, áp dụng nguyên tắc phòng ngừa, yêu cầu ghi nhãn và khuyến khích sử dụng các chất thay thế an toàn hơn [2]. Bên cạnh đó, xây dựng các chiến dịch truyền thông sức khỏe và đào tạo nhân viên y tế giúp người dân nhận diện nguồn phơi nhiễm và đưa ra lựa chọn tiêu dùng an toàn hơn [2].
5.3. Vai trò của bác sĩ sản phụ khoa và tư vấn cá nhân hoá
Trong thực hành lâm sàng, đánh giá phơi nhiễm EDCs nên được tích hợp vào tư vấn và điều trị vô sinh, đặc biệt ở các nhóm nguy cơ (bệnh nhân lớn tuổi, BMI cao, phơi nhiễm nghề nghiệp…). Khai thác kỹ các yếu tố như tiền sử, môi trường, nghề nghiệp, kết hợp thực hiện các xét nghiệm giúp nhận diện các cá nhân có mức phơi nhiễm EDCs cao và xây dựng các khuyến nghị nhằm điều chỉnh lối sống phù hợp cho bệnh nhân [2,11].
5.4. Cần thêm bằng chứng về tương tác gen - môi trường
Tác động của EDCs không chỉ dừng lại ở rối loạn trục hạ đồi – tuyến yên – buồng trứng mà còn liên quan đến nhiều cơ chế phức tạp khác như điều hòa phiên mã gen, tín hiệu nhanh ngoài bộ gen, biến đổi các trục tự tiết, cận tiết và các sửa đổi thượng di truyền (methyl hóa DNA, biến đổi histone). Do đó, việc khảo sát cơ chế tác động của EDCs thông qua các thiết kế lâm sàng và thực nghiệm tích hợp, bao gồm các con đường nội tiết, bộ gen và biểu sinh, giữ vai trò then chốt trong việc làm sáng tỏ các cơ chế bệnh sinh của các rối loạn liên quan đến EDCs [11].
6. Kết luận
Các bằng chứng dịch tễ và thực nghiệm đều cho thấy phơi nhiễm EDCs gây rối loạn chức năng sinh sản nữ thông qua sự can thiệp trực tiếp vào trục hạ đồi – tuyến yên – buồng trứng, dẫn đến suy giảm phát triển nang noãn, rối loạn phóng noãn, giảm chất lượng noãn và giảm khả năng tiếp nhận của nội mạc tử cung. Những rối loạn nội tiết này là nền tảng của nhiều bệnh lý sinh sản quan trọng bao gồm buồng trứng đa nang, suy giảm dự trữ buồng trứng và suy buồng trứng sớm, cũng như vô sinh không rõ nguyên nhân. Đáng lưu ý, phơi nhiễm EDCs trong các giai đoạn sinh lý khác nhau có thể tạo ra những tác động kéo dài hoặc thậm chí truyền qua các thế hệ thông qua các cơ chế thượng di truyền. Do đó, giảm thiểu sự phơi nhiễm EDCs và bổ sung việc đánh giá các yếu tố nguy cơ vào chăm sóc sức khỏe sinh sản là yêu cầu cấp thiết nhằm bảo vệ và duy trì chức năng sinh sản dài hạn cho nữ giới.
1. Komarla, A., Dufresne, S., & Towers, C. G. (2023). Recent Advances in the Role of Autophagy in Endocrine-Dependent Tumors. Endocrine Reviews, 44(4), 629–646. https://doi.org/10.1210/endrev/bnad001
2. Tzouma, Z., Dourou, P., Diamanti, A., Harizopoulou, V., Papalexis, P., Karampas, G., Liepinaitienė, A., Dėdelė, A., & Sarantaki, A. (2025). Associations Between Endocrine-Disrupting Chemical Exposure and Fertility Outcomes: A Decade of Human Epidemiological Evidence. Life, 15(7), 993. https://doi.org/10.3390/life15070993
3. Voros, C., Athanasiou, D., Papapanagiotou, I., Mavrogianni, D., Varthaliti, A., Bananis, K., Athanasiou, A., Athanasiou, A., Papadimas, G., Gkirgkinoudis, A., Migklis, K., Vaitsis, D., Koulakmanidis, A.-M., Tsimpoukelis, C., Ivanidou, S., Stepanyan, A. J., Daskalaki, M. A., Theodora, M., Antsaklis, P., … Daskalakis, G. (2025). Molecular Shadows of Per- and Polyfluoroalkyl Substances (PFASs): Unveiling the Impact of Perfluoroalkyl Substances on Ovarian Function, Polycystic Ovarian Syndrome (PCOS), and In Vitro Fertilization (IVF) Outcomes. International Journal of Molecular Sciences, 26(14), 6604. https://doi.org/10.3390/ijms26146604
4. Tricotteaux-Zarqaoui, S., Lahimer, M., Abou Diwan, M., Corona, A., Candela, P., Cabry, R., Bach, V., Khorsi-Cauet, H., & Benkhalifa, M. (2024). Endocrine disruptor chemicals exposure and female fertility declining: From pathophysiology to epigenetic risks. Frontiers in Public Health, 12, 1466967. https://doi.org/10.3389/fpubh.2024.1466967
5. Zhang X, Wu Y, Zhang D, Zhang Y. Serum bisphenol S levels are associated with decreased ovarian reserve function: a single-center study. Am J Transl Res. 2024 Oct 15;16(10):5961-5969. doi: 10.62347/AQMO8416. PMID: 39544747; PMCID: PMC11558416.
6. Birch Petersen, K., Hvidman, H. W., Sylvest, R., Pinborg, A., Larsen, E. C., Macklon, K. T., Andersen, A. N., & Schmidt, L. (2015). Family intentions and personal considerations on postponing childbearing in childless cohabiting and single women aged 35–43 seeking fertility assessment and counselling. Human Reproduction, 30(11), 2563–2574. https://doi.org/10.1093/humrep/dev237
7. Caserta D, Costanzi F, De Marco MP, Di Benedetto L, Matteucci E, Assorgi C, et al. Effects of Endocrine-Disrupting Chemicals on Endometrial Receptivity and Embryo Implantation: A Systematic Review of 34 Mouse Model Studies. Int J Environ Res Public Health. 2021 June 25;18(13):6840.
8. Xu, J., Wang, Q., Jiao, X., Kong, P., Chen, S., Yang, W., Liu, W., Li, K., Teng, X., & Guo, Y. (2025). Association between Perfluorooctanoic Acid-Related Poor Embryo Quality and Metabolite Alterations in Human Follicular Fluid during IVF: A Cohort Study. Environmental Health Perspectives, 133(6), 67017. https://doi.org/10.1289/EHP15422
9. Diamanti-Kandarakis, E., Bourguignon, J.-P., Giudice, L. C., Hauser, R., Prins, G. S., Soto, A. M., Zoeller, R. T., & Gore, A. C. (2009). Endocrine-Disrupting Chemicals: An Endocrine Society Scientific Statement. Endocrine Reviews, 30(4), 293–342. https://doi.org/10.1210/er.2009-0002
10. Gore, A. C., Chappell, V. A., Fenton, S. E., Flaws, J. A., Nadal, A., Prins, G. S., Toppari, J., & Zoeller, R. T. (2015). EDC-2: The Endocrine Society’s Second Scientific Statement on Endocrine-Disrupting Chemicals. Endocrine Reviews, 36(6), E1–E150. https://doi.org/10.1210/er.2015-1010
11. Pan, J., Liu, P., Yu, X., Zhang, Z., & Liu, J. (2023). The adverse role of endocrine disrupting chemicals in the reproductive system. Frontiers in Endocrinology, 14, 1324993. https://doi.org/10.3389/fendo.2023.1324993
12. Rt, Z., Tr, B., Ll, D., Ac, G., Ne, S., Am, S., Tj, W., & Fs, V. S. (2012). Endocrine-disrupting chemicals and public health protection: A statement of principles from The Endocrine Society. Endocrinology, 153(9). https://doi.org/10.1210/en.2012-1422
13. Endocrine Disrupting Chemicals: Threats to Human Health | IPEN. (n.d.). Retrieved November 20, 2025, from https://www.ipen.org/documents/endocrine-disrupting-chemicals-threats-human-health
14. Schug, T. T., Janesick, A., Blumberg, B., & Heindel, J. J. (2011). Endocrine disrupting chemicals and disease susceptibility. The Journal of Steroid Biochemistry and Molecular Biology, 127(3–5), 204–215. https://doi.org/10.1016/j.jsbmb.2011.08.007
15. Machtinger, R., & Orvieto, R. (2014). Bisphenol A, oocyte maturation, implantation, and IVF outcome: Review of animal and human data. Reproductive Biomedicine Online, 29(4), 404–410. https://doi.org/10.1016/j.rbmo.2014.06.013
16. Stiefel, C., & Stintzing, F. (2023). Endocrine-active and endocrine-disrupting compounds in food – occurrence, formation and relevance. NFS Journal, 31, 57–92. https://doi.org/10.1016/j.nfs.2023.03.004