Tin tức
on Tuesday 26-11-2024 1:57am
Danh mục: Tin quốc tế
DS. Nguyễn Thảo Nhi – Đại học Y Dược Thành phố Hồ Chí Minh
1. Giới thiệu
Có khá nhiều liệu pháp đang được ứng dụng trong các chương trình bảo tồn khả năng sinh sản (FP): phổ biến nhất là lấy trứng từ buồng trứng sau khi kích thích buồng trứng và gây trưởng thành trứng với thuốc nội tiết, sau đó thực hiện thụ tinh trong ống nghiệm (IVF) hay tiêm trực tiếp tinh trùng vào bào tương trứng (ICSI). Phương pháp này thường được sử dụng phổ biến cho bệnh nhân hiếm muộn, trong khi đó, với trường hợp cần bảo tồn khả năng sinh sản để điều trị ung thư (CTRI), trứng chọc hút được thường được bác sĩ tư vấn trữ lạnh và sau khi chữa khỏi ung thư mới thực hiện thụ tinh với tinh trùng. Tuy nhiên, quy trình này chưa được khuyến cáo nhiều vì nguy cơ ung thư vẫn còn tiềm ẩn, đặc biệt là ở những bệnh nhân bị những loại ung thư nhạy cảm với hormone.
Phương pháp tương đối phù hợp cho nhóm đối tượng trên, đặc biệt ở lứa tuổi trước dậy thì chính là đông lạnh vỏ buồng trứng và cấy ghép lại sau khi điều trị ung thư. Phương pháp không sử dụng hormone này dựa trên làm lạnh và sau đó thay thế các mảnh buồng trứng tự nhiên. Tuy nhiên tỷ lệ thành công của liệu pháp này khá thấp so với IVF và ICSI, đồng thời cũng được báo cáo là cấy ghép vỏ ban đầu có nguy cơ tái tạo ung thư.
Gần đây, lĩnh vực y học tái tạo đưa ra phương pháp sử dụng tế bào gốc, trong đó tế bào gốc buồng trứng (OSCs) mang lại tiềm năng rất lớn cho chương trình FP. Thực tế, dựa trên khả năng phát triển các tế bào giống tế bào trứng (OLCs) từ OSCs để thu được quần thể tế bào trứng trưởng thành, có tiềm năng trong việc lựa chọn OLCs thích hợp cho các chương trình FP để điều trị cả phụ nữ mắc POF và CTRI mà không có nguy cơ gây ung thư và hạn chế liên quan đến thời điểm trưởng thành của trứng.
2. Sự phát hiện tế bào mầm buồng trứng
Mặc dù có những giả thiết cho rằng tiền thân của trứng đã được cố định từ lúc sinh ra ở các động vật có vú cùng với thời kỳ mãn kinh phản ánh sự cạn kiệt nguồn dự trữ trong buồng trứng, một nhóm nghiên cứu đã mô tả sự hiện diện của tế bào gốc trong vỏ buồng trứng sau khi sinh của chuột, cụ thể là OSCs. Bằng việc sử dụng mô hình chuột, họ đã chứng minh rằng việc cấy ghép vỏ buồng trứng chứa OSCs sẽ dẫn đến hình thành noãn mới và điều trị vô sinh.
Nghiên cứu trên đã thổi một làn gió mới, dẫn đến hàng loạt các thử nghiệm thành công khác trên dê, lợn, chuột,...; những tế bào này cũng được đặc trưng bởi các đánh dấu màng – rất hữu ích cho việc phân lập của chúng khỏi vỏ buồng trứng cho các nghiên cứu tiếp theo xác định khía cạnh phân tử cũng như chức năng của chúng. Người ta cũng mô tả rằng OSCs được phát hiện trong vỏ buồng trứng ở độ tuổi trước và sau mãn kinh.
Bằng cách sử dụng phương pháp phân lập liên kết các phân tử cụ thể với màng OSCs, có thể làm sạch chúng khỏi các mảnh vỏ và tiếp tục nuôi cấy in vitro. Kết quả của các nghiên cứu sau đó là OSCs của phụ nữ có kích thước nhỏ hơn trứng trưởng thành, thường là 10 µm và tính nhất quán của quần thể tế bào này trong vỏ buồng trứng khá thấp so với các loại khác, khoảng 5%. Tuy nhiên, sau khi được phân lập, dưới môi trường nuôi cấy thích hợp, OSCs được duy trì và sau 3 tuần, chúng sẽ tăng trưởng về kích thước, có hình thái và số đo đặc trưng của tế bào đang trải qua tăng trưởng giống như tế bào mầm (hình dạng tròn với nhân lớn và đường kính từ 50-70 µm trở lên).
Một công nghệ mới giúp cải thiện sự phân lập khỏi dịch nuôi cấy bằng cách sử dụng máy phân loại tế bào cho phép bắt duy nhất một OSC để nghiên cứu. Trên thực tế, đánh giá phân tử cho thấy thời điểm trưởng thành đến OLCs in vitro (màng mất dấu phân tử đặc trưng và sự xuất hiện các dấu ấn khác). Khi đánh giá hàm lượng nhiễm sắc thể (NST) ở OLCs ngay sau giai đoạn 3 tuần thì chỉ còn một nửa trong số đó - tình trạng này được gọi là “đơn bội” và sẽ chuyển thành “lưỡng bội” sau khi tiếp xúc với tinh trùng.
3. Chọn lọc và nuôi cấy OSCs
Một trong những nghiên cứu quan trọng là xác định các protein đặc biệt được biểu hiện bởi OSCs cùng một số phân tử như Ddx4 và Fragile trên bề mặt – những receptor của chúng, điển hình cho sự phát triển dòng tế bào mầm và chỉ được tiếp xúc trong giai đoạn đầu phát triển. Do đó, bằng việc sử dụng các thuốc thử đặc hiệu cho những receptor này sẽ có thể phân lập được chúng, thuốc thử dùng cho Ddx4 và Fragile đều gồm các kháng thể có thể dễ dàng liên kết với các hóa chất phát hiện như huỳnh quang hay các vật liệu rắn giúp tách OSCs với kiểu phân lập dựa vào các hạt vi từ tính.
Quy trình phân lập: sinh thiết một mẫu nhỏ vỏ buồng trứng làm mẫu phân lập. Mảnh vỏ này thu được qua nội soi ổ bụng được xử lý nhanh chóng bằng collagenase giúp hòa tan các thành phần tế bào và tạo thành hỗn dịch tế bào chứa tất cả những gì hiện diện trong mảnh ban đầu. Sau đó, hỗn dịch được ủ với các kháng thể (anti-Ddx4 và anti-Fragile) liên hợp với các hạt vi từ tính mà có thể bắt được OSCs và tiếp tục đi qua từ trường để tách biệt với những thành phần không được gắn.
Trước khi nuôi cấy, để đảm bảo tính liên tục trong điều kiện cơ thể sống thì người ta thường chuẩn bị một lớp nuôi cấy (feeder layer) để tạo lớp đệm giúp các tế bào duy trì khả năng sống và tăng kích thước. Các tế bào trung mô từ lớp mỡ dưới da hoặc máu ngoại vi khá phù hợp để tạo môi trường in vivo, thúc đẩy việc duy trì ổn định và trưởng thành của OSCs in vitro. Tuy nhiên, điểm quan trọng để đảm bảo sự thành lập tối ưu là môi trường nuôi cấy; trên thực tế thường phải thêm một lượng protein, hormone FSH, LH, estradiol, yếu tố tăng trưởng biểu bì (EGF).
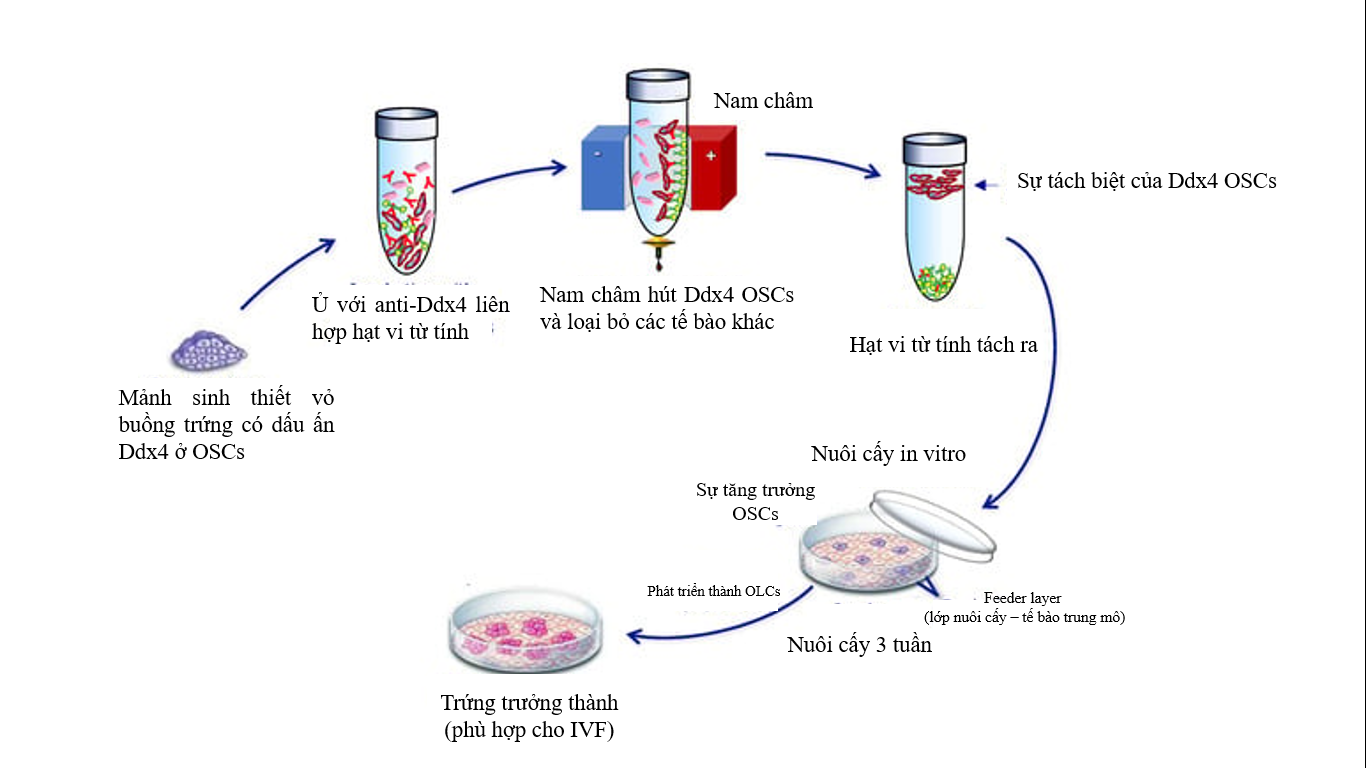
Hình 1. Các bước phân lập và nuôi cấy OSCs
Sau khi phân lập thành công, các đánh giá chi tiết về tạp chất và quy mô quần thể là rất cần thiết. Phân tích tế bào dòng chảy sử dụng huỳnh quang để phát hiện OSCs gắn với kháng thể cho các tín hiệu tích cực về cách phân lập này.
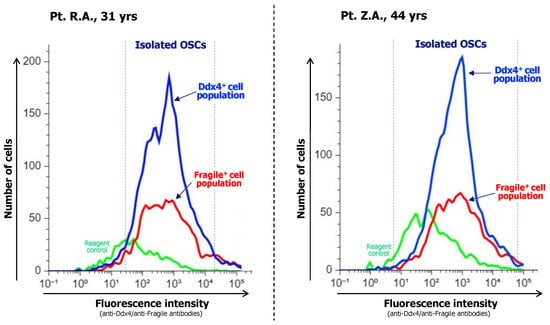
Hình 2. Kết quả phân tích tế bào dòng chảy ở hai bệnh nhân
Trong quá trình nuôi cấy, việc kiểm tra liên tục các ống nuôi cấy OSCs được thực hiện thường xuyên để đánh giá sự tăng lên về kích thước. Khởi điểm với đường kính khoảng 7-10 µm lúc phân lập đến 20 µm sau 1 tuần và tiếp tục tăng từ từ ở những tuần tiếp theo. Sau tuần thứ 3, chúng có thể đạt đến 50-70 µm – gần với kích thước của trứng trưởng thành (80-100 µm). Ngoài ra, trong quá trình trưởng thành, OSCs trải qua sự thay đổi hình thái ở cả tế bào chất và nhân, trong đó ở những ngày cuối, chúng đẩy một phần nhân qua một túi bề mặt gọi là thể cực, nơi chứa toàn bộ NST, khi đó có thể chắc chắn OSCs đã thành OLCs khi sự đùn thể cực liên quan đến việc thụ tinh.
.png)
Hình 3. Sự thay đổi hình thái và kích thước của OSCs, phát triển thành OLCs và cuối cùng là trứng trưởng thành
4. Kết quả
Trong một nghiên cứu gần đây với cỡ mẫu là 21 bệnh nhân có độ tuổi trung bình là 36, trong đó 20 người vô sinh do POF và một đối tượng mắc CTRI, mục đích của nghiên cứu để đánh giá khả năng thu được OLCs từ nhóm phụ nữ này. Như dự đoán, nồng độ anti-Müllerian hormone (AMH) trong huyết tương thấp ở tất cả phụ nữ, cung cấp thêm bằng chứng bổ sung rằng nồng độ AMH thấp có liên quan trực tiếp đến tình trạng rụng trứng không hiệu quả - trở thành một marker độc lập cho vô sinh ở cả người trẻ và lớn tuổi.
Khu trú trong thử nghiệm, sử dụng phương pháp phân tích tế bào dòng chảy đã cho thấy sự xuất hiện của OSCs trong tổng quần thể tế bào vỏ buồng trứng là gần 15%, củng cố giả thiết rằng sự có mặt của OSCs ở người mắc POF không phụ thuộc đến nồng độ AMH, chất mà, như đã dự đoán, không có hiệu ứng lên tế bào gốc.
5. Tiềm năng áp dụng trong tương lai
Ngày nay, việc áp dụng OLCs từ OSCs trong các chương trình FP mang lại nhiều lợi ích cho đối tượng nhạy cảm với hormone. Trên thực tế, đông lạnh trứng vẫn được xem là phương pháp thành công nhất để mang thai sau khi chữa khỏi ung thư, nhưng nguy cơ của việc kích thích khối u thông qua estrogen đang chưa được đánh giá với một nhược điểm nữa là khả năng sống của trứng ở vỏ rã đông.
Mặt khác, việc chọn lựa OLCs để đông lạnh diễn ra rất khắc nghiệt, cần phải được đảm bảo về khả năng sống và chất lượng. Do đó nhìn chung thì phương pháp này khá an toàn và không có nguy cơ kích hoạt ung thư. Các nghiên cứu sâu hơn rất cần thiết để khẳng định có phải hay không kiểm soát OLCs thúc đẩy các biến đổi sinh học trong trứng trưởng thành, cũng như sự toàn vẹn hệ gen khi đưa vào lâm sàng.
Tài liệu tham khảo
Grettka K, Idzik K, Lewandowska K, Świętek K, Palini S, Silvestris F. Ovarian Stem Cells for Women’s Infertility: State of the Art. Biomedicines. 2024;12(6):1139. doi:10.3390/biomedicines12061139
1. Giới thiệu
Có khá nhiều liệu pháp đang được ứng dụng trong các chương trình bảo tồn khả năng sinh sản (FP): phổ biến nhất là lấy trứng từ buồng trứng sau khi kích thích buồng trứng và gây trưởng thành trứng với thuốc nội tiết, sau đó thực hiện thụ tinh trong ống nghiệm (IVF) hay tiêm trực tiếp tinh trùng vào bào tương trứng (ICSI). Phương pháp này thường được sử dụng phổ biến cho bệnh nhân hiếm muộn, trong khi đó, với trường hợp cần bảo tồn khả năng sinh sản để điều trị ung thư (CTRI), trứng chọc hút được thường được bác sĩ tư vấn trữ lạnh và sau khi chữa khỏi ung thư mới thực hiện thụ tinh với tinh trùng. Tuy nhiên, quy trình này chưa được khuyến cáo nhiều vì nguy cơ ung thư vẫn còn tiềm ẩn, đặc biệt là ở những bệnh nhân bị những loại ung thư nhạy cảm với hormone.
Phương pháp tương đối phù hợp cho nhóm đối tượng trên, đặc biệt ở lứa tuổi trước dậy thì chính là đông lạnh vỏ buồng trứng và cấy ghép lại sau khi điều trị ung thư. Phương pháp không sử dụng hormone này dựa trên làm lạnh và sau đó thay thế các mảnh buồng trứng tự nhiên. Tuy nhiên tỷ lệ thành công của liệu pháp này khá thấp so với IVF và ICSI, đồng thời cũng được báo cáo là cấy ghép vỏ ban đầu có nguy cơ tái tạo ung thư.
Gần đây, lĩnh vực y học tái tạo đưa ra phương pháp sử dụng tế bào gốc, trong đó tế bào gốc buồng trứng (OSCs) mang lại tiềm năng rất lớn cho chương trình FP. Thực tế, dựa trên khả năng phát triển các tế bào giống tế bào trứng (OLCs) từ OSCs để thu được quần thể tế bào trứng trưởng thành, có tiềm năng trong việc lựa chọn OLCs thích hợp cho các chương trình FP để điều trị cả phụ nữ mắc POF và CTRI mà không có nguy cơ gây ung thư và hạn chế liên quan đến thời điểm trưởng thành của trứng.
2. Sự phát hiện tế bào mầm buồng trứng
Mặc dù có những giả thiết cho rằng tiền thân của trứng đã được cố định từ lúc sinh ra ở các động vật có vú cùng với thời kỳ mãn kinh phản ánh sự cạn kiệt nguồn dự trữ trong buồng trứng, một nhóm nghiên cứu đã mô tả sự hiện diện của tế bào gốc trong vỏ buồng trứng sau khi sinh của chuột, cụ thể là OSCs. Bằng việc sử dụng mô hình chuột, họ đã chứng minh rằng việc cấy ghép vỏ buồng trứng chứa OSCs sẽ dẫn đến hình thành noãn mới và điều trị vô sinh.
Nghiên cứu trên đã thổi một làn gió mới, dẫn đến hàng loạt các thử nghiệm thành công khác trên dê, lợn, chuột,...; những tế bào này cũng được đặc trưng bởi các đánh dấu màng – rất hữu ích cho việc phân lập của chúng khỏi vỏ buồng trứng cho các nghiên cứu tiếp theo xác định khía cạnh phân tử cũng như chức năng của chúng. Người ta cũng mô tả rằng OSCs được phát hiện trong vỏ buồng trứng ở độ tuổi trước và sau mãn kinh.
Bằng cách sử dụng phương pháp phân lập liên kết các phân tử cụ thể với màng OSCs, có thể làm sạch chúng khỏi các mảnh vỏ và tiếp tục nuôi cấy in vitro. Kết quả của các nghiên cứu sau đó là OSCs của phụ nữ có kích thước nhỏ hơn trứng trưởng thành, thường là 10 µm và tính nhất quán của quần thể tế bào này trong vỏ buồng trứng khá thấp so với các loại khác, khoảng 5%. Tuy nhiên, sau khi được phân lập, dưới môi trường nuôi cấy thích hợp, OSCs được duy trì và sau 3 tuần, chúng sẽ tăng trưởng về kích thước, có hình thái và số đo đặc trưng của tế bào đang trải qua tăng trưởng giống như tế bào mầm (hình dạng tròn với nhân lớn và đường kính từ 50-70 µm trở lên).
Một công nghệ mới giúp cải thiện sự phân lập khỏi dịch nuôi cấy bằng cách sử dụng máy phân loại tế bào cho phép bắt duy nhất một OSC để nghiên cứu. Trên thực tế, đánh giá phân tử cho thấy thời điểm trưởng thành đến OLCs in vitro (màng mất dấu phân tử đặc trưng và sự xuất hiện các dấu ấn khác). Khi đánh giá hàm lượng nhiễm sắc thể (NST) ở OLCs ngay sau giai đoạn 3 tuần thì chỉ còn một nửa trong số đó - tình trạng này được gọi là “đơn bội” và sẽ chuyển thành “lưỡng bội” sau khi tiếp xúc với tinh trùng.
3. Chọn lọc và nuôi cấy OSCs
Một trong những nghiên cứu quan trọng là xác định các protein đặc biệt được biểu hiện bởi OSCs cùng một số phân tử như Ddx4 và Fragile trên bề mặt – những receptor của chúng, điển hình cho sự phát triển dòng tế bào mầm và chỉ được tiếp xúc trong giai đoạn đầu phát triển. Do đó, bằng việc sử dụng các thuốc thử đặc hiệu cho những receptor này sẽ có thể phân lập được chúng, thuốc thử dùng cho Ddx4 và Fragile đều gồm các kháng thể có thể dễ dàng liên kết với các hóa chất phát hiện như huỳnh quang hay các vật liệu rắn giúp tách OSCs với kiểu phân lập dựa vào các hạt vi từ tính.
Quy trình phân lập: sinh thiết một mẫu nhỏ vỏ buồng trứng làm mẫu phân lập. Mảnh vỏ này thu được qua nội soi ổ bụng được xử lý nhanh chóng bằng collagenase giúp hòa tan các thành phần tế bào và tạo thành hỗn dịch tế bào chứa tất cả những gì hiện diện trong mảnh ban đầu. Sau đó, hỗn dịch được ủ với các kháng thể (anti-Ddx4 và anti-Fragile) liên hợp với các hạt vi từ tính mà có thể bắt được OSCs và tiếp tục đi qua từ trường để tách biệt với những thành phần không được gắn.
Trước khi nuôi cấy, để đảm bảo tính liên tục trong điều kiện cơ thể sống thì người ta thường chuẩn bị một lớp nuôi cấy (feeder layer) để tạo lớp đệm giúp các tế bào duy trì khả năng sống và tăng kích thước. Các tế bào trung mô từ lớp mỡ dưới da hoặc máu ngoại vi khá phù hợp để tạo môi trường in vivo, thúc đẩy việc duy trì ổn định và trưởng thành của OSCs in vitro. Tuy nhiên, điểm quan trọng để đảm bảo sự thành lập tối ưu là môi trường nuôi cấy; trên thực tế thường phải thêm một lượng protein, hormone FSH, LH, estradiol, yếu tố tăng trưởng biểu bì (EGF).

Hình 1. Các bước phân lập và nuôi cấy OSCs
Sau khi phân lập thành công, các đánh giá chi tiết về tạp chất và quy mô quần thể là rất cần thiết. Phân tích tế bào dòng chảy sử dụng huỳnh quang để phát hiện OSCs gắn với kháng thể cho các tín hiệu tích cực về cách phân lập này.

Hình 2. Kết quả phân tích tế bào dòng chảy ở hai bệnh nhân
Trong quá trình nuôi cấy, việc kiểm tra liên tục các ống nuôi cấy OSCs được thực hiện thường xuyên để đánh giá sự tăng lên về kích thước. Khởi điểm với đường kính khoảng 7-10 µm lúc phân lập đến 20 µm sau 1 tuần và tiếp tục tăng từ từ ở những tuần tiếp theo. Sau tuần thứ 3, chúng có thể đạt đến 50-70 µm – gần với kích thước của trứng trưởng thành (80-100 µm). Ngoài ra, trong quá trình trưởng thành, OSCs trải qua sự thay đổi hình thái ở cả tế bào chất và nhân, trong đó ở những ngày cuối, chúng đẩy một phần nhân qua một túi bề mặt gọi là thể cực, nơi chứa toàn bộ NST, khi đó có thể chắc chắn OSCs đã thành OLCs khi sự đùn thể cực liên quan đến việc thụ tinh.
.png)
Hình 3. Sự thay đổi hình thái và kích thước của OSCs, phát triển thành OLCs và cuối cùng là trứng trưởng thành
4. Kết quả
Trong một nghiên cứu gần đây với cỡ mẫu là 21 bệnh nhân có độ tuổi trung bình là 36, trong đó 20 người vô sinh do POF và một đối tượng mắc CTRI, mục đích của nghiên cứu để đánh giá khả năng thu được OLCs từ nhóm phụ nữ này. Như dự đoán, nồng độ anti-Müllerian hormone (AMH) trong huyết tương thấp ở tất cả phụ nữ, cung cấp thêm bằng chứng bổ sung rằng nồng độ AMH thấp có liên quan trực tiếp đến tình trạng rụng trứng không hiệu quả - trở thành một marker độc lập cho vô sinh ở cả người trẻ và lớn tuổi.
Khu trú trong thử nghiệm, sử dụng phương pháp phân tích tế bào dòng chảy đã cho thấy sự xuất hiện của OSCs trong tổng quần thể tế bào vỏ buồng trứng là gần 15%, củng cố giả thiết rằng sự có mặt của OSCs ở người mắc POF không phụ thuộc đến nồng độ AMH, chất mà, như đã dự đoán, không có hiệu ứng lên tế bào gốc.
5. Tiềm năng áp dụng trong tương lai
Ngày nay, việc áp dụng OLCs từ OSCs trong các chương trình FP mang lại nhiều lợi ích cho đối tượng nhạy cảm với hormone. Trên thực tế, đông lạnh trứng vẫn được xem là phương pháp thành công nhất để mang thai sau khi chữa khỏi ung thư, nhưng nguy cơ của việc kích thích khối u thông qua estrogen đang chưa được đánh giá với một nhược điểm nữa là khả năng sống của trứng ở vỏ rã đông.
Mặt khác, việc chọn lựa OLCs để đông lạnh diễn ra rất khắc nghiệt, cần phải được đảm bảo về khả năng sống và chất lượng. Do đó nhìn chung thì phương pháp này khá an toàn và không có nguy cơ kích hoạt ung thư. Các nghiên cứu sâu hơn rất cần thiết để khẳng định có phải hay không kiểm soát OLCs thúc đẩy các biến đổi sinh học trong trứng trưởng thành, cũng như sự toàn vẹn hệ gen khi đưa vào lâm sàng.
Tài liệu tham khảo
Grettka K, Idzik K, Lewandowska K, Świętek K, Palini S, Silvestris F. Ovarian Stem Cells for Women’s Infertility: State of the Art. Biomedicines. 2024;12(6):1139. doi:10.3390/biomedicines12061139
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Tiền Hội nghị: Trung tâm Hội nghị Grand Saigon, thứ bảy ngày ...
Năm 2020
New World Saigon hotel, thứ bảy 14 tháng 06 năm 2025 (12:00 - 16:00)
Năm 2020
Vinpearl Landmark 81, ngày 9-10 tháng 8 năm 2025
GIỚI THIỆU SÁCH MỚI
Kính mời quý đồng nghiệp quan tâm đến hỗ trợ sinh sản tham ...
Y học sinh sản số 73 (Quý I . 2025) ra mắt ngày 20 . 3 . 2025 và ...
Sách ra mắt ngày 6 . 1 . 2025 và gửi đến quý hội viên trước ...
FACEBOOK








