Tin chuyên ngành
on Monday 31-03-2025 12:38pm
Danh mục: Vô sinh & hỗ trợ sinh sản
CNSH. Nguyễn Thị Trang, CNSH. Nguyễn Thị Cẩm Nhung, ThS. Phan Thị Kim Anh
IVFMD Tân Bình - Bệnh viện Đa khoa Mỹ Đức
Lời mở đầu
Theo Tổ chức Y tế Thế giới (WHO), vô sinh là tình trạng một cặp vợ chồng không có thai sau 12 tháng chung sống, giao hợp bình thường mà không sử dụng các biện pháp tránh thai. Trong đó yếu tố nam giới đóng vai trò quan trọng, đóng góp khoảng 50% tổng số ca vô sinh [1]. Việc xác định nguyên nhân gây vô sinh nam đòi hỏi kết hợp bệnh sử và xét nghiệm tinh dịch đồ. Tuy nhiên, chỉ đánh giá tinh dịch là chưa đủ để nhận diện những trường hợp vô sinh chưa rõ nguyên nhân. Do đó, các nghiên cứu phân tử không xâm lấn đóng vai trò quan trọng trong việc thu thập thông tin cần thiết để đánh giá và chẩn đoán những trường hợp này. Một trong những phân tử có tiềm năng cao trong nghiên cứu vô sinh nam và đang thu hút sự quan tâm của nhiều nhà khoa học là miRNA. Các nghiên cứu gần đây cho thấy hồ sơ biểu hiện của miRNA có liên quan đến các kiểu hình vô sinh nam khác nhau, có thể có tiềm năng trở thành công cụ đánh giá vô sinh nam trong tương lai. Trong bài viết này chúng tôi đề cập đến vai trò và ảnh hưởng của miRNA tinh trùng đến khả năng sinh sản nam giới. Bên cạnh đó, bài viết cũng đề cập sơ bộ đến các hướng nghiên cứu tiềm năng và ứng dụng lâm sàng trong tương lai của miRNA, mở ra triển vọng cho các phương pháp chẩn đoán và điều trị vô sinh nam hiệu quả hơn.

Hình 1. Sơ đồ về sự tương tác giữa miRNA trưởng thành (mạch trên) và mRNA mục tiêu của nó (mạch dưới). Vùng lõi trên miRNA bắt đầu từ nucleotide số 2-8 [2]
Quá trình sinh tổng hợp miRNA trong tinh trùng là quá trình phức tạp, bao gồm nhiều bước (hình 1) [3]. Đầu tiên, các gen mã hóa miRNA được enzyme RNA Polymerase II phiên mã tạo thành phân tử tiền chất miRNA lớn gọi là pri-miRNA. Pri-miRNA được xử lý trong nhân bởi enzyme RNase III Drosha cùng với DGCR8 tạo ra tiền miRNA (pre-miRNA) có cấu trúc vòng thân không hoàn chỉnh. Các bản phiên mã này sau đó được đưa ra khỏi nhân và được xử lý để tạo miRNA trưởng thành. Sau đó miRNA trưởng thành liên kết với phức hợp protein RISC (RNA induced silencing complex), để ức chế mRNA mục tiêu, điều hòa nhiều quá trình sinh học quan trọng bao gồm ngăn cản mRNA tham gia vào quá trình dịch mã, hoặc làm bất ổn định hoặc phân hủy mRNA mục tiêu.

Hình 2. Quá trình sinh tổng hợp và cơ chế hoạt động của miRNA [3]
Theo nghiên cứu của Zhao và cộng sự vào năm 2023, có tất cả 2160 miRNAs được phát hiện trong tinh trùng [4]. Các miRNA này có vai trò quan trọng trong quá trình điều hoà sự sinh tinh ở nam giới. Trong đó những nhóm miRNA quan trọng bao gồm let-7, miR-202, miR-21, miR-34b/c.
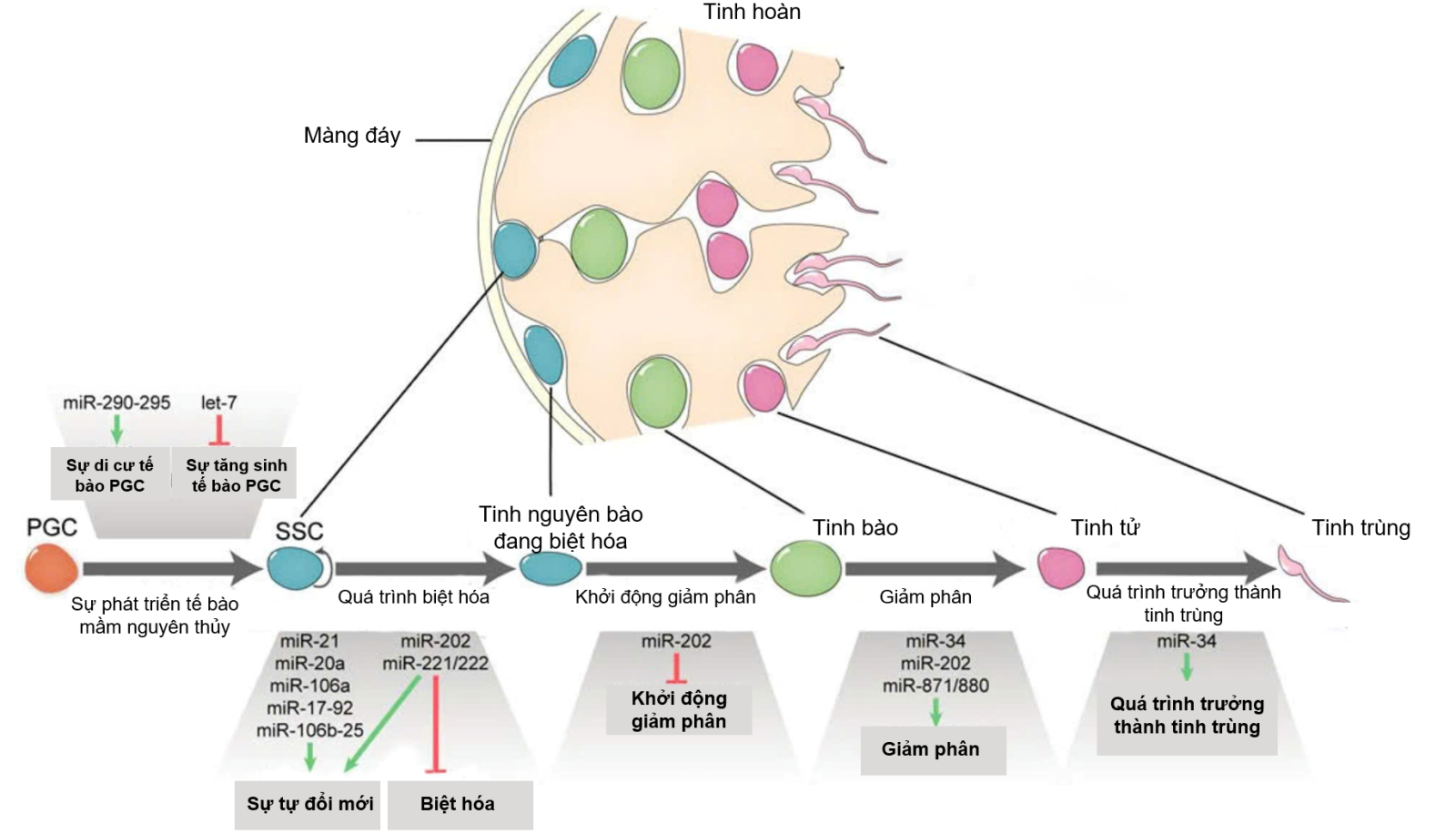
Hình 3. Sự tham gia của miRNAs ở các giai đoạn khác nhau của quá trình sinh tinh (PGC – tế bào mầm nguyên thủy, SSC: tế bào gốc sinh tinh) [5]
Lethal-7 (let-7) là một trong hai miRNAs được phát hiện đầu tiên ở giun tròn. Trong quá trình sinh tinh miRNA let-7 có vai trò thúc đẩy quá trình biệt hóa của tinh nguyên bào dưới sự kích thích của axit retinoic (RA),cơ chế này có liên quan đến giảm sự biểu hiện của các gene có liên quan đến quá trình tăng sinh như Mycn, Ccnd1 và Col1a2 [6].
miR-202 tạo ra hai miRNA bổ sung, miR-202-5p và miR-202-3p, cả hai đều được biểu hiện cao và đặc hiệu trong tinh hoàn. Ở chuột mất gene mã hóa cho miR-202 quá trình khởi động giảm phân diễn ra sớm hơn bình thường cho thấy vai trò quan trọng của miRNA này [7].
miR-21 chịu sự kiểm soát bởi yếu tố phiên mã ETV5, yếu tố quan trọng đối với quá trình tự đổi mới của tế bào SSC. Vai trò của miR-21 được phát hiện khi cho lây nhiễm tế bào SSC bằng chất ức chế miR-21, kết quả cho những tế bào này có tỷ lệ tế bào chết theo chương trình cao và số lượng tế bào mầm giảm đi đáng kể [8].
miR-34b/c là hai thành viên trong họ miR-34 (miR-34a, 34b và 34c) được bảo tồn ở động vật có xương sống và biểu hiện cao ở tinh bào ở giai đoạn pachytene và tinh tử [9]. Thiếu hụt miR-34b/c thật sự làm tổn thương quá trình giảm phân và giai đoạn cuối của quá trình trưởng thành của tinh trùng dẫn đến các bất thường bao gồm biểu mô ống sinh tinh mỏng hơn, giảm số lượng tinh tử kéo dài, tăng tỷ lệ apoptosis ở tinh bào [10]. Bên cạnh đó, việc xóa loci mã hóa cho miR-34b/c còn dẫn đến mật độ tinh trùng thấp và tinh trùng có hình thái và di động bất thường ở chuột [10]. Ngoài việc tham gia điều hòa quá trình sinh tinh, miR-34c trong tinh trùng còn đóng vai trò quan trọng trong lần phân chia đầu tiên ở phôi chuột [11]. Tuy nhiên, vấn đề này vẫn còn đang tranh cãi bởi có một nghiên khác cho thấy chuột đực không có miR-34b/c có khả năng sinh sản bình thường và việc tiêm tinh trùng của những con chuôt này vào noãn vẫn cho quá trình thụ tinh, tiền làm tổ và tỷ lệ sinh bình thường [12].


Bảng 1. Mối quan hệ giữa miRNA và vô sinh nam (A: asthenozoospermia, O: oligozoospermia, T: teratozoospermia, OA: oligoasthenozoospermia, AT: asthenoteratozoospermia, N: nam giới có khả năng sinh sản, NI: nam giới vô sinh có tinh dịch đồ bình thường,↑: tăng biểu hiện đáng kể,↓: giảm biểu hiện đáng kể)
Trong trường hợp vô sinh không do yếu tố nam, khi so sánh sự biểu hiện của miRNAs giữa nhóm vô sinh có tinh dịch đồ bình thường và nhóm có khả năng sinh sản, Salas-Huetos và cộng sự đã phát hiện 45 miRNAs tăng biểu hiện và 12 miRNAs giảm biểu hiện đáng kể ở nhóm vô sinh có tinh dịch đồ bình thường. Nghiên cứu cũng xác định 20 miRNA có sự điều hòa bởi các gene chủ (host gene promoter), trong đó có 3 gene quan trọng liên quan đến sự phát triển của phôi. Ngoài ra, 57 miRNA khác được phát hiện có ảnh hưởng đến các gene kiểm soát quá trình định hướng tế bào phôi và biến đổi cấu trúc chromatin. Điều này làm dấy lên giả thuyết rằng nếu sự điều hòa các gene này bị rối loạn, nó có thể dẫn đến sự mất cân bằng trong biểu hiện của các miRNA tương ứng, từ đó ảnh hưởng đến các gene quan trọng trong phát triển phôi. Những bất thường này có thể là nguyên nhân gây ra các khiếm khuyết trong giai đoạn phát triển phôi sớm, có thể là nguyên nhân gây thất bại IVF/ICSI nhiều lần ở nhóm vô sinh có tinh dịch bình thường [13].
Một nghiên cứu của Yeh và cộng sự vào năm 2022 trên nhóm bệnh nhân thực hiện ICSI có hình dạng tinh trùng bất thường cho thấy, mức độ biểu hiện của miR-34b và miR-34c có liên quan tới tăng tỷ lệ làm tổ và trẻ sinh sống. Tuy nhiên, cần có thêm nghiên cứu để xác nhận trước khi có thể sử dụng chúng như một chỉ số tham chiếu lâm sàng [14].
Việc lựa chọn dấu ấn sinh học trong chẩn đoán cần đảm bảo độ chính xác, ổn định và đáng tin cậy. Tuy nhiên, các dấu ấn hiện tại vẫn gặp hạn chế về độ đặc hiệu, dễ bị ảnh hưởng bởi yếu tố môi trường và có tỷ lệ dương tính giả cao [15].
Nhiều nghiên cứu đã làm sáng tỏ mối liên hệ giữa sự biểu hiện của các miRNA trong tinh trùng và khả năng sinh sản nam giới, đặc biệt ở những trường hợp có bất thường về tinh dịch đồ như mật độ tinh trùng thấp, độ di động suy giảm và hình thái bất thường (Bảng 1). Trong nghiên cứu của Salas-Huetos và cộng sự trên 40 mẫu, phân tích 736 miRNAs ở nhóm OAT và nhóm đối chứng có khả năng sinh sản cho thấy hsa-miR-629-3p có mối tương quan thuận với độ di động của tinh trùng, trong khi ba miRNA khác (hsa-miR-335-5p, hsa-miR-885-5p và hsa-miR-152-3p) có tương quan thuận với mật độ tinh trùng. Tổng hợp dữ liệu từ các nghiên cứu trước đây và phân tích trên 161 mẫu bệnh phẩm, bao gồm nhóm O/OA/A, nhóm vô sinh có tinh dịch đồ bình thường (NI), và nhóm có khả năng sinh sản (N), Tomic và cộng sự đã xác định hsa-miR-9-3p, hsa-miR-30b-5p và hsa-miR-122-5p là những dấu ấn sinh học tiềm năng cho vô sinh nam và chất lượng tinh trùng. Điều Các nghiên cứu trên cho thấy rằng miRNAs có tiềm năng như một dấu ấn sinh học để chẩn đoán vô sinh nam.
miRNA có nhiều ưu điểm vượt trội, đặc biệt ở người, khoảng 30% gene mã hóa protein được điều hòa bởi miRNA, ảnh hưởng lên sự biểu hiện của gene có liên quan đến nhiều quá trình sinh học quan trọng như quá trình tăng sinh tế bào, phân tách dòng tế bào gốc, chết theo chương trình,... Ngoài ra, với tính ổn định cao và sự hiện diện rộng rãi trong nhiều dịch sinh học như huyết tương, nước bọt, tinh tương, miRNA giúp cung cấp một công cụ chẩn đoán chính xác không xâm lấn Hiện nay có nhiều công nghệ tiên tiến như microarray, giải trình tự sâu (deep-sequencing) và qRT-PCR đã giúp việc định lượng miRNA trở nênhiệu quả hơn cũng như phát hiện miRNA mới có liên quan đến khả năng sinh sản [15].
Tuy nhiên, việc ứng dụng miRNA trong chẩn đoán lâm sàng còn thách thức, đòi hỏi xác nhận bổ sung, chuẩn hóa quy trình và kiểm soát sai số kỹ thuật. Cần mở rộng phương pháp phân lập RNA ngoại bào từ nhiều dịch cơ thể và giảm thiểu khác biệt giữa các phòng thí nghiệm để đảm bảo độ tin cậy trong thực hành lâm sàng.
3.2. miRNA và tiềm năng điều trị vô sinh nam
Các nghiên cứu đã chỉ ra rằng, bên cạnh giá trị chẩn đoán, miRNA còn có thể đóng vai trò quan trọng trong lĩnh vực điều trị. Phương pháp tiếp cận này tập trung vào việc điều chỉnh mức độ biểu hiện của miRNA, nhằm khôi phục sự cân bằng sinh học và giảm thiểu tác động của các rối loạn. Bằng cách tăng cường hoặc ức chế các miRNA cụ thể, liệu pháp này có thể giúp điều hòa quá trình sinh tinh và cải thiện khả năng sinh sản nam giới.
Cho đến nay, hai phương pháp điều trị dựa trên miRNA đã được sử dụng, bao gồm anti-miRs và miRNA mimics. Anti-miRs, hay còn gọi là chất ức chế miRNA, là các axit nucleic mạch đơn được biến đổi hóa học để liên kết đặc hiệu và ức chế các phân tử miRNA mục tiêu trong tế bào. Trong khi đó, miRNA mimics là các miRNA tổng hợp hóa học có khả năng bắt chước các miRNA tự nhiên sau khi được chuyển nạp vào tế bào [16]. Việc phân phối miRNA đến tế bào đích rất quan trọng , các phương pháp vận chuyển miRNAs có thể được chia thành 2 nhóm chính: sử dụng vector virus hoặc không dùng vector virus (vector lipid, polymer, hạt vô cơ như vàng (Au), túi ngoại bào (EV), peptide…). Mỗi phương pháp có cách xâm nhập riêng nhưng nhìn chung chúng có thể được chia thành hai cơ chế chính: xâm nhập trực tiếp hoặc nhập bào. Hiện nay, liệu pháp miRNA đã được thử nghiệm đối với nhiều loại ung thư và một số bệnh lý khác. Ví dụ về việc ứng dụng miRNA trong điều trị ung thư là MRX34, một liệu pháp miRNA mimic dựa trên miR-34. MRX34 từng được thử nghiệm ở giai đoạn 1 và đã ức chế thành công sự phát triển của khối u rắn ở người [17]. Ngoài ra, Cobomarsen là một chất ức chế miR-155 được tổng hợp dưới dạng oligonucleotide đã được biến đổi. Trong thử nghiệm lâm sàng giai đoạn 1, cobomarsen đã được đánh giá trên các bệnh ung thư huyết học, kết quả cho thấy nó có tác dụng làm giảm sự phát triển của khối U lympho tế bào B lớn lan tỏa (diffuse large B-cell lymphoma) [18]. Trong điều trị vô sinh nam, hầu hết các nghiên cứu áp dụng trên mô hình động vật nhưng hướng đi này giúp mở ra các chiến lược điều trị khả quan trên người. Tuy nhiên, vẫn tồn tại một số thách thức trong lĩnh vực này, chẳng hạn như việc phân phối chính xác các tác nhân điều trị đến các tế bào đích cũng như tránh gây phản ứng miễn dịch.
3.3. miRNA trong tinh tương dự đoán sự tồn tại của tinh trùng/tinh nguyên bào trong tinh hoàn ở bệnh nhân NOA (Non-Obstructive Azoospermia)
miRNA trong tinh tương đang được nghiên cứu như một dấu ấn sinh học tiềm năng giúp dự đoán khả năng thu hồi tinh trùng thành công, cũng như sự tồn tại của tinh trùng hoặc tinh nguyên bào ở bệnh nhân vô tinh không do tắc nghẽn (NOA). Hướng đi này có thể tối ưu hóa quy trình chẩn đoán, giúp phân loại chính xác bệnh nhân và cải thiện hiệu quả điều trị.
Gần đây, Zhang và cộng sự đã phát triển một mô hình nhằm dự đoán khả năng thu hồi tinh trùng thành công ở bệnh nhân NOA với độ chính xác khá cao (AUC = 0.972) [19]. Trong một nghiên cứu khác, Willems và cộng sự cũng đã xác định 9 miRNAs có mức độ biểu hiện cao đáng kể và 6 miRNAs có biểu hiện giảm đáng kể hiện giữa bệnh nhân NOA có tinh trùng (TESE+) và không có tinh trùng (TESE-), cho thấy chúng có thể được sử dụng để dự đoán khả năng thu hồi tinh trùng từ tinh hoàn. Ngoài ra, 14 miRNAs có liên quan đến sự hiện diện của tinh nguyên bào cũng được phát hiện, cung cấp thêm thông tin về khả năng sinh tinh của bệnh nhân [20]. Những nghiên cứu về hướng đi này còn hạn chế, tuy nhiên nếu thành công những dấu ấn sinh học này có thể giúp ích rất nhiều trong việc đưa ra quyết định lâm sàng. Nếu xét nghiệm miRNA chỉ ra sự hiện diện của tinh trùng, thủ thuật TESE sẽ được thực hiện. Trong trường hợp kết quả âm tính, việc kiểm tra miRNA liên quan đến tinh nguyên bào có thể giúp xác định bệnh nhân có khả năng sinh tinh còn sót lại, từ đó hỗ trợ quyết định sinh thiết tinh hoàn. Với những tiến bộ trong công nghệ nuôi cấy tinh trùng trong ống nghiệm, hướng tiếp cận này có thể mở ra cơ hội điều trị mới cho bệnh nhân NOA trong tương lai [20].
Trong chẩn đoán vô sinh, đặc biệt ở những trường hợp vô sinh không rõ nguyên nhân (CRNN), miRNA trong tinh trùng có thể kết hợp với các xét nghiệm truyền thống để nâng cao độ chính xác, giúp xác định nguyên nhân một cách hiệu quả hơn.
Bên cạnh việc chẩn đoán, miRNA còn mở ra tiềm năng lớn trong điều trị vô sinh nam trong tương lai. Đặc biệt, miRNA trong huyết tương tinh dịch có thể đóng vai trò như một dấu ấn sinh học, giúp dự đoán sự hiện diện của tinh trùng, tinh nguyên bào cũng như tỷ lệ thu hồi tinh trùng thành công ở bệnh nhân vô tinh không do tắc nghẽn (NOA), góp phần tối ưu hóa chiến lược điều trị và nâng cao cơ hội làm cha cho bệnh nhân.
TÀI LIỆU THAM KHẢO
IVFMD Tân Bình - Bệnh viện Đa khoa Mỹ Đức
Lời mở đầu
Theo Tổ chức Y tế Thế giới (WHO), vô sinh là tình trạng một cặp vợ chồng không có thai sau 12 tháng chung sống, giao hợp bình thường mà không sử dụng các biện pháp tránh thai. Trong đó yếu tố nam giới đóng vai trò quan trọng, đóng góp khoảng 50% tổng số ca vô sinh [1]. Việc xác định nguyên nhân gây vô sinh nam đòi hỏi kết hợp bệnh sử và xét nghiệm tinh dịch đồ. Tuy nhiên, chỉ đánh giá tinh dịch là chưa đủ để nhận diện những trường hợp vô sinh chưa rõ nguyên nhân. Do đó, các nghiên cứu phân tử không xâm lấn đóng vai trò quan trọng trong việc thu thập thông tin cần thiết để đánh giá và chẩn đoán những trường hợp này. Một trong những phân tử có tiềm năng cao trong nghiên cứu vô sinh nam và đang thu hút sự quan tâm của nhiều nhà khoa học là miRNA. Các nghiên cứu gần đây cho thấy hồ sơ biểu hiện của miRNA có liên quan đến các kiểu hình vô sinh nam khác nhau, có thể có tiềm năng trở thành công cụ đánh giá vô sinh nam trong tương lai. Trong bài viết này chúng tôi đề cập đến vai trò và ảnh hưởng của miRNA tinh trùng đến khả năng sinh sản nam giới. Bên cạnh đó, bài viết cũng đề cập sơ bộ đến các hướng nghiên cứu tiềm năng và ứng dụng lâm sàng trong tương lai của miRNA, mở ra triển vọng cho các phương pháp chẩn đoán và điều trị vô sinh nam hiệu quả hơn.
- Cấu tạo, vai trò và cơ chế hoạt động của miRNA tinh trùng

Hình 1. Sơ đồ về sự tương tác giữa miRNA trưởng thành (mạch trên) và mRNA mục tiêu của nó (mạch dưới). Vùng lõi trên miRNA bắt đầu từ nucleotide số 2-8 [2]
Quá trình sinh tổng hợp miRNA trong tinh trùng là quá trình phức tạp, bao gồm nhiều bước (hình 1) [3]. Đầu tiên, các gen mã hóa miRNA được enzyme RNA Polymerase II phiên mã tạo thành phân tử tiền chất miRNA lớn gọi là pri-miRNA. Pri-miRNA được xử lý trong nhân bởi enzyme RNase III Drosha cùng với DGCR8 tạo ra tiền miRNA (pre-miRNA) có cấu trúc vòng thân không hoàn chỉnh. Các bản phiên mã này sau đó được đưa ra khỏi nhân và được xử lý để tạo miRNA trưởng thành. Sau đó miRNA trưởng thành liên kết với phức hợp protein RISC (RNA induced silencing complex), để ức chế mRNA mục tiêu, điều hòa nhiều quá trình sinh học quan trọng bao gồm ngăn cản mRNA tham gia vào quá trình dịch mã, hoặc làm bất ổn định hoặc phân hủy mRNA mục tiêu.

Hình 2. Quá trình sinh tổng hợp và cơ chế hoạt động của miRNA [3]
Theo nghiên cứu của Zhao và cộng sự vào năm 2023, có tất cả 2160 miRNAs được phát hiện trong tinh trùng [4]. Các miRNA này có vai trò quan trọng trong quá trình điều hoà sự sinh tinh ở nam giới. Trong đó những nhóm miRNA quan trọng bao gồm let-7, miR-202, miR-21, miR-34b/c.

Hình 3. Sự tham gia của miRNAs ở các giai đoạn khác nhau của quá trình sinh tinh (PGC – tế bào mầm nguyên thủy, SSC: tế bào gốc sinh tinh) [5]
Lethal-7 (let-7) là một trong hai miRNAs được phát hiện đầu tiên ở giun tròn. Trong quá trình sinh tinh miRNA let-7 có vai trò thúc đẩy quá trình biệt hóa của tinh nguyên bào dưới sự kích thích của axit retinoic (RA),cơ chế này có liên quan đến giảm sự biểu hiện của các gene có liên quan đến quá trình tăng sinh như Mycn, Ccnd1 và Col1a2 [6].
miR-202 tạo ra hai miRNA bổ sung, miR-202-5p và miR-202-3p, cả hai đều được biểu hiện cao và đặc hiệu trong tinh hoàn. Ở chuột mất gene mã hóa cho miR-202 quá trình khởi động giảm phân diễn ra sớm hơn bình thường cho thấy vai trò quan trọng của miRNA này [7].
miR-21 chịu sự kiểm soát bởi yếu tố phiên mã ETV5, yếu tố quan trọng đối với quá trình tự đổi mới của tế bào SSC. Vai trò của miR-21 được phát hiện khi cho lây nhiễm tế bào SSC bằng chất ức chế miR-21, kết quả cho những tế bào này có tỷ lệ tế bào chết theo chương trình cao và số lượng tế bào mầm giảm đi đáng kể [8].
miR-34b/c là hai thành viên trong họ miR-34 (miR-34a, 34b và 34c) được bảo tồn ở động vật có xương sống và biểu hiện cao ở tinh bào ở giai đoạn pachytene và tinh tử [9]. Thiếu hụt miR-34b/c thật sự làm tổn thương quá trình giảm phân và giai đoạn cuối của quá trình trưởng thành của tinh trùng dẫn đến các bất thường bao gồm biểu mô ống sinh tinh mỏng hơn, giảm số lượng tinh tử kéo dài, tăng tỷ lệ apoptosis ở tinh bào [10]. Bên cạnh đó, việc xóa loci mã hóa cho miR-34b/c còn dẫn đến mật độ tinh trùng thấp và tinh trùng có hình thái và di động bất thường ở chuột [10]. Ngoài việc tham gia điều hòa quá trình sinh tinh, miR-34c trong tinh trùng còn đóng vai trò quan trọng trong lần phân chia đầu tiên ở phôi chuột [11]. Tuy nhiên, vấn đề này vẫn còn đang tranh cãi bởi có một nghiên khác cho thấy chuột đực không có miR-34b/c có khả năng sinh sản bình thường và việc tiêm tinh trùng của những con chuôt này vào noãn vẫn cho quá trình thụ tinh, tiền làm tổ và tỷ lệ sinh bình thường [12].
- Ảnh hưởng của miRNA lên chất lượng tinh trùng và khả năng sinh sản của nam giới


Bảng 1. Mối quan hệ giữa miRNA và vô sinh nam (A: asthenozoospermia, O: oligozoospermia, T: teratozoospermia, OA: oligoasthenozoospermia, AT: asthenoteratozoospermia, N: nam giới có khả năng sinh sản, NI: nam giới vô sinh có tinh dịch đồ bình thường,↑: tăng biểu hiện đáng kể,↓: giảm biểu hiện đáng kể)
Trong trường hợp vô sinh không do yếu tố nam, khi so sánh sự biểu hiện của miRNAs giữa nhóm vô sinh có tinh dịch đồ bình thường và nhóm có khả năng sinh sản, Salas-Huetos và cộng sự đã phát hiện 45 miRNAs tăng biểu hiện và 12 miRNAs giảm biểu hiện đáng kể ở nhóm vô sinh có tinh dịch đồ bình thường. Nghiên cứu cũng xác định 20 miRNA có sự điều hòa bởi các gene chủ (host gene promoter), trong đó có 3 gene quan trọng liên quan đến sự phát triển của phôi. Ngoài ra, 57 miRNA khác được phát hiện có ảnh hưởng đến các gene kiểm soát quá trình định hướng tế bào phôi và biến đổi cấu trúc chromatin. Điều này làm dấy lên giả thuyết rằng nếu sự điều hòa các gene này bị rối loạn, nó có thể dẫn đến sự mất cân bằng trong biểu hiện của các miRNA tương ứng, từ đó ảnh hưởng đến các gene quan trọng trong phát triển phôi. Những bất thường này có thể là nguyên nhân gây ra các khiếm khuyết trong giai đoạn phát triển phôi sớm, có thể là nguyên nhân gây thất bại IVF/ICSI nhiều lần ở nhóm vô sinh có tinh dịch bình thường [13].
Một nghiên cứu của Yeh và cộng sự vào năm 2022 trên nhóm bệnh nhân thực hiện ICSI có hình dạng tinh trùng bất thường cho thấy, mức độ biểu hiện của miR-34b và miR-34c có liên quan tới tăng tỷ lệ làm tổ và trẻ sinh sống. Tuy nhiên, cần có thêm nghiên cứu để xác nhận trước khi có thể sử dụng chúng như một chỉ số tham chiếu lâm sàng [14].
- Một số tiềm năng ứng dụng của miRNA trong chẩn đoán vô sinh nam
Việc lựa chọn dấu ấn sinh học trong chẩn đoán cần đảm bảo độ chính xác, ổn định và đáng tin cậy. Tuy nhiên, các dấu ấn hiện tại vẫn gặp hạn chế về độ đặc hiệu, dễ bị ảnh hưởng bởi yếu tố môi trường và có tỷ lệ dương tính giả cao [15].
Nhiều nghiên cứu đã làm sáng tỏ mối liên hệ giữa sự biểu hiện của các miRNA trong tinh trùng và khả năng sinh sản nam giới, đặc biệt ở những trường hợp có bất thường về tinh dịch đồ như mật độ tinh trùng thấp, độ di động suy giảm và hình thái bất thường (Bảng 1). Trong nghiên cứu của Salas-Huetos và cộng sự trên 40 mẫu, phân tích 736 miRNAs ở nhóm OAT và nhóm đối chứng có khả năng sinh sản cho thấy hsa-miR-629-3p có mối tương quan thuận với độ di động của tinh trùng, trong khi ba miRNA khác (hsa-miR-335-5p, hsa-miR-885-5p và hsa-miR-152-3p) có tương quan thuận với mật độ tinh trùng. Tổng hợp dữ liệu từ các nghiên cứu trước đây và phân tích trên 161 mẫu bệnh phẩm, bao gồm nhóm O/OA/A, nhóm vô sinh có tinh dịch đồ bình thường (NI), và nhóm có khả năng sinh sản (N), Tomic và cộng sự đã xác định hsa-miR-9-3p, hsa-miR-30b-5p và hsa-miR-122-5p là những dấu ấn sinh học tiềm năng cho vô sinh nam và chất lượng tinh trùng. Điều Các nghiên cứu trên cho thấy rằng miRNAs có tiềm năng như một dấu ấn sinh học để chẩn đoán vô sinh nam.
miRNA có nhiều ưu điểm vượt trội, đặc biệt ở người, khoảng 30% gene mã hóa protein được điều hòa bởi miRNA, ảnh hưởng lên sự biểu hiện của gene có liên quan đến nhiều quá trình sinh học quan trọng như quá trình tăng sinh tế bào, phân tách dòng tế bào gốc, chết theo chương trình,... Ngoài ra, với tính ổn định cao và sự hiện diện rộng rãi trong nhiều dịch sinh học như huyết tương, nước bọt, tinh tương, miRNA giúp cung cấp một công cụ chẩn đoán chính xác không xâm lấn Hiện nay có nhiều công nghệ tiên tiến như microarray, giải trình tự sâu (deep-sequencing) và qRT-PCR đã giúp việc định lượng miRNA trở nênhiệu quả hơn cũng như phát hiện miRNA mới có liên quan đến khả năng sinh sản [15].
Tuy nhiên, việc ứng dụng miRNA trong chẩn đoán lâm sàng còn thách thức, đòi hỏi xác nhận bổ sung, chuẩn hóa quy trình và kiểm soát sai số kỹ thuật. Cần mở rộng phương pháp phân lập RNA ngoại bào từ nhiều dịch cơ thể và giảm thiểu khác biệt giữa các phòng thí nghiệm để đảm bảo độ tin cậy trong thực hành lâm sàng.
3.2. miRNA và tiềm năng điều trị vô sinh nam
Các nghiên cứu đã chỉ ra rằng, bên cạnh giá trị chẩn đoán, miRNA còn có thể đóng vai trò quan trọng trong lĩnh vực điều trị. Phương pháp tiếp cận này tập trung vào việc điều chỉnh mức độ biểu hiện của miRNA, nhằm khôi phục sự cân bằng sinh học và giảm thiểu tác động của các rối loạn. Bằng cách tăng cường hoặc ức chế các miRNA cụ thể, liệu pháp này có thể giúp điều hòa quá trình sinh tinh và cải thiện khả năng sinh sản nam giới.
Cho đến nay, hai phương pháp điều trị dựa trên miRNA đã được sử dụng, bao gồm anti-miRs và miRNA mimics. Anti-miRs, hay còn gọi là chất ức chế miRNA, là các axit nucleic mạch đơn được biến đổi hóa học để liên kết đặc hiệu và ức chế các phân tử miRNA mục tiêu trong tế bào. Trong khi đó, miRNA mimics là các miRNA tổng hợp hóa học có khả năng bắt chước các miRNA tự nhiên sau khi được chuyển nạp vào tế bào [16]. Việc phân phối miRNA đến tế bào đích rất quan trọng , các phương pháp vận chuyển miRNAs có thể được chia thành 2 nhóm chính: sử dụng vector virus hoặc không dùng vector virus (vector lipid, polymer, hạt vô cơ như vàng (Au), túi ngoại bào (EV), peptide…). Mỗi phương pháp có cách xâm nhập riêng nhưng nhìn chung chúng có thể được chia thành hai cơ chế chính: xâm nhập trực tiếp hoặc nhập bào. Hiện nay, liệu pháp miRNA đã được thử nghiệm đối với nhiều loại ung thư và một số bệnh lý khác. Ví dụ về việc ứng dụng miRNA trong điều trị ung thư là MRX34, một liệu pháp miRNA mimic dựa trên miR-34. MRX34 từng được thử nghiệm ở giai đoạn 1 và đã ức chế thành công sự phát triển của khối u rắn ở người [17]. Ngoài ra, Cobomarsen là một chất ức chế miR-155 được tổng hợp dưới dạng oligonucleotide đã được biến đổi. Trong thử nghiệm lâm sàng giai đoạn 1, cobomarsen đã được đánh giá trên các bệnh ung thư huyết học, kết quả cho thấy nó có tác dụng làm giảm sự phát triển của khối U lympho tế bào B lớn lan tỏa (diffuse large B-cell lymphoma) [18]. Trong điều trị vô sinh nam, hầu hết các nghiên cứu áp dụng trên mô hình động vật nhưng hướng đi này giúp mở ra các chiến lược điều trị khả quan trên người. Tuy nhiên, vẫn tồn tại một số thách thức trong lĩnh vực này, chẳng hạn như việc phân phối chính xác các tác nhân điều trị đến các tế bào đích cũng như tránh gây phản ứng miễn dịch.
3.3. miRNA trong tinh tương dự đoán sự tồn tại của tinh trùng/tinh nguyên bào trong tinh hoàn ở bệnh nhân NOA (Non-Obstructive Azoospermia)
miRNA trong tinh tương đang được nghiên cứu như một dấu ấn sinh học tiềm năng giúp dự đoán khả năng thu hồi tinh trùng thành công, cũng như sự tồn tại của tinh trùng hoặc tinh nguyên bào ở bệnh nhân vô tinh không do tắc nghẽn (NOA). Hướng đi này có thể tối ưu hóa quy trình chẩn đoán, giúp phân loại chính xác bệnh nhân và cải thiện hiệu quả điều trị.
Gần đây, Zhang và cộng sự đã phát triển một mô hình nhằm dự đoán khả năng thu hồi tinh trùng thành công ở bệnh nhân NOA với độ chính xác khá cao (AUC = 0.972) [19]. Trong một nghiên cứu khác, Willems và cộng sự cũng đã xác định 9 miRNAs có mức độ biểu hiện cao đáng kể và 6 miRNAs có biểu hiện giảm đáng kể hiện giữa bệnh nhân NOA có tinh trùng (TESE+) và không có tinh trùng (TESE-), cho thấy chúng có thể được sử dụng để dự đoán khả năng thu hồi tinh trùng từ tinh hoàn. Ngoài ra, 14 miRNAs có liên quan đến sự hiện diện của tinh nguyên bào cũng được phát hiện, cung cấp thêm thông tin về khả năng sinh tinh của bệnh nhân [20]. Những nghiên cứu về hướng đi này còn hạn chế, tuy nhiên nếu thành công những dấu ấn sinh học này có thể giúp ích rất nhiều trong việc đưa ra quyết định lâm sàng. Nếu xét nghiệm miRNA chỉ ra sự hiện diện của tinh trùng, thủ thuật TESE sẽ được thực hiện. Trong trường hợp kết quả âm tính, việc kiểm tra miRNA liên quan đến tinh nguyên bào có thể giúp xác định bệnh nhân có khả năng sinh tinh còn sót lại, từ đó hỗ trợ quyết định sinh thiết tinh hoàn. Với những tiến bộ trong công nghệ nuôi cấy tinh trùng trong ống nghiệm, hướng tiếp cận này có thể mở ra cơ hội điều trị mới cho bệnh nhân NOA trong tương lai [20].
- Kết luận:
Trong chẩn đoán vô sinh, đặc biệt ở những trường hợp vô sinh không rõ nguyên nhân (CRNN), miRNA trong tinh trùng có thể kết hợp với các xét nghiệm truyền thống để nâng cao độ chính xác, giúp xác định nguyên nhân một cách hiệu quả hơn.
Bên cạnh việc chẩn đoán, miRNA còn mở ra tiềm năng lớn trong điều trị vô sinh nam trong tương lai. Đặc biệt, miRNA trong huyết tương tinh dịch có thể đóng vai trò như một dấu ấn sinh học, giúp dự đoán sự hiện diện của tinh trùng, tinh nguyên bào cũng như tỷ lệ thu hồi tinh trùng thành công ở bệnh nhân vô tinh không do tắc nghẽn (NOA), góp phần tối ưu hóa chiến lược điều trị và nâng cao cơ hội làm cha cho bệnh nhân.
TÀI LIỆU THAM KHẢO
- Sharlip, I. D., Jarow, J. P., Belker, A. M., Lipshultz, L. I., Sigman, M., Thomas, A. J., ... & Sadovsky, R. (2002). Best practice policies for male infertility. Fertility and sterility, 77(5), 873-882.
- Peterson, S. M., Thompson, J. A., Ufkin, M. L., Sathyanarayana, P., Liaw, L., & Congdon, C. B. (2014). Common features of microRNA target prediction tools. Frontiers in genetics, 5, 23.
- Gurtan, A. M. & Sharp, P. A., The Role of miRNAs in Regulating Gene Expression Networks, J. Mol. Biol. (2013).
- Zhao, M. J., Zhang, Y. N., Zhao, Y. P., Chen, X. B., Han, B. S., Ding, N., Gu, Y. Q., Wang, S. S., Ma, J., & Liu, M. L. (2023). Altered microRNA expression profiles of human spermatozoa in normal fertile men of different ages. Asian journal of andrology, 25(6), 737–744.
- Chen, J., & Han, C. (2023). In vivo functions of miRNAs in mammalian spermatogenesis. Frontiers in cell and developmental biology, 11, 1154938.
- Tong, M. H., Mitchell, D., Evanoff, R., & Griswold, M. D. (2011). Expression of Mirlet7 family microRNAs in response to retinoic acid-induced spermatogonial differentiation in mice. Biology of reproduction, 85(1), 189–197.
- Chen, J., Gao, C., Lin, X., Ning, Y., He, W., Zheng, C., Zhang, D., Yan, L., Jiang, B., Zhao, Y., Alim Hossen, M., & Han, C. (2021). The microRNA miR-202 prevents precocious spermatogonial differentiation and meiotic initiation during mouse spermatogenesis. Development (Cambridge, England), 148(24), dev199799.
- Niu, Z., Goodyear, S. M., Rao, S., Wu, X., Tobias, J. W., Avarbock, M. R., & Brinster, R. L. (2011). MicroRNA-21 regulates the self-renewal of mouse spermatogonial stem cells. Proceedings of the National Academy of Sciences of the United States of America, 108(31), 12740–12745.
- Bouhallier, F., Allioli, N., Lavial, F., Chalmel, F., Perrard, M. H., Durand, P., Samarut, J., Pain, B., & Rouault, J. P. (2010). Role of miR-34c microRNA in the late steps of spermatogenesis. RNA (New York, N.Y.), 16(4), 720–731.
- Comazzetto, S., Di Giacomo, M., Rasmussen, K. D., Much, C., Azzi, C., Perlas, E., Morgan, M., & O’Carroll, D. (2014). Oligoasthenoteratozoospermia and infertility in mice deficient for miR-34b/c and miR-449 loci. PLoS genetics, 10(10), e1004597.
- Liu, W. M., Pang, R. T., Chiu, P. C., Wong, B. P., Lao, K., Lee, K. F., & Yeung, W. S. (2012). Sperm-borne microRNA-34c is required for the first cleavage division in mouse. Proceedings of the National Academy of Sciences of the United States of America, 109(2), 490–494.
- Yuan, S., Tang, C., Zhang, Y., Wu, J., Bao, J., Zheng, H., Xu, C., & Yan, W. (2015). mir-34b/c and mir-449a/b/c are required for spermatogenesis, but not for the first cleavage division in mice. Biology open, 4(2), 212–223.
- Salas-Huetos, A., Blanco, J., Vidal, F., Grossmann, M., Pons, M. C., Garrido, N., & Anton, E. (2016). Spermatozoa from normozoospermic fertile and infertile individuals convey a distinct miRNA cargo. Andrology, 4(6), 1028–1036.
- Yeh, L. Y., Lee, R. K., Lin, M. H., Huang, C. H., & Li, S. H. (2022). Correlation between Sperm Micro Ribonucleic Acid-34b and -34c Levels and Clinical Outcomes of Intracytoplasmic Sperm Injection in Men with Male Factor Infertility. International journal of molecular sciences, 23(20), 12381.
- Kiani, M., Salehi, M., & Mogheiseh, A. (2019). MicroRNA expression in infertile men: its alterations and effects. Zygote (Cambridge, England), 27(5), 263–271.
- Sinaei, R., Jamebozorgi, K., Mirshekarpour, H., Poormasoumi, H., Mahdizadeh, A., Akbari, Z., & Taghizadeh, E. (2023). The role of miRNAs in the diagnosis and treatment of male infertility: a review study. Egyptian Journal of Medical Human Genetics, 24(1), 40.
- Beg, M. S., Brenner, A. J., Sachdev, J., Borad, M., Kang, Y. K., Stoudemire, J., ... & Hong, D. S. (2017). Phase I study of MRX34, a liposomal miR-34a mimic, administered twice weekly in patients with advanced solid tumors. Investigational new drugs, 35, 180-188.
- Anastasiadou, E., Seto, A. G., Beatty, X., Hermreck, M., Gilles, M. E., Stroopinsky, D., Pinter-Brown, L. C., Pestano, L., Marchese, C., Avigan, D., Trivedi, P., Escolar, D. M., Jackson, A. L., & Slack, F. J. (2021). Cobomarsen, an Oligonucleotide Inhibitor of miR-155, Slows DLBCL Tumor Cell Growth In Vitro and In Vivo. Clinical cancer research : an official journal of the American Association for Cancer Research, 27(4), 1139–1149.
- Zhang, Y., Tang, Y., Huang, J., Liu, H., Liu, X., Zhou, Y., Ma, C., Wang, Q., Yang, J., Sun, F., & Zhang, X. (2022). Circulating microRNAs in seminal plasma as predictors of sperm retrieval in microdissection testicular sperm extraction. Annals of translational medicine, 10(7), 392.
- Willems, M., Devriendt, C., Olsen, C., Caljon, B., Janssen, T., Gies, I., ... & Goossens, E. (2023). Micro RNA in Semen/Urine from Non-Obstructive Azoospermia Patients as Biomarkers to Predict the Presence of Testicular Spermatozoa and Spermatogonia. Life, 13(3), 616.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...
FACEBOOK








