BS Nguyễn Khánh Linh
Mỗi bệnh nhân là một cơ địa hoàn toàn khác nhau. Do đó, khi điều trị vô sinh bằng thụ tinh trong ống nghiệm (TTTON), việc lựa chọn phác đồ kích thích buồng trứng (KTBT) phải dựa trên từng bệnh nhân cụ thể nhằm đạt được khả năng thành công cao nhất. Từ những ngày đầu TTTON còn chập chững, phác đồ dài down-regulation với việc sử dụng GnRH agonist để ức chế đỉnh LH sớm hầu như là vũ khí duy nhất của các nhà hỗ trợ sinh sản, được áp dụng cho gần 100% bệnh nhân làm TTTON. Mặc dù cũng có một số khuyết điểm, phác đồ này vẫn ngự trị rất lâu cho đến tận ngày hôm nay nhờ tính hiệu quả và tỉ lệ có thai khá ổn định của nó.
Sự ra đời của phác đồ GnRH antagonist đã giúp bác sĩ và bệnh nhân có thêm một lựa chọn để KTBT. Phác đồ ngắn này đã khắc phục những khuyết điểm của phác đồ dài GnRH agonist và tỏ ra khá “thân thiện” với bệnh nhân, do đó cả bệnh nhân và bác sĩ đều ưa chuộng phác đồ này hơn. Tuy nhiên, vẫn còn đó khá nhiều vấn đề tranh cãi xoay quanh việc áp dụng phác đồ này để đạt được tỉ lệ thành công tương đương như phác đồ dài kinh điển. Chính vì lẽ này, nhiều nhà lâm sàng còn rất e dè khi chỉ định phác đồ GnRH antagonist cho bệnh nhân.
Sử dụng đơn liều hay đa liều GnRH antagonist?
Sử dụng đơn liều GnRH antagonist có lợi điểm là tiết kiệm số lần tiêm thuốc. Nghiên cứu của Olivennes năm 2000 cho thấy chỉ có 10% bệnh nhân cần bổ sung thêm GnRH antagonist sau khi tiêm 1 liều duy nhất antagonist trước đó 3 ngày. Một số tác giả lo ngại về việc ức chế quá mức LH khi dùng đơn liều cao antagonist (3 mg) trong phác đồ đơn liều, do đó họ chuộng phác đồ đa liều hơn. Theo các tác giả này, sử dụng đa liều antagonist cho tất cả bệnh nhân giúp bác sĩ không phải lo ngại về hiệu quả ức chế đỉnh LH của thuốc, không cần theo dõi sát bằng siêu âm hoặc xét nghiệm máu, và có thể tạo một quy trình sử dụng thống nhất cho tất cả bệnh nhân. Hai phác đồ đơn liều và đa liều cho kết quả thai lâm sàng tương đương nhau (Wilcox và cộng sự, 2005).
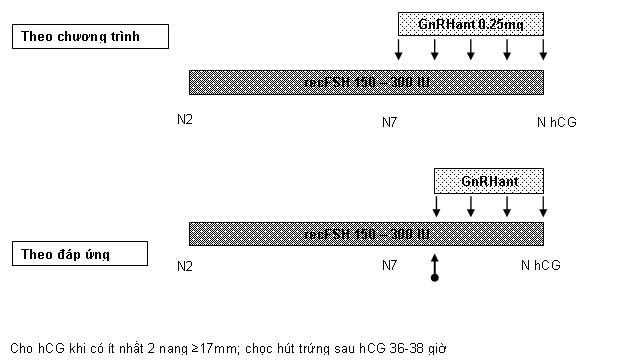
Thời điểm khởi đầu GnRH antagonist
Một số nghiên cứu RCTs cho thấy bắt đầu antagonist một cách thường quy vào ngày 6 của KTBT cho tỉ lệ có thai cao hơn (dù không có ý nghĩa thống kê) so với việc khởi đầu antagonist dựa trên kích thước nang noãn của bệnh nhân. Cách khởi đầu này giúp tiết kiệm thời gian theo dõi và thống nhất được phác đồ chung cho khoa điều trị. Ngoài ra, một số tác giả còn đề nghị khởi đầu dùng GnRH antagonist sớm hơn, vào ngày 5 của KTBT chẳng hạn (Kolibianakis và cộng sự, 2003, 2004).
Bổ sung LH
Đây là một trong những vấn đề gây khá nhiều tranh cãi. Nhóm tác giả ủng hộ việc bổ sung LH lập luận rằng GnRH antagonist gây ức chế đột ngột đỉnh LH nội sinh vào giữa pha nang noãn, là giai đoạn quan trọng cho sự phát triển nang noãn. Nồng độ LH thấp khi sử dụng liều antagonist cao có liên quan đến giảm tỉ lệ có thai (nhóm nghiên cứu liều Ganirelix, 1998), và tỉ lệ sẩy thai gia tăng khi nồng độ LH thấp trong chu kỳ GnRH agonist (Westergaard et al., 2000) là lý do nhóm ủng hộ cho rằng bổ sung LH có thể cải thiện kết quả thai kỳ.
Tuy nhiên, những dữ liệu từ các nghiên cứu thử nghiệm lâm sàng ngẫu nhiên có đối chứng cho rằng bố sung LH tái tổ hợp vào thời điểm dùng antagonist (Cedrine – Durnerin et al., 2004) hoặc từ ngày đầu kích thích buồng trứng (Griesinger et al., 2005) không làm tăng tỉ lệ có thai. Tương tự, tỉ lệ có thai cũng không cải thiện khi tăng liều hMG vào thời điểm cho antagonist (Aboulghar et al., 2004).
Ngoài ra, nghiên cứu của Merviel et al., 2004 và Kolibianakis et al., 2004 không tìm ra bằng chứng chứng minh nồng độ LH nội sinh thấp sau khi sử dụng antagonist có liên quan đến khả năng có thai giảm trong chu kỳ TTTON. Ngược lại, các nhà khoa học cho rằng nồng độ LH thấp hơn vào ngày 8 của kích thích buồng trứng thì khả năng có thai cao hơn (Kolibianakis et al., 2004).
Nhìn chung, các dữ liệu hiện tại chưa cung cấp bằng chứng rõ ràng về hiệu quả của bổ sung LH trong KTBT/TTTON với phác đồ antagonist lên kết quả thai kỳ.
Tiêu chuẩn cho hCG
Đa số các tác giả đều ủng hộ quan điểm cho hCG khi có ít nhất 3 nang noãn có kích thước từ 17 mm trở lên mà không cần quan tâm đến đoàn hệ nang noãn còn lại. Nghiên cứu của Kolibianakis và cộng sự (2004) cho thấy nếu kéo dài pha nang noãn thêm 2 ngày sau khi đạt được tiêu chuẩn trên sẽ làm giảm tỉ lệ thai diễn tiến. Theo ông, nguyên nhân không nằm ở chất lượng trứng, mà do nồng độ estrogen tăng cao hơn cộng với progesterone tăng cao vào một ngày sau tiêm hCG ở nhóm cho hCG trễ so với nhóm cho hCG sớm đã khiến cho nội mạc tử cung biến đổi sớm sang giai đoạn chế tiết, hậu quả là làm cho cửa số làm tổ của phôi bị đóng lại sớm hơn trước ngày phôi có khả năng làm tổ (Kolibianakis et al., 2005).
Tuy nhiên, cần có thêm nghiên cứu để xác định thời điểm lý tưởng cho hCG trong phác đồ antagonist. Tiêu chuẩn đề ra trong các nghiên cứu này cần được tuân thủ một cách nghiêm ngặt nhằm đảm bảo mọi bệnh nhân đều được cho hCG với một tiêu chuẩn như nhau, như vậy mới có thể tìm ra một cách chính xác thời điểm lý tưởng cho hCG.
Agonist trigger trong trường hợp nguy cơ cao quá kích buồng trứng (OHSS)
Hầu hết các nghiên cứu đều cho thấy nguy cơ OHSS có thể được loại trừ hoàn toàn trong phác đồ GnRH antagonist bằng cách sử dụng GnRH agonist để tạo đỉnh LH nội sinh thay cho việc sử dụng hCG. Tuy nhiên, trigger bằng agonist đưa đến tỉ lệ có thai giảm rất thấp cũng như tỉ lệ sẩy thai cao (Humaidan và cộng sự, 2005).
Một số phác đồ hỗ trợ đã được nghiên cứu và đem lại hiệu quả cao: phục hồi hoàng thể bằng hCG (Humaidan và cs, 2009, nghiên cứu quan sát, không đối chứng) đã cho kết quả có thai tương đương. Tuy nhiên, vẫn cần nghiên cứu thêm để khẳng định và tìm ra phác đồ thích hợp.
Nguyên nhân là do hoàng thể bị tiêu hủy hoàn toàn và cho đến thời điểm hiện tại, chưa có một phác đồ hỗ trợ hoàng thể nào tỏ ra phù hợp sau khi trigger bằng agonist. Mặc dù vậy, có thể áp dụng thường quy phác đồ ngắn GnRH antagonist cho những trường hợp xin – cho trứng đối với những trường hợp nguy cơ quá kích buồng trứng cao mà không lo ngại làm giảm tỉ lệ có thai. Trong những trường hợp buồng trứng đa nang ở chu kỳ không xin trứng, cũng có thể áp dụng phác đồ này, nếu có nguy cơ cao bị quá kích, bệnh nhân nên được trigger bằng agonist, sau đó trữ phôi toàn bộ hoặc chuyển phôi và hỗ trợ giai đoạn hoàng thể với estrogen và progesterone liều cao dạng đặt âm đạo kết hợp tiêm bắp (Tuân P.H, 2009).
Antagonist trong IUI
Sử dụng GnRH antagonist làm tăng chi phí điều trị. Do vậy, trong những chu kỳ IUI, chỉ nên dùng antagonist cho những bệnh nhân có tiền căn rụng trứng sớm hoặc để sắp xếp ngày bơm tinh trùng. Tỉ lệ có thai khi kết hợp GnRH antagonist cần được nghiên cứu thêm.
Sử dụng thuốc ngừa thai để lập chương trình TTTON với GnRH antagonist
Thuốc viên ngừa thai có công dụng tốt trong việc sắp xếp lịch TTTON cho bệnh nhân mà không làm giảm khả năng có thai (Kolibianakis et al., 2006). Bên cạnh đó, trong những chu kỳ có dùng thuốc ngừa thai, các nang noãn phát triển đồng bộ hơn (Tarlatzis et al., 2006). Tuy nhiên, sử dụng thuốc ngừa thai trước KTBT làm kéo dài thời gian KTBT hơn (Van Loenen et al., 2001) và cần tổng liều FSH cao hơn (Bendikson et al., 2003).
Nên áp dụng phác đồ antagonist cho những bệnh nhân nào?
Tại hội nghị về sử dụng antagonist tại Barcelona 2010, các chuyên gia đã đề nghị sử dụng antagonist cho các đối tượng:
Chu kỳ xin – cho trứng: hầu hết tác giả đều nhất trí phác đồ này thuận tiện hơn so với phác đồ dài, vì nguy cơ hủy chu kỳ điều trị do người cho trứng tự ý ngưng chu kỳ sẽ thấp hơn so với phác đồ dài. Đặc biệt, những trường hợp có nguy cơ quá kích buồng trứng cao sẽ được phòng ngừa bằng cách trigger bằng GnRH agonist mà không sợ làm ảnh hưởng đến chất lượng trứng và tỉ lệ có thai.
Bệnh nhân PCOS: một số tác giả cho rằng GnRH antagonist giúp giảm tỉ lệ LH/FSH, nhờ vậy các nang noãn đáp ứng tốt hơn với KTBT, số trứng thu được cao hơn. Ngoài ra, những phụ nữ PCOS là những người có nguy cơ cao quá kích buồng trứng. Phác đồ này kết hợp với agonist trigger sẽ giúp loại trừ hoàn toàn nguy cơ này.
Bệnh nhân đáp ứng kém: với luận cứ cho rằng GnRH antagonist không ức chế quá mức sự bài tiết các gonadotropin tuyến yên, một số tác giả đề nghị nên dùng phác đồ này cho bệnh nhân đáp ứng kém. Tuy nhiên, hai nghiên cứu đối chứng của Akman, 2001 và Nikolettos, 2001 cho thấy phác đồ này không làm cải thiện tỉ lệ có thai so với phác đồ dài.
Kết luận
Nói tóm lại, vẫn còn cần rất nhiều nghiên cứu nhằm cải thiện hiệu quả của phác đồ GnRH antagonist trong KTBT làm TTTON, đồng thời xác định những tiêu chuẩn chặt chẽ về việc cho liều đầu FSH, bổ sung LH và thời điểm lý tưởng cho hCG. Ngoài ra, cần tìm ra một phác đồ hỗ trợ giai đoạn hoàng thể thích hợp trong những trường hợp trigger bằng agonist để phòng ngừa nguy cơ quá kích buồng trứng. Việc áp dụng GnRH antagonist trong các chu kỳ IUI cũng là một phác đồ hứa hẹn cho những bệnh nhân có tiền căn rụng trứng sớm.
Tài liệu tham khảo chính
1. B.C.Tarlatzis, B.C.Fauser, E.M.Kolibianakis, K.Diedrich and P.Devroey, 2006. GnRH antagonists in ovarian stimulation for IVF. Human Reproduction Update, Vol.12, No.4 pp. 333-340.
2. E.M. Kolibianakis, L. Kalogeropoulou, G. Griesinger, E.G. Papanikolaou, J. Papadimas, J. Bontis and B.C Tarlatzis, 2007. Among patients treated with FSH and GnRH analogues for in vitro fertilization, is the addition of recombinant LH associated with the probability of live birth? A systematic review and meta-analysis. Human Reproduction Update, Vol.13, No.5 pp. 445-452.
3. J.A. Huirne, R. Homburg and C.B. Lambalk, 2007. Are GnRH antagonist comparable to agonists for use in IVF? Human Reproduction Vol.22, No.11 pp. 2805-2813
4. Andrea J. DiLuigi, Lawrence Engmann, David W. Schmidt, Donald B. Maier, John C. Nulsen, Claudio A. Benadiva. Gonadotropin-releasing hormone agonist to induce final oocyte maturation prevents the development of ovarian hyperstimulation syndrome in high-risk patients and leads to improved clinical outcomes compared with coasting. Fertil Steril 2010.
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
Cẩm nang Hội chứng buồng trứng đa nang được phát hành online ...








