Tin chuyên ngành
on Friday 26-06-2020 1:01pm
Danh mục: Vô sinh & hỗ trợ sinh sản
Ths Lê Thị Thu Thảo - Chuyên viên phôi học - IVFMD Tân Bình
Hiện nay, vô sinh đang là vấn đề của toàn cầu. Ở nam giới, tỷ lệ vô sinh chiếm khoảng 40% và thường liên quan đến rối loạn chức năng sinh tinh. Đối với các bệnh nhân tinh trùng ít, không có tinh trùng,… một số biện pháp điều trị như phẫu thuật nhiều lần để thu nhận tinh trùng có thể ảnh hưởng đến sức khoẻ, tâm lý bệnh nhân; hoặc một số bệnh nhân điều trị ung thư lo ngại về các tác dụng phụ liên quan đến việc điều trị, ảnh hưởng đến chức năng sinh sản. Vì vậy, bảo tồn khả năng sinh sản khi điều trị là vô cùng quan trọng, trong đó trữ lạnh tinh trùng là biện pháp cứu cánh cho nhiều trường hợp bệnh nhân có vấn đề về sinh sản. Tuy nhiên, hiện nay kỹ thuật bảo quản tinh trùng thông thường hữu hiệu cho những trường hợp tinh trùng có chất lượng tốt, còn đối với tinh trùng số lượng ít việc bảo quản thông thường có thể làm ảnh hưởng đến mẫu như tỷ lệ thu hồi thấp, giảm độ di động,… Vì vậy, trữ đông tinh trùng số lượng ít bằng phương pháp thuỷ tinh hoá đang là xu hướng trong tương lai.
Điểm quan trọng trong việc trữ đông tinh trùng số lượng ít bằng phương pháp thuỷ tinh hóa là lựa chọn các dụng cụ chứa phù hợp để tạo thuận lợi cho quá trình lưu trữ cũng như sử dụng. Có 2 dạng vật chứa được sử dụng là vật chứa sinh học như màng trong suốt, volvox globator spheres… và vật chứa phi sinh học như cryoloops, cryotop, Sperm VD, cell-sleeper… Mỗi vật chứa đều có ưu, nhược điểm khác nhau và đang được nghiên cứu rộng rãi trên nhiều đối tượng khác nhau.
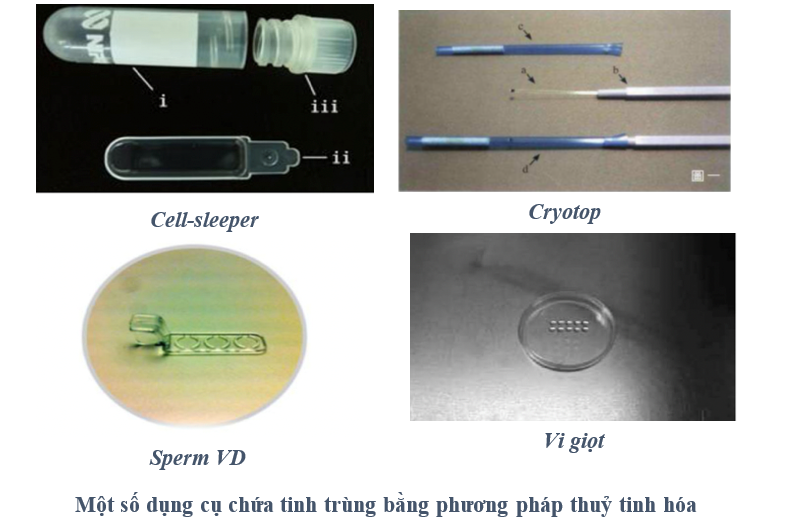
-
Một số dụng cụ chứa trong trữ lạnh tinh trùng số lượng ít
-
Trữ tinh trùng với màng ZP
ZP có kích thước lớn nên là vật chứa được nhiều tinh trùng và dễ quan sát dưới kính hiển vi. Tuy nhiên, giới hạn của ZP là vật liệu sinh học. Khi loại bỏ tế bào chất từ noãn, các mảnh vỡ DNA có thể chưa được loại bỏ hoàn toàn, lưu lại và được chuyển vào noãn cho lần ICSI sau đó. Một số nguyên cứu cho rằng việc trữ lạnh tinh trùng bằng ZP cho tỉ lệ phục hồi chất lượng tinh trùng sau rã đông và tỉ lệ thụ tinh thấp do tinh trùng gắn vào ZP3 trên ZP cũng có thể gây ra phản ứng acrosome ảnh hưởng đến chất lượng tinh trùng [3]. Ngoài ra, việc sử dụng ZP trên người còn liên quan đến vấn đề đạo đức ở một số quốc gia; vì vậy, trong tương lai các nhà khoa học đang dần tìm kiếm vật liệu phi sinh học thay thế tương tự như ZP.
-
Cryoloops
-
Cell- sleeper
-
Cryotop
-
Vi giọt
-
Closed slice
-
The novel sperm vitrification device (SpermVD)
- Một số vấn đề liên quan đến trữ lạnh tinh trùng số lượng ít
Trữ lạnh tinh trùng số lượng ít bằng phương pháp thuỷ tinh hoá là một hướng nghiên cứu mới. Vì vậy có nhiều vấn đề còn đang bàn luận cho phương pháp này. Một câu hỏi đặt ra là trữ đông tinh trùng số lượng ít trên hơi hay thả trực tiếp trong nitơ lỏng sẽ tốt hơn? Nhóm tác giả Akram Hosseini và cộng sự (2019) đã so sánh hiệu quả của phương pháp thủy tinh hóa với hai quy trình: trữ đông tinh trùng trong nitơ lỏng LN2 (direct submerging - DS) và hơi nitơ LN2 (vapour - V). Tiến hành lọc rửa tinh trùng bằng kỹ thuật swim-up trước khi tiến hành đông lạnh và mẫu được chia thành hai nhóm: nhóm đối chứng và nhóm trữ đông. Nhóm trữ đông được chia thành hai nhóm khác: trữ đông bằng cách thả trực tiếp vào nitơ lỏng LN2 (nhóm DS) và trữ đông bằng hơi nitơ (nhóm V). Ở nhóm V, cryotop được đặt trên bề mặt của LN2 với khoảng cách 4cm trong 15 phút. Các mẫu tinh trùng sau đó được rã đông và đánh giá các chỉ số về độ di động, tỉ lệ sống, acrosome, nhiễm sắc thể và tính toàn vẹn DNA tinh trùng. Kết quả cho thấy khả năng di động và tỉ lệ sống của tinh trùng giảm đáng kể sau khi thủy tinh hóa so với nhóm đối chứng (p<0.05). Ở nhóm trữ đông, độ di động của tinh trùng ở nhóm DS cao hơn so với nhóm V (p<0,05), tỉ lệ sống sau rã đông ở cả hai nhóm DS và V không có sự khác biệt có ý nghĩa thống kê. Tính toàn vẹn của acrosome và DNA tinh trùng giảm đáng kể sau khi thủy tinh hóa ở nhóm trữ đông so với nhóm đối chứng. Tỉ lệ tổn thương nhiễm sắc thể ở nhóm V cao hơn đáng kể so với nhóm DS, tương ứng 46,84% ở nhóm V và 38,84% ở nhóm DS (p<0,05). Như vậy, nghiên cứu cho thấy sử dụng phương pháp thủy tinh hóa trong đông lạnh tinh trùng số lượng ít có những thay đổi về chỉ số tinh trùng có thể chấp nhận được. Hạn chế của nghiên cứu là cỡ mẫu thấp, do đó cần có thêm nhiều nghiên cứu với cỡ mẫu lớn hơn trong tương lai nhằm tìm ra phương pháp đông lạnh tinh trùng hiệu quả đối với nhóm bệnh nhân có số lượng tinh trùng ít [11].
Một câu hỏi khác được đặt ra là nên sử dụng CPA trong trữ lạnh tinh trùng hay không? Việc sử dụng thủy tinh hóa tinh trùng không có CPA có phù hợp với IVF không? Phương pháp thủy tinh hóa là một quá trình chuyển hóa nước thành dạng thủy tinh, hạn chế hình thành tinh thể đá trong quá trình đông lạnh. Để đạt được điều kiện như vậy phải sử dụng chất bảo quản đông lạnh với nồng độ cao và tốc độ làm lạnh cực nhanh. Tuy nhiên, việc sử dụng CPA nồng độ cao sẽ ảnh hưởng đến chất lượng tinh trùng sau rã đông và điều này vô cùng bất lợi cho những trường hợp có mật độ tinh trùng thấp. Nghiên cứu của Widyastuti và cộng sự (2017) đánh giá ảnh hưởng của CPA trong đông lạnh tinh trùng bằng thuỷ tinh hoá. Mỗi mẫu tinh dịch được chia làm 3 nhóm: nhóm chứng P1, nhóm P2 chỉ pha loãng với môi trường không có chất bảo quản lạnh, nhóm P3 pha với môi trường có chất bảo quản lạnh. Kết quả nghiên cứu cho thấy chất lượng của tinh trùng sau rã bằng phương pháp thủy tinh hóa ở cả 2 nhóm P2 và P3 đều thấp hơn so với nhóm chứng. Chất lượng của tinh trùng với chất bảo vệ ở nhóm P3 (di động 56%, sống 58,15%) thì cao hơn đáng kể so với P2 (di động 35%, sống 48%). Trong nghiên cứu này, nhóm P3 sử dụng thêm 0,25M sucrose và 1% HAS hoạt động như CPA không thẩm thấu có khả năng bảo vệ màng tế bào khi đông lạnh, dẫn đến tỉ lệ sống cao hơn so với nhóm không sử dụng CPA (P2). Như vậy, kết quả nghiên cứu trên cho thấy đông lạnh tinh trùng bằng phương pháp thủy tinh hóa không sử dụng CPA có thể được ứng dụng và nên khuyến khích sử dụng trong các kỹ thuật hỗ trợ sinh sản [12].
Tài liệu tham khảo chính
[1] P. E. Levi-Setti, E. Albani, L. Negri, A. Cesana, P. Novara, and S. Bianchi, “Cryopreservation of a small number of spermatozoa in yolk-filled human zonae pellucidae,” Arch. Ital. di Urol. e Androl., 2003.
[2] Y. Y. Hsieh, H. Der Tsai, C. C. Chang, and H. Y. Lo, “Cryopreservation of human spermatozoa within human or mouse empty zona pellucidae,” Fertil. Steril., 2000.
[3] J. Cohen, G. J. Garrisi, T. A. Congedo-Ferrara, K. A. Kieck, T. W. Sehimmel, and R. T. Scott, “Cryopreservation of single human spermatozoa,” Hum. Reprod., 1997.
[4] T. G. Schuster, L. M. Keller, R. L. Dunn, D. A. Ohl, and G. D. Smith, “Ultra-rapid freezing of very low numbers of sperm using cryoloops,” Hum. Reprod., 2003.
[5] Y. Endo, Y. Fujii, K. Shintani, M. Seo, H. Motoyama, and H. Funahashi, “Simple vitrification for small numbers of human spermatozoa,” Reprod. Biomed. Online, 2012.
[6] K. Coetzee, K. Ozgur, M. Berkkanoglu, H. Bulut, and A. Isikli, “Reliable single sperm cryopreservation in Cell Sleepers for azoospermia management,” Andrologia, 2016.
[7] J. B. Ma C, Hu MG, “Application of closed slice method in cryopreservation of testicular spermatozoa,” Contemp Chin Med, vol. 24, pp. 19–21, 2017.
[8] A. Berkovitz, N. Miller, M. Silberman, M. Belenky, and P. Itsykson, “A novel solution for freezing small numbers of spermatozoa using a sperm vitrification device,” Hum. Reprod., 2018.
[9] Y. Endo, Y. Fujii, K. Shintani, M. Seo, H. Motoyama, and H. Funahashi, “Single Spermatozoon Freezing Using Cryotop,” J. Mamm. Ova Res., 2011.
[10] E. Sereni et al., “Freezing spermatozoa obtained by testicular fine needle aspiration: A new technique,” Reprod. Biomed. Online, 2008.
[11] A. Hosseini et al., “Cryopreservation of Low Number of Human Spermatozoa; Which is Better: Vapor Phase or Direct Submerging in Liquid Nitrogen?,” Hum. Fertil., vol. 22, no. 2, pp. 126–132, 2019.
[12] R. Widyastuti, R. Lesmana, A. Boediono, and S. H. Sumarsono, “Effect of cryoprotectants on sperm vitrification,” Adv. Biomol. Med. - Proc. 4th BIBMC (Bandung Int. Biomol. Med. Conf. 2016 2nd ACMM (ASEAN Congr. Med. Biotechnol. Mol. Biosci. 2016, no. March, pp. 119–122, 2017.
Từ khóa: Trữ lạnh tinh trùng số lượng ít
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








