CNSH. Quảng Thị Phước Tín - IVFMD SIH - Bệnh viện Phụ sản Quốc tế Sài Gòn
Giới thiệu
Trong lịch sử hơn 40 năm của thụ tinh trong ống nghiệm (IVF), "tiêu chuẩn vàng" để đánh giá và lựa chọn phôi chuyển chủ yếu dựa vào hình thái học (morphology) tại các thời điểm quan sát cố định. Mặc dù phương pháp này đã giúp hàng triệu trẻ em ra đời, nhưng nó mang tính chất "tĩnh", giả thuyết rằng một phôi có hình thái đẹp tại thời điểm quan sát là kết quả của một quá trình phân chia bình thường. Tuy nhiên, nhận định này hiện nay không còn đúng đắn. Giữa các lần quan sát ngắt quãng, phôi có thể trải qua những biến động như: phân chia sau đó hợp nhất, phân chia quá nhanh, hoặc xuất hiện đa nhân rồi biến mất. Những sự kiện này vốn là dấu hiệu chỉ điểm bất thường nhiễm sắc thể đã bị bỏ sót trong quan sát tĩnh.
Sự ra đời của các hệ thống nuôi cấy tích hợp camera time-lapse cho phép ghi lại hình ảnh phôi mỗi 5-10 phút mà không làm gián đoạn môi trường nuôi cấy [2]. Dữ liệu liên tục này đã định nghĩa lại khái niệm về sự phát triển phôi "bình thường". Các nhà khoa học bắt đầu quan sát thấy một tỷ lệ đáng kể phôi người trải qua các kiểu phân chia không bình thường, bao gồm:
- Phân chia trực tiếp (Direct Cleavage - DC): Một tế bào mẹ phân chia thành 3 hoặc nhiều tế bào con trong một chu kỳ tế bào duy nhất [3],[4].
- Phân chia ngược (Reverse Cleavage - RC): Các tế bào con sau khi phân chia lại hợp nhất với nhau [4].
- Phân chia nhanh (Rapid/Fast Cleavage): Các chu kỳ phân chia diễn ra với tốc độ bất thường, gợi ý sự mất kiểm soát của các điểm kiểm soát chu kỳ tế bào (cell cycle checkpoints) [1].
Trước đây, sự hiện diện của bất kỳ dấu hiệu nào kể trên thường dẫn đến việc phôi bị đánh giá thấp hoặc loại bỏ, dựa trên giả thuyết khả năng cao chúng mang bất thường di truyền (aneuploidy) và không có khả năng làm tổ. Tuy nhiên, các nghiên cứu gần đây đã bác bỏ quan điểm này, do đó cần phải xem xét lại tác động thực sự của từng loại phân chia bất thường đối với kết cục IVF, thể hiện thông qua tỷ lệ sinh sống (Live Birth Rate - LBR).
Các báo cáo mới cho thấy phôi người thể hiện một sự linh hoạt (plasticity) đáng kinh ngạc. Mặc dù các kiểu phân chia bất thường như phân chia trực tiếp tức thời (IDC – Instant direct cleavage) hay phân chia không đều (IRC – irregular cleavage) có liên quan mật thiết đến sự bất ổn di truyền và tỷ lệ tạo phôi nang thấp, nhưng những phôi vượt qua được các rào cản chọn lọc tự nhiên này để đạt đến giai đoạn phôi nang thường sở hữu tiềm năng làm tổ và kết cục sơ sinh tương đương với phôi phân chia bình thường. Điều này gợi ý sự tồn tại của các cơ chế "tự sửa chữa" mạnh mẽ, bao gồm việc loại bỏ dòng tế bào bất thường và sự khắc phục của các phôi bào khỏe mạnh. Bài viết này nhằm tổng hợp các bằng chứng mới nhất để làm rõ tác động của các kiểu phân chia phôi khác nhau đối với khả năng phát triển thành công đến phôi nang và kết cục IVF, nhằm cung cấp các khuyến nghị lâm sàng cụ thể để tối đa hóa cơ hội có con cho bệnh nhân vô sinh hiếm muộn [1].
Cơ sở sinh học của sự phân chia và định hướng thoi vô sắc
Lần nguyên phân đầu tiên của hợp tử là sự kiện quan trọng nhất trong quá trình phát triển phôi, nơi bộ gen của cha và mẹ lần đầu tiên kết hợp và phân chia. Bất kỳ sai sót nào ở giai đoạn này sẽ được khuếch đại vào tất cả hoặc một phần lớn các dòng tế bào con [2].
Trong hợp tử người, sau khi thụ tinh, hai tiền nhân (pronuclei - PN) di chuyển lại gần nhau và nằm kề nhau (juxtaposed) ở trung tâm tế bào chất. Trục dọc nối tâm của hai tiền nhân này tạo thành một hệ quy chiếu không gian quan trọng cho lần phân chia đầu tiên.
Nghiên cứu của Porokh và cộng sự (2024) đã sử dụng hình ảnh 3D time-lapse độ phân giải cao để theo dõi sự hình thành và định hướng của thoi vô sắc (spindle apparatus) – bộ máy chịu trách nhiệm kéo nhiễm sắc thể về hai cực tế bào và phát hiện ra một quy luật [2]:
- Cấu hình vuông góc (Perpendicular Configuration): Ở các phôi phát triển bình thường, thoi vô sắc luôn hình thành và định hướng vuông góc với trục tiếp xúc của hai tiền nhân. Điều này đảm bảo rằng mặt phẳng phân chia (cleavage plane) sẽ đi qua giữa hai bộ nhiễm sắc thể đã được sao chép, phân chia tế bào chất đồng đều và quan trọng hơn là phân ly nhiễm sắc thể chính xác.
- Cấu hình bất thường (Parallel/Oblique Configuration): Khi thoi vô sắc định hướng song song hoặc lệch so với trục tiền nhân, phân chia bất thường xảy ra. Sự sai lệch không gian này dẫn đến việc nhiễm sắc thể không được sắp xếp đúng trên mặt phẳng xích đạo, gây ra hiện tượng phân ly không đều (nondisjunction) hoặc trễ nhiễm sắc thể (lagging chromosomes)

Hình 1: Sự định hướng phân chia phôi được xác định bởi vị trí tiền nhân nằm gần kề [2].
Chú thích: a: Sự định hướng của tiền nhân (PN) đối với thể cực (polar body - PB). c: Các mặt phẳng phân chia tế bào từ giai đoạn hợp tử sang 2 tế bào, so với trục PN (đường nối hai tiền nhân). Song song (parallel): Mặt phẳng phân chia song song với trục PN, Xiên (oblique): Mặt phẳng phân chia xiên so với trục PN, và vuông góc (perpendicular): Mặt phẳng phân chia vuông góc với trục PN.
Nguyên nhân của sự sai lệch định hướng này là do khả năng duy trì định hướng vuông góc phụ thuộc vào sự tương tác phức tạp giữa các vi ống (microtubules) của thoi vô sắc và vỏ tế bào (cell cortex). Nghiên cứu xác định mối liên hệ mật thiết giữa tuổi mẹ và sự mất kiểm soát định hướng thoi vô sắc. Ở phụ nữ lớn tuổi, tế bào chất noãn suy giảm chất lượng, đặc biệt là suy yếu khung xương tế bào (cytoskeleton) và các yếu tố phân tử (molecular motors) chịu trách nhiệm xoay trục thoi vô sắc. Khi cơ chế kiểm soát không gian này thất bại, hợp tử có xu hướng phân chia theo các góc lệch, dẫn đến hai hậu quả chính quan sát được trên lâm sàng:
- Phân chia không đều (Uneven Cleavage): Tế bào chất bị chia cắt không đối xứng, tạo ra các phôi bào kích thước chênh lệch.
- Đa nhân (Multinucleation): Do sự phân ly nhiễm sắc thể bị rối loạn, các mảnh nhiễm sắc thể bị bỏ lại hoặc không được bao bọc trọn vẹn trong màng nhân mới, tạo thành các vi nhân (micronuclei) hoặc nhiều nhân trong một tế bào.

Hình 2: Mô hình đề xuất kiểm soát không gian quá trình nguyên phân đầu tiên ở phôi người [2].
Chú thích: Hàng trên mô tả sự di chuyển đến gần của các tiền nhân (PN apposition) với sự sắp xếp liền kề của các hạch nhân (Nucleolar clustering) và nhiễm sắc chất (chromatin clustering) một cách hoàn chỉnh (complete); các trung thể tổ chức lắp ráp thoi vô sắc nguyên phân vuông góc với các tiền nhân, do đó thúc đẩy sự phân tách NST chính xác, tạo ra 2 tế bào con đơn nhân (mononucleation). Hàng dưới mô tả sự rối loạn điều chỉnh kiểm soát không gian trong quá trình nguyên phân đầu tiên ở phôi từ noãn người mẹ lớn tuổi: các PN đến gần nhau nhưng sự sắp xếp các hạch nhân không hoàn chỉnh (incomplete) cho thấy định hướng không gian suy giảm nên thoi vô sắc được lắp ráp với góc lệch <90o, dẫn đến phân tách NST không đồng đều, tạo ra tế bào con có nhiều nhân (multinucleation) hoặc số lượng NST bất thường.
Nghiên cứu cũng khẳng định hình thái phân chia bên ngoài (phenotype) phản ánh trực tiếp trạng thái nhiễm sắc thể bên trong (genotype). Sự lệch hướng của thoi vô sắc ngay từ lần phân chia đầu tiên là nguyên nhân gốc rễ gây ra sự bất ổn định di truyền, dẫn đến thể khảm (mosaicism) hoặc lệch bội toàn phần ở giai đoạn phôi sớm. Điều này giải thích tại sao các phôi có kiểu phân chia bất thường ngay từ giai đoạn hợp tử thường có tiên lượng làm tổ kém và tỷ lệ sảy thai cao [2].
Phân chia trực tiếp từ hợp tử đến 3 tế bào: Phân loại IDC và FC
Trong nhiều năm, thuật ngữ "phân chia trực tiếp" (Direct Cleavage) được sử dụng một cách không chặt chẽ để mô tả bất kỳ sự kiện nào mà phôi tăng số lượng tế bào một cách đột ngột. Tuy nhiên, sự thiếu chính xác trong thuật ngữ này đã gây khó khăn cho việc tiên lượng lâm sàng. Nghiên cứu của Nemerovsky và cộng sự (2024) đã phân loại chi tiết hiện tượng này thành hai dạng riêng biệt: phân chia trực tiếp tức thời (IDC - Instant Direct Cleavage) và phân chia nhanh (FC - Fast Cleavage) [1].
- Phân chia IDC: hợp tử phân chia trực tiếp thành 3 tế bào con, hoàn toàn không có giai đoạn 2 tế bào, hoặc giai đoạn này tồn tại trong thời gian cực ngắn đến mức không thể phân biệt được ranh giới rõ ràng giữa các lần phân chia. Về mặt cơ chế, đây thường là kết quả của thoi vô sắc ba cực (tripolar spindle), kéo nhiễm sắc thể về 3 hướng cùng một lúc.
- Phân chia FC: quá trình hợp tử phân chia thành 2 tế bào, sau đó một trong hai tế bào này phân chia tiếp thành tế bào thứ 3 trong khoảng thời gian rất ngắn (chu kỳ tế bào thứ hai (cc2) kéo dài dưới 5 giờ (cc2 < 5h)). Khác với IDC, phôi FC vẫn trải qua giai đoạn 2 tế bào rõ ràng về mặt hình thái học.
Đối với IDC: Trong số 922 phôi IDC được theo dõi, chỉ có 4 phôi đạt đến giai đoạn phôi nang. Tỷ lệ này quá thấp nên tác giả kết luận rằng tiềm năng của phôi IDC là không đáng kể. Sự phân chia đồng thời thành 3 tế bào gây ra sự hỗn loạn nhiễm sắc thể nghiêm trọng (chaotic mosaicism) mà cơ chế sửa chữa của phôi không thể khắc phục được.
Đối với FC: Mặc dù tỷ lệ tạo phôi nang thấp hơn nhiều so với nhóm chứng (6,81% so với 32,67%), nhưng những phôi FC vượt qua được giai đoạn này thì tiềm năng làm tổ rất tốt (42,55%), tương đương với phôi bình thường. Điều này gợi ý rằng "phôi phân chia nhanh" không có nghĩa là phôi “không có tiềm năng". Một số phôi FC có thể chỉ đơn giản là có tốc độ chuyển hóa nhanh hoặc chu kỳ tế bào ngắn hơn nhưng vẫn đảm bảo sự phân ly nhiễm sắc thể chính xác. Từ đó, tác giả đã khuyến cáo về chiến lược chuyển phôi như sau: Đối với phôi IDC, không nên thực hiện chuyển phôi vào ngày 3 ngay cả khi hình thái được đánh giá là loại 1 hoặc 2 do bản chất di truyền gần như chắc chắn là bất thường. Nếu chuyển những phôi này chỉ làm tăng tỷ lệ thất bại và kéo dài thời gian mong con của bệnh nhân. Đối với phôi FC, nếu bệnh nhân có nhiều phôi thì nên nuôi cấy đến ngày 5 để chọn lọc. Tuy nhiên, nếu bệnh nhân lớn tuổi hoặc ít phôi, việc chuyển phôi FC vào ngày 3 là một lựa chọn "khả dĩ" chấp nhận được, vì vẫn có tỷ lệ thấp thành công [1].
Phân chia bất thường IRC
Nghiên cứu của Shavit và cộng sự (2023) đã cung cấp toàn diện về phân chia bất thường (Irregular Cleavage - IRC) thông qua phân tích 9600 phôi. Phân chia IRC được định nghĩa là sự phân chia tế bào bất thường dưới dạng phân chia trực tiếp của tế bào mẹ thành nhiều hơn hai tế bào con. IRC xuất hiện khá phổ biến, chiếm khoảng 17,5% (1689/9632 phôi) [3]. Nghiên cứu phân chia IRC thành hai nhóm dựa trên thời điểm khởi phát:
- IRC sớm (Early IRC): Xảy ra trong chu kỳ tế bào đầu tiên (từ 1 đến 2 tế bào). Nhóm này chiếm 35% tổng số ca IRC. Đây là dạng bất lợi nhất vì nó ảnh hưởng đến dòng tế bào gốc ban đầu.
- IRC muộn (Late IRC): Xảy ra sau chu kỳ tế bào đầu tiên (từ 2 tế bào trở đi). Nhóm này chiếm đa số (65%). Mặc dù vẫn là bất thường, nhưng do chỉ ảnh hưởng đến một dòng tế bào con (sub-lineage), phôi có cơ hội sửa chữa hoặc khắc phục cao hơn.
Dữ liệu trong nghiên cứu cho thấy tỷ lệ phôi IRC cao hơn đáng kể trong các chu kỳ điều trị có nguyên nhân từ yếu tố nam. Tỷ lệ IRC ở nhóm vô sinh nam chiếm 35,7% , trong khi tỷ lệ IRC ở nhóm không có yếu tố nam chiếm 31,2% (p = 0,01). Do đó có thể thấy sự tồn tại mối liên hệ có ý nghĩa thống kê giữa vô sinh nam và các kiểu phân chia bất thường. Nguyên nhân tinh trùng gây ảnh hưởng đến sự phân chia phôi nằm ở yếu tố trung thể (centrosome). Trong quá trình thụ tinh ở người, noãn cung cấp hầu hết tế bào chất và ty thể, nhưng tinh trùng đóng góp trung thể - bào quan chịu trách nhiệm tổ chức hệ thống vi ống và hình thành thoi vô sắc cho lần nguyên phân đầu tiên. Tinh trùng từ nam giới vô sinh nặng (mật độ thấp, dị dạng nhiều) thường mang các trung thể khiếm khuyết hoặc suy thoái. Khi trung thể bị lỗi, việc hình thành thoi vô sắc bị rối loạn dẫn đến phân chia đa cực hoặc không đồng bộ, gây nên IRC. Điều này khẳng định rằng chất lượng phôi là kết quả của sự tương tác của cả bố và mẹ, chứ không chỉ phụ thuộc vào chất lượng noãn.
Nghiên cứu cũng cho thấy một phôi trải qua nhiều lần IRC (phân chia bất thường ở ≥ 2 chu kì tế bào) có tiên lượng kém hơn nhiều so với phôi chỉ có 1 IRC. Tỷ lệ thai lâm sàng giảm từ 30,8% (không IRC) xuống 23,4% (1 IRC) và sụt giảm xuống còn 5,0% nếu có ≥ 2 IRC. Ngoài ra, phôi có IRC sớm có tỷ lệ sinh sống (LBR) thấp nhất (3,1%) so với IRC muộn (15,8%). Điều này củng cố quan điểm rằng các sai sót xảy ra càng sớm trong quá trình phát triển thì hậu quả càng nặng nề [3].
Nuôi cấy phôi nang và cơ chế tự sửa sai của phôi phân chia bất thường
Trong thực hành lâm sàng, các chuyên gia thường đối mặt với tình huống như bệnh nhân chỉ có một phôi nang duy nhất nhưng lại có lịch sử phân chia trực tiếp hoặc phân chia ngược vào ngày 2. Câu hỏi đặt ra là liệu có nên chuyển phôi này không hay nên hủy phôi vì lo ngại dị tật?
Một nghiên cứu hồi cứu được thực hiện trên 1562 chu kỳ, theo dõi kết cục của 664 phôi nang được chuyển [4]. Các phôi này được phân loại dựa trên lịch sử phân chia:
- Phân chia trực tiếp (Direct Cleavage - DC).
- Phân chia ngược (Reverse Cleavage - RC).
Kết quả cho thấy phân chia bất thường làm giảm đáng kể khả năng phôi phát triển đến giai đoạn phôi nang. Tỷ lệ tạo phôi nang giảm từ 67,2% (bình thường) xuống còn 41,7% (RC) và 19,5% (DC). Điều này cho thấy quá trình nuôi cấy đến ngày 5 hoạt động như một "bộ lọc" tự nhiên, giúp loại bỏ phần lớn các phôi bất thường. Tuy nhiên, đối với những phôi vượt qua được bộ lọc này để trở thành phôi nang hoàn chỉnh thì kết cục sinh sản của chúng không khác biệt so với phôi bình thường. Dữ liệu cho thấy không có sự suy giảm về tỷ lệ sinh sống, cũng không có sự gia tăng nguy cơ sinh non hay nhẹ cân ở nhóm phôi có lịch sử bất thường. Thậm chí, nhóm RC còn có tỷ lệ sinh sống cao hơn một chút (33,0%) so với nhóm chứng, dù không có ý nghĩa thống kê, gợi ý rằng bản thân sự phân chia ngược có thể là một cơ chế sửa chữa thành công [5].
Các nghiên cứu tổng quan gần đây đã đề xuất cơ chế sinh học đằng sau hiện tượng phôi phục hồi (tức là một phôi có phân chia bất thường vẫn có thể phát triển thành một em bé khỏe mạnh):
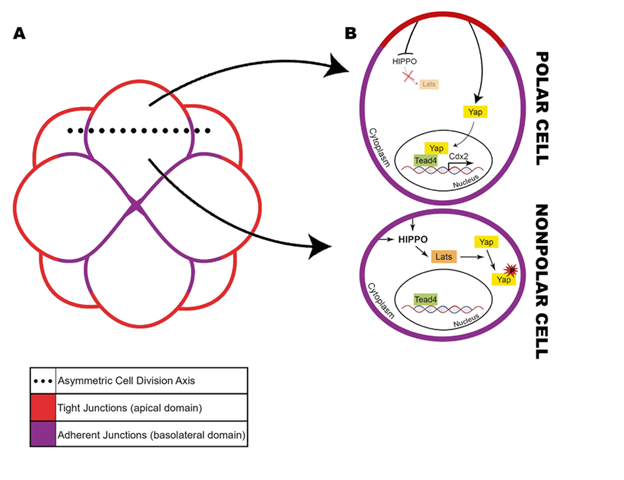
- Loại bỏ tế bào (Cell extrusion): Đây là cơ chế quan trọng nhất. Khi phôi nén (compaction) để hình thành phôi dâu (morula), nó có khả năng nhận diện các phôi bào bất thường (lệch bội, đa nhân) và chủ động đẩy chúng ra ngoài khối tế bào chung. Những tế bào bị loại bỏ này không tham gia vào quá trình hình thành phôi nang mà trở thành các mảnh vỡ hoặc tế bào thoái hóa nằm giữa zona pellucida và lớp lá nuôi. Phân tích di truyền cho thấy các mảnh vỡ này thường lệch bội, trong khi phần phôi nang chính là lưỡng bội [6].
- Chết tế bào theo chương trình (Apoptosis): Các tế bào mang sai hỏng nhiễm sắc thể nghiêm trọng sẽ kích hoạt con đường apoptosis và tự tiêu hủy. Nếu tỷ lệ tế bào chết không vượt quá ngưỡng tới hạn (critical threshold), các tế bào khỏe mạnh còn lại sẽ tăng tốc phân chia (proliferative compensation) để bù đắp số lượng, đảm bảo phôi nang có đủ tế bào để làm tổ [7].
- Sửa chữa qua phân chia ngược (Reverse Cleavage as Rescue): Một giả thuyết mới cho rằng phân chia ngược không phải là lỗi, mà là nỗ lực sửa sai. Nếu một lần phân chia diễn ra quá sớm khi nhiễm sắc thể chưa sẵn sàng, tế bào có thể đảo ngược quá trình (hợp nhất lại) để tái tổ chức bộ máy thoi vô sắc và thực hiện lại quá trình phân chia một cách chính xác hơn vào lần sau [5].
Kết luận
Sự chuyển đổi từ hợp tử đơn bào sang phôi nang hàng trăm tế bào đại diện cho một giai đoạn phát triển sớm phức tạp và tiềm ẩn nhiều bất ổn sinh học. Các nghiên cứu chuyên sâu gần đây đã cho thấy phôi người có tính linh hoạt rất lớn, chúng có thể sửa chữa các sai sót phân chia, loại bỏ các tế bào hỏng và phát triển thành những em bé khỏe mạnh. Tuy nhiên, sự linh hoạt này cũng có giới hạn. Các bất thường nghiêm trọng như phân chia trực tiếp tức thời (IDC) thường vượt quá khả năng sửa chữa của phôi.
Việc tối ưu hóa quy trình lựa chọn phôi đòi hỏi sự kết hợp giữa việc áp dụng chiến lược nuôi cấy kéo dài và nâng cao sự hiểu biết về các yếu tố sinh học quan trọng, bao gồm cơ chế định hướng của thoi vô sắc và ảnh hưởng của yếu tố nam giới. Theo đó, các chuyên gia cần có một góc nhìn chính xác và linh hoạt hơn đối với những phôi có dấu hiệu phân chia nhanh hoặc bất thường. Thay vì loại bỏ sớm vào ngày 3, nên triển khai chiến lược nuôi cấy kéo dài đến ngày 5 để tối đa hóa cơ hội phát triển và đánh giá khả năng tự điều chỉnh của phôi. Mục tiêu cuối cùng của cách tiếp cận toàn diện này là cải thiện đáng kể tỷ lệ thành công trong điều trị cho bệnh nhân hiếm muộn.
Tài liệu tham khảo
- NEMEROVSKY, Luba, et al. Two types of cleavage, from zygote to three cells, result in different clinical outcomes and should be treated differently. Frontiers in Cell and Developmental Biology, 2024, 12: 1398684.
- Porokh, V., Kyjovská, D., Martonová, M., Klenková, T., Otevřel, P., Kloudová, S., & Holubcová, Z. (2024). Zygotic spindle orientation defines cleavage pattern and nuclear status of human embryos. Nature Communications, 15(1), 6369.
- SHAVIT, Maya, et al. Cleavage patterns of 9600 embryos: the importance of irregular cleavage. Journal of Clinical Medicine, 2023, 12.17: 5656.
- LEE, Tammy, et al. Abnormal cleavage up to Day 3 does not compromise live birth and neonatal outcomes of embryos that have achieved full blastulation: a retrospective cohort study. Human Reproduction, 2024, 39.5: 955-962.
- Novo S, Yeste M, Montalvo V, Munuera A, Garcia-Faura A, Marquès B. The effect of reverse cleavage on embryo development and clinical outcomes. Reprod Biomed Online. 2025 May;50(5):104473. doi: 10.1016/j.rbmo.2024.104473. Epub 2024 Oct 11. PMID: 40138767.
- Wang X, Zhao J, Yao Z, Xia Q, Chang T, Zeng J, Liu J, Li Y, Zhu H. Arrested Cells/Cellular Debris Expelled from Blastocysts Is Self-Correction Phenomenon During Early Embryonic Development. Reprod Sci. 2023 Jul;30(7):2177-2187. doi: 10.1007/s43032-022-01159-8. Epub 2023 Jan 10. PMID: 36627481; PMCID: PMC10310642.
- Campos G, Sciorio R, Fleming S. Healthy Live Births after the Transfer of Mosaic Embryos: Self-Correction or PGT-A Overestimation? Genes. 2024; 15(1):18. https://doi.org/10.3390/genes15010018.