CNSH. Lê Thị Quỳnh – IVFMD SIH – Bệnh viện Phụ sản Quốc tế Sài Gòn
- Mở đầu
Quá trình phát triển của phôi ở động vật có vú được khởi đầu từ một hợp tử toàn năng, sau đó trải qua các đợt phân chia liên tiếp nhưng không thay đổi về mặt thể tích để hình thành khối phôi dâu. Tuy nhiên, bước ngoặt mang tính quyết định nhất chính là sự chuyển đổi từ phôi dâu sang phôi nang[1]. Đây không chỉ đơn thuần là sự thay đổi về mặt hình thái mà còn là một quá trình biệt hóa tế bào quan trọng, đặt nền tảng cho việc tách biệt hoàn toàn giữa các mô phôi và mô ngoài phôi[2].
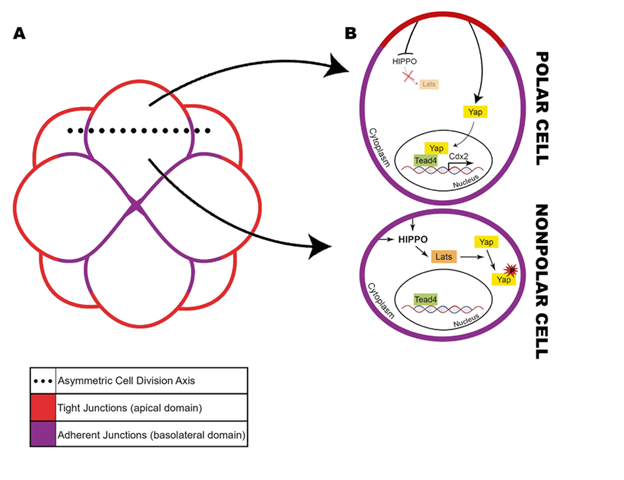
Sự biệt hóa này dẫn đến việc hình thành hai lớp tế bào riêng biệt là tế bào lá nuôi phôi (Trophectoderm - TE) và khối tế bào nội mô (Inner cell mass - ICM). Trong khi lớp TE phát triển thành biểu mô phân cực bao quanh phôi nang để đảm nhiệm vai trò bám dính vào nội mạc tử cung (NMTC) và hình thành nhau thai, thì khối ICM lại duy trì tính toàn năng bên trong để hình thành em bé[2]. Quá trình biệt hoá chính xác là điều kiện tiên quyết cho sự làm tổ thành công. Bất kỳ sự rối loạn nào trong quá trình biệt hóa cũng có thể dẫn đến tình trạng thai ngưng phát triển hoặc sảy thai sớm[3].
Để điều phối mạng lưới biệt hóa phức tạp này, con đường tín hiệu Hippo (Hippo signaling pathway) đóng vai trò quan trọng. Hippo hoạt động như một "trung tâm cảm biến sinh học", cho phép các phôi bào nhận diện vị trí không gian thông qua sự phân cực và mức độ tiếp xúc tế bào. Từ đó đảm bảo phôi phát triển đúng theo lộ trình di truyền đã định sẵn[3].
- Cơ chế phân tử của con đường tín hiệu Hippo trong phôi sớm
Hệ thống Hippo ở động vật có vú vận hành thông qua một chuỗi kinase ức chế (inhibitory kinase cascade), kiểm soát sự định vị dưới tế bào của các đồng yếu tố phiên mã (transcriptional co-activators).
Các thành phần kinase chính: MST1/2 và LATS1/2
Trung tâm của con đường tín hiệu Hippo là sự phối hợp của các kinase thượng nguồn MST1 và MST2 (Mammalian Ste20-like kinases) cùng protein SAV1[4]. Khi được kích hoạt, phức hợp này sẽ phosphoryl hóa các kinase hạ nguồn là LATS1 và LATS2 (Large Tumor Suppressor kinases) với sự hỗ trợ của protein điều hòa MOB1[4]. LATS1/2 đóng vai trò quyết định trạng thái hoạt động của các yếu tố hạ nguồn thông qua phản ứng phosphoryl hóa trực tiếp[5].
Đồng yếu tố phiên mã: YAP và TAZ
Đối tượng điều hòa chính của các kinase này là YAP1 (Yes-associated protein 1) và TAZ. Đây là những nhân tố có khả năng di chuyển vào nhân tế bào khi con đường Hippo ở trạng thái bất hoạt và không bị phosphoryl hóa[6]. Ngược lại, khi hệ thống Hippo được kích hoạt, LATS1/2 sẽ thực hiện phosphoryl hóa YAP tại các vị trí serine quan trọng, điển hình là Ser127 và Ser397[4]. Trong khi sự phosphoryl hóa tại Ser127 dẫn đến việc YAP bị giữ lại ở bào tương thông qua liên kết với protein 14-3-3, thì phản ứng tại Ser397 lại kích hoạt quá trình phân hủy protein thông qua con đường ubiquitin-proteasome[4].
Khi thoát khỏi sự ức chế và tiến vào bên trong nhân, YAP/TAZ sẽ liên kết với TEAD4 (TEA domain family member 4)[7] - một yếu tố sở hữu miền liên kết DNA nhưng bắt buộc phải có YAP/TAZ làm đồng yếu tố để khởi động quá trình phiên mã[8]. Phức hợp YAP-TEAD4 sau khi hình thành sẽ kích hoạt các gen mục tiêu đặc hiệu của TE, trong khi sự thiếu vắng YAP trong nhân sẽ khiến TEAD4 tương tác với các chất ức chế để duy trì trạng thái ức chế phiên mã, đảm bảo tính toàn năng của ICM[8].
Cơ chế biệt hoá dựa trên vị trí: Trục “Trong - Ngoài”
Sự điều phối của hệ thống Hippo trong giai đoạn phôi dâu chính là minh chứng cho việc vị trí không gian quyết định số phận tế bào thông qua trục "Trong - Ngoài". Tại các phôi bào lớp trong, việc tiếp xúc toàn diện với các tế bào lân cận sẽ kích hoạt con đường Hippo thông qua các phân tử như Angiomotin (AMOT) tại các mối nối bám[2]. Hệ quả là YAP bị phosphoryl hóa và bị cô lập ở bào tương, tín hiệu Hippo ON[3].
Ngược lại, tại các phôi bào lớp ngoài, sự tiếp xúc không đối xứng tạo ra sự phân cực đỉnh-đáy, giúp miền đỉnh tích tụ phức hợp phân cực PAR để ức chế Hippo bằng cách cô lập AMOT và LATS1/2[2]. Nhờ đó, YAP không bị phosphoryl hóa và có thể tự do định vị vào nhân để cùng TEAD4 kích hoạt sự biệt hoá thành TE, tín hiệu Hippo OFF[9].
- Cơ chế cảm biến của hệ thống Hippo
Tại tế bào lá nuôi phôi
Phức hợp YAP-TEAD4 hoạt động như một cỗ máy phiên mã mạnh mẽ, nhắm mục tiêu trực tiếp vào các vùng điều hòa (enhancer) của gen Cdx2 và Gata3[1]. Cdx2 là yếu tố phiên mã chỉ huy cho TE, yếu tố này cần thiết để ức chế các gen duy trì tính toàn năng như Oct4 và Nanog[8]. Theo nghiên cứu của Troilo và cộng sự (2016), Gata3 còn được xác định là một yếu tố phiên mã tiên phong giúp mở rộng cấu trúc chromatin tại các locus của gen TE, hỗ trợ cho quá trình biệt hóa từ phôi dâu sang phôi nang[10].
Tại khối tế bào nội mô
Do thiếu hụt YAP trong nhân, TEAD4 không thể kích hoạt Cdx2. Điều này tạo điều kiện cho các yếu tố toàn năng như Oct4, Nanog và Sox2 biểu hiện ổn định[2]. Đáng chú ý, Hippo không chỉ đóng vai trò ngăn chặn sự biệt hóa nhầm lẫn thành Cdx2 ở các tế bào lớp trong, mà còn mở khoá cho Sox2 – dấu ấn sớm nhất xác định sự hình thành ICM[2].
Sự ổn định này phụ thuộc vào việc giữ cho các yếu tố YAP/TAZ không xâm nhập vào nhân của tế bào lớp trong. Nếu YAP/TAZ xuất hiện bất thường trong nhân tại vị trí này, chúng sẽ trực tiếp ức chế Sox2, dẫn đến phá vỡ trạng thái toàn năng và ảnh hưởng đến quá trình phát triển bình thường của phôi[10].
- Các tín hiệu từ bề mặt tế bào và cơ chế truyền tin
Hệ thống Hippo vận hành như một trung tâm điều khiển thông minh, cho phép phôi cảm nhận và phản ứng lại các tín hiệu hóa học cũng như vật lý từ môi trường xung quanh[7].
Quá trình này bắt đầu từ sự phân cực tế bào, nơi phức hợp PAR (bao gồm PARD3, PARD6 và aPKC) tích tụ tại miền đỉnh của các tế bào lớp ngoài. Vai trò chính của phức hợp này là cô lập Angiomotin (AMOT), ngăn chặn sự tương tác của nó với các kinase LATS1/2[2]. Chính cơ chế này cho phép protein YAP tự do di chuyển vào nhân để kích hoạt các gen đặc hiệu. Ngược lại, ở các tế bào lớp trong, do AMOT không bị cô lập nên nó có thể liên kết chặt chẽ với protein E-cadherin tại các mối nối bám, từ đó giữ YAP lại ở bào tương[2].
Song song với các tín hiệu phân cực, sự hình thành và nở rộng của khoang phôi nang còn tạo ra áp suất thủy tĩnh nội bào, kích thích cơ học trực tiếp lên khung xương tế bào actin (F-actin)[11]. Khi nồng độ F-actin gia tăng dưới tác động của áp suất, hoạt tính kinase của LATS sẽ bị suy giảm, tạo điều kiện thuận lợi cho YAP định vị vào nhân tế bào[12]. Ngoài ra, mạng lưới điều hòa này còn có sự tham gia của các GTPase họ Rho, tiêu biểu là RHOA, giúp điều chỉnh hoạt động của Hippo dựa trên sức căng bề mặt màng tế bào[13]. Sự phối hợp nhịp nhàng giữa các tín hiệu cơ - sinh học này giúp đảm bảo sự ổn định và phát triển bình thường của TE trong suốt quá trình biệt hóa.
- Ý nghĩa trong hỗ trợ sinh sản
Việc hiểu rõ cơ chế vận hành của hệ thống Hippo không chỉ mang lại giá trị lý thuyết mà còn có ý nghĩa thực tiễn to lớn trong công nghệ hỗ trợ sinh sản (HTSS).
Đánh giá chất lượng và tiềm năng phát triển của phôi
Trong thực hành IVF, sự định vị chính xác của YAP (dạng hoạt động) và p-YAP (dạng bất hoạt) được xem là biomarker để đánh giá liệu phôi có đang phát triển đúng lộ trình hay không[1]. Nhờ sự hỗ trợ của hệ thống Time-lapse, nhiều nghiên cứu đã cho thấy mối tương quan giữa động học của các thành phần trong con đường Hippo với tiềm năng làm tổ và trạng thái nguyên bội của phôi[14]. Điều này cho phép chọn lọc những phôi tối ưu nhất, giảm thiểu rủi ro thất bại trong các chu kỳ chuyển phôi.
Tác động của tuổi mẹ lên sự điều hòa hệ thống Hippo
Tuổi mẹ cao liên quan đến sự suy giảm độ chính xác trong việc định vị các protein trong con đường tín hiệu Hippo. Ở phôi từ phụ nữ trên 37 tuổi, p-YAP (dạng bất hoạt) thường tích tụ sai vị trí trong tế bào TE, trong khi YAP (dạng hoạt động) lại xuất hiện bất thường trong nhân ICM[1]. Sự rối loạn này dẫn đến việc giảm biểu hiện các gen quan trọng như Cdx2 và Sox2. Điều này góp một phần vào giải thích nguyên nhân tỷ lệ có thai giảm ở phụ nữ lớn tuổi[1].
- Kết luận
Con đường tín hiệu Hippo đóng vai trò quan trọng trong quá trình biệt hóa tế bào. Sự chuyển đổi thành công từ phôi dâu sang phôi nang phụ thuộc vào tính chính xác của trung tâm cảm biến sinh học này. Quy luật chính trong giai đoạn phát triển tiền làm tổ chính là sự định vị của protein YAP: yếu tố này phải vào được trong nhân tế bào lớp ngoài để kích hoạt gene Cdx2 hình thành TE. Đồng thời, YAP phải bị ức chế không vào được nhân tế bào lớp trong nhằm đảm bảo tính toàn năng của ICM.
Từ khoá: tế bào lá nuôi phôi, khối tế bào nội mô, con đường tín hiệu Hippo, quá trình biệt hoá tế bào.
Tài liệu tham khảo:
[1] Gharanfoli, et al. (2020). Effect of Maternal Age on Hippo Pathway Related Gene Expressions and Protein Localization Pattern in Human Embryos. Cell journal, 22(Suppl 1), 74–80. https://doi.org/10.22074/cellj.2020.6860
[2] Gerri, et al. (2023). A conserved role of the Hippo signalling pathway in initiation of the first lineage specification event across mammals. Development (Cambridge, England), 150(8), dev201112. https://doi.org/10.1242/dev.201112
[3] Kruger, et al. (2025). Hippo signaling in mammalian reproduction. Reproduction (Cambridge, England), 169(6), e250016. https://doi.org/10.1530/REP-25-0016
[4] Wu, Z., & Guan, K. L. (2021). Hippo Signaling in Embryogenesis and Development. Trends in biochemical sciences, 46(1), 51–63. https://doi.org/10.1016/j.tibs.2020.08.008
[5] Gumbiner, B. M., & Kim, N. G. (2014). The Hippo-YAP signaling pathway and contact inhibition of growth. Journal of cell science, 127(Pt 4), 709–717. https://doi.org/10.1242/jcs.140103
[6] Engel-Pizcueta, C., & Pujades, C. (2021). Interplay between Notch and YAP/TAZ pathways in the regulation of cell fate during embryo development. Frontiers in Cell and Developmental Biology, 9, 711531. https://doi.org/10.3389/fcell.2021.711531
[7] Meng, et al. (2016). Mechanisms of Hippo pathway regulation. Genes & development, 30(1), 1–17. https://doi.org/10.1101/gad.274027.115
[8] Nishioka, et al. (2009). The Hippo signaling pathway components Lats and Yap pattern Tead4 activity to distinguish mouse trophectoderm from inner cell mass. Developmental cell, 16(3), 398–410. https://doi.org/10.1016/j.devcel.2009.02.003
[9] Carreiro, et al. (2021). Cell differentiation events in pre-implantation mouse and bovine embryos. Animal Reproduction, 18(4), e20210098. https://doi.org/10.1590/1984-3143-AR2021-0098
[10] Troilo, et al. (2016). Angiomotin stabilization by tankyrase inhibitors antagonizes constitutive TEAD-dependent transcription and proliferation of human tumor cells with Hippo pathway core component mutations. Oncotarget, 7(20), 28765–28782. https://doi.org/10.18632/oncotarget.9117
[11] Mohri, et al. (2017). The emerging role of YAP/TAZ in mechanotransduction. Journal of thoracic disease, 9(5), E507–E509. https://doi.org/10.21037/jtd.2017.03.179
[12] Maeda, H., & Sasaki, H. (2025). Blastocoel expansion and AMOT degradation cooperatively promote YAP nuclear localization during epiblast formation. Developmental Biology, 517, 36–52. https://doi.org/10.1016/j.ydbio.2024.10.007
[13] Zhao, et al. (2011). The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nature cell biology, 13(8), 877–883. https://doi.org/10.1038/ncb2303
[14] Clark, et al. (2022). Hippo Signaling in the Ovary: Emerging Roles in Development, Fertility, and Disease. Endocrine reviews, 43(6), 1074–1096. https://doi.org/10.1210/endrev/bnac013