Ths. Nguyễn Thị Thanh Tâm
Đơn vị HTSS IVFMD FAMILY, BVĐK Gia Đình, Đà Nẵng
1. Giới thiệu
Ở nam giới, tỷ lệ vô tinh hay không có tinh trùng trong tinh dịch chiếm khoảng 1% nam giới[1]. Trong nhiều nghiên cứu đoàn hệ hồi cứu, nhiều nam giới thực hiện thủ thuật thu nhận tinh trùng từ tinh hoàn (Testicular Extraction of Spermatozoa-TESE) hoặc chiết xuất tinh trùng từ tinh hoàn bằng kính hiển vi (Microdissection Testicular Sperm Extraction-mTESE). Tuy nhiên, vô tinh vẫn còn là thách thức về mặt lâm sàng do còn tương đối ít phương thức điều trị hiệu quả.
Khi không thu nhận được tinh trùng trưởng thành từ phẫu thuật, nam giới có rất ít lựa chọn. Tuy nhiên, có ý kiến cho rằng tinh tử tròn là tiền thân chưa trưởng thành của tinh trùng trưởng thành, có thể được tiêm thành công vào noãn người, sử dụng thay thế tinh trùng trưởng thành trong những trường hợp không còn lựa chọn khác. Trong số những nam giới vô tinh không do tắc nghẽn, có báo cáo cho rằng khoảng 30% bệnh nhân sẽ có tinh tử tròn[2]. Ngoài ra, ở người đã có báo cáo ca sinh thành công khi sử dụng kỹ thuật tiêm tinh tử tròn vào bào tương noãn (round spermatid injection-ROSI)[1].
.jpg)
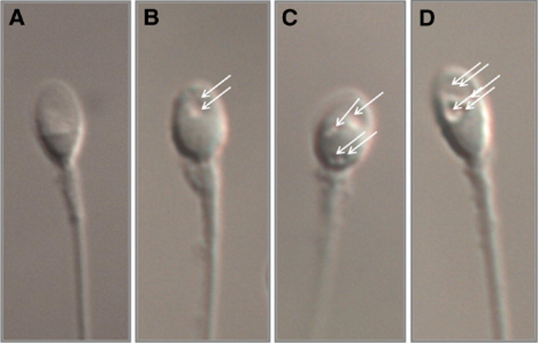
Hình: Nhận dạng tinh tử tròn[1]
Tinh tử tròn là tế bào sinh tinh nhỏ nhất (đường kính 6-8μm). Không giống như các tế bào sinh tinh khác, tinh tử không có nhân riêng biệt và viền tế bào chất của tinh tử bao quanh nhân mỏng hơn viền tế bào chất của tinh nguyên bào. Một đặc điểm quan trọng khác của tinh tử là tế bào chất của nó dễ tách khỏi nhân khi tế bào được di chuyển trong kim tiêm. Do đó, một số tinh nguyên bào nhìn giống tinh tử, nhưng hút bằng kim không tách tế bào chất của chúng ra khỏi nhân dễ dàng như ở tinh tử. Tế bào lympho, có kích thước bằng tinh tử, có màng sinh chất cứng không giống như tinh tử và không thể bị phá vỡ ngay khi dùng lực hút mạnh[1].
-
Dao động canxi
Trong quá trình thụ tinh bình thường, một noãn trưởng thành được kích hoạt ngay sau khi tinh trùng và noãn hợp nhất để bắt đầu một loạt các sự gia tăng nồng độ Ca2+ tự do trong tế bào chất, được gọi là dao động canxi. Các dao động canxi thúc đẩy một loạt các sự kiện xảy ra được gọi là hoạt hóa noãn. Sự gia tăng liên tục nồng độ Ca2+ trong tế bào chất cho đến khi hình thành tiền nhân là một sự kiện quan trọng cho sự thụ tinh bình thường và phát triển của phôi. Đối với tinh tử ở người có chứa chất hoạt hóa noãn nhưng không đủ để tạo ra dao động canxi tự do và đảm bảo sự thụ tinh, tiềm năng phát triển của phôi. Chính vì thế, hiện nay đã phát triển nhiều phương pháp hỗ trợ hoạt hóa noãn như hút cơ học trong quá trình thực hiện ROSI, tiêm canxi ionomycin, thông qua dòng điện[3]…
-
Hiệu quả
Nghiên cứu đoàn hệ hồi cứu thực hiện từ 2019 đến 2021 ở những bệnh nhân vô tinh không do tắc, thực hiện thụ tinh tiêm tinh trùng vào bào tương noãn (Intracytoplasmic Sperm Injection-ICSI) hoặc ROSI, thu nhận tinh trùng hoặc tinh tử thông qua phương pháp mTESE. Trong quy trình thực hiện ROSI: xác định tinh tử tròn, tiêm vào noãn và hoạt hóa noãn sau tiêm. Điều trị nội tiết trước ở bệnh nhân nam, sử dụng anastrozole ở bệnh nhân nam vô sinh có tỷ lệ testosterone huyết thanh (ng/dL)/estrogen (pg/mL) < 10. Kết quả ở nhóm ICSI và ROSI được đánh giá dựa trên tỷ lệ thụ tinh, làm tổ và trẻ sinh sống. Kết quả cho thấy không có sự khác biệt đáng kể về tỷ lệ thụ tinh giữa nhóm ICSI và ROSI (56,3% và 51,0%). Tỷ lệ làm tổ ở nhóm ICSI cao hơn so với nhóm ROSI (10,3% so với 4%; p=0,034). Tuy nhiên, sự khác biệt này không đáng kể sau khi điều chỉnh theo việc sử dụng anastrozole (p=0,077). Ngoài ra, tỷ lệ trẻ sinh sống ở nhóm ICSI cao hơn đáng kể so với nhóm ROSI (30,8% so với 8,3%) trước và sau khi điều chỉnh các yếu tố gây nhiễu[4]
Phân tích kết quả của 22 bài nghiên cứu, các báo cáo bao gồm thông tin về số lượng noãn được tiêm, tỷ lệ thụ tinh, mang thai, sảy thai, loại hoạt hóa noãn, phương pháp thu nhận tinh tử[5]… Kết quả cho thấy có sư khác biệt đáng kể giữa tỷ lệ thụ tinh ở các nhóm nghiên cứu khác so với nhóm của Tanaka (36,60 ± 15,53%) và (58,15 ± 1,95%), qua đó cho thấy, các nghiên cứu của nhóm Tanaka đạt tỷ lệ thụ tinh cao hơn đáng kể. Lý do có sự khác biệt giữa các báo cáo từ năm 1996 đến 2015 so với các báo cáo của nhóm Tanaka năm 2015, 2018 có thể do: (1) quan sát tinh tử tròn bằng kính hiển vi tương phản pha Hoffman có độ phân giải thấp hơn so với kính hiển vi tương phản giao thoa vi sai Nomarski. (2) Các phương pháp chuẩn bị khác nhau cho các mô sinh tinh đã loại bỏ, quy trình đơn giản so với có hoặc không có chế phẩm bằng enzyme. Môi trường có DNase và collagenase giúp dễ phân lập tế bào sinh tinh. (3) Hầu hết các báo cáo trước đều sử dụng phương pháp cơ học hút bào tương noãn để hoạt hóa noãn[5].
-
Thách thức
Mặc dù các thử nghiệm đã cho thấy sự tiến bộ khi thực hiện ROSI ở người và hơn 100 em bé khỏe mạnh đã được sinh ra mà không có bất thường biểu sinh rõ ràng, nhưng vẫn còn một thách thức do tỷ lệ thành công thấp, điều này hạn chế việc áp dụng phương pháp này. Đầu tiên, việc phân biệt tinh tử tròn với các loại tế bào mầm khác có thể còn khó khăn nhưng lại rất quan trọng khi thực hiện phương pháp này. Các phương pháp hiện tại nên được tối ưu hóa để ít tốn thời gian hơn nhưng tăng hiệu quả, không xâm lấn trước khi thao tác ROSI. Ngoài ra, tinh tử tròn từ xuất tinh hoặc sinh thiết tinh hoàn có thể được xử lý trước khi ROSI như nuôi cấy hoặc bảo quản lạnh. Bên cạnh đó, cần thử nghiệm nhiều phương pháp hỗ trợ hoạt hóa noãn kết hợp ROSI khi thực hiện ở người để so sánh kết quả mang lại và cần thêm các nghiên cứu để cải thiện khi thực hiện hoạt hóa noãn[3].
-
Kết luận
Hiệu quả khi thực hiện ROSI vẫn còn kém và không ổn đinh, và vẫn chưa được xem là một thủ thuật thường quy. Cần có thêm nhiều nghiên cứu chuyên sâu về các vấn đề kỹ thuật và đạo đức để cân nhắc giữa lợi ích và rủi ro, mặc dù ROSI có thể là cơ hội cuối cùng cho những bệnh nhân muốn có con ruột nhưng đã thất bại với các phương pháp khác.
Tài liệu tham khảo
1. Tanaka, A., Nagayoshi, M., Takemoto, Y., Tanaka, I., Kusunoki, H., Watanabe, S., Kuroda, K., Takeda, S., Ito, M., & Yanagimachi, R. (2015). Fourteen babies born after round spermatid injection into human oocytes. Proceedings of the National Academy of Sciences, 112(47), 14629–14634. https://doi.org/10.1073/pnas.1517466112
2. Hanson, B. M., Kohn, T. P., Pastuszak, A. W., Scott, R. T., Cheng, P. J., & Hotaling, J. M. (2021). Round spermatid injection into human oocytes: A systematic review and meta-analysis. Asian Journal of Andrology, 23(4), 363–369. https://doi.org/10.4103/aja.aja_85_20
3. Tao, Y. (2022). Oocyte activation during round spermatid injection: State of the art. Reproductive BioMedicine Online, 45(2), 211–218. https://doi.org/10.1016/j.rbmo.2022.03.024
4. Cheng, N.-M., Huang, W. J., Huang, C.-Y., Chen, Y.-J., & Ho, C.-H. (2025). Clinical outcomes of round spermatid injection vs intracytoplasmic sperm injection: The role of hormonal pretreatment for nonobstructive azoospermia. Journal of the Chinese Medical Association, 88(1), 52–57. https://doi.org/10.1097/JCMA.0000000000001184
5. Tanaka, A., & Watanabe, S. (2023). How to improve the clinical outcome of round spermatid injection (ROSI) into the oocyte: Correction of epigenetic abnormalities. Reproductive Medicine and Biology, 22(1), e12503. https://doi.org/10.1002/rmb2.12503