Ths. Bs. Dương Công Bằng
IVF Mỹ Đức SIH - BV Phụ Sản Quốc Tế Sài Gòn
MỞ ĐẦU
Lạc nội mạc tử cung (LNMTC, endometriosis) là một bệnh lý mạn tính, phụ thuộc vào hormone sinh dục estrogen và được chẩn đoán bằng sự hiện diện của biểu mô và/hoặc mô đệm giống nội mạc tử cung ở bên ngoài vị trí nội mạc chính vị và cơ tử cung. Năm 1927, John Sampson đặt tên cho bệnh lý này là endometriosis và đề xuất giả thuyết trào ngược máu kinh để giải thích về sinh lý bệnh. Trên toàn thế giới, có xấp xỉ 10% phụ nữ trong độ tuổi sinh sản mắc LNMTC [1].
Ở thời kỳ đó, điều trị LNMTC được chỉ định cho bệnh nhân (BN) có đau vùng chậu nặng, với 1 lựa chọn duy nhất là phẫu thuật cắt tử cung và/hoặc buồng trứng, kể cả BN trẻ tuổi. Và có 1 điều thú vị, từ năm 1953, đã có khuyến cáo điều trị dự phòng LNMTC bằng cách kết hôn sớm và sinh con thường xuyên hơn dựa trên những quan sát trên lâm sàng. Cơ sở của khuyến cáo này càng rõ ràng hơn khi đến năm 1959, các nghiên cứu cho thấy trạng thái mang thai có tác động tích cực đến sinh lý bệnh của LNMTC, thông qua phản ứng màng rụng hóa gây hoại tử và giới hạn tình trạng cấy ghép trên bề mặt của mô bệnh [2]. Từ đây, cơ chế kích hoạt trạng thái “nội tiết giống thai kỳ”, hay chính là sử dụng các chất có hoạt tính progesterone (progestin) tác động qua thụ thể progesterone (PR) trong kiểm soát LNMTC đã ra đời.
Trải qua hơn nửa thế kỷ, bên cạnh những trường hợp thành công thì vẫn còn những BN chỉ cải thiện 1 phần hoặc không đáp ứng với tất cả các biện pháp điều trị. Và con đường đi tìm câu trả lời cho vấn đề: Tại sao các liệu pháp điều trị LNMTC bằng hormone đôi khi vẫn thất bại? Bài tổng quan này nhằm mục đích điểm lại các cơ chế tác động của các progestin lên PR để lý giải cho các tình huống thất bại và mở ra cơ hội điều trị thành công cho những BN này.
ĐẶC ĐIỂM THỤ THỂ PROGESTERONE Ở NỘI MẠC TỬ CUNG CHÍNH VỊ VÀ TẠI MÔ LẠC NỘI MẠC TỬ CUNG
Progesterone tự nhiên và các progestin tổng hợp đều điều hòa các tác động sinh lý thông qua 3 nhóm PR đặc hiệu là: 1) PR tại nhân (gồm loại A và B) [3], 2) Đồng phân của PR tại ty thể - cùng nguồn gốc từ gen thụ thể progesterone (PGR), 3) thụ thể tại màng tế bào. Ngoài ra, progesterone và progestin có thể tác động lên cả thụ thể của glucocorticoid, mineralcorticoid và androgen.
Tại nội mạc tử cung (NMTC) của người có đồng thời 2 loại PRA và PRB, nhưng số lượng và tỉ lệ của 2 dạng đồng phân này thay đổi tùy vào sự đáp ứng của tế bào nội mạc với các hormone sinh dục của buồng trứng tiết ra, nhưng thường là PRA chiếm ưu thế hơn PRB [4]. Mật độ của PR ở biểu mô tuyến lớn hơn rất nhiều so với chất nền NMTC và được biểu hiện tối đa vào giữa chu kỳ kinh, sau đó giảm từ từ đến đáy ở cuối pha chế tiết.
Đối với tổn thương LNMTC, kết quả từ các nghiên cứu cho thấy sự biểu hiện của PR tại đây bị mất đi sự biến đổi tuần tự theo chu kỳ kinh, đồng phân PRA chiếm ưu thế và mật độ của PRB rất thấp hoặc có thể không phát hiện được [4]. Với tổn thương LNMTC sâu tại trực tràng, PR đều biểu hiện ở cả mô tuyến và chất nền, nhưng PRB lại bị ức chế. Cơ chế của hiện tượng PRA ưu thế hơn PRB là do tình trạng tăng methyl hóa vùng khởi đầu (promoter) của gen PGR, dẫn đến kết cục chỉ phiên mã vùng PRA - vùng không methyl. Và nguyên nhân của tình trạng methyl hóa bất thường tại vùng khởi đầu của PGR tại tổn thương LNMTC được cho là do sự tăng nồng độ các cytokine tiền viêm trong môi trường viêm mạn tính.
TỔNG HỢP CƠ CHẾ TÁC ĐỘNG CỦA PROGESTIN LÊN TỔN THƯƠNG LẠC NỘI MẠC TỬ CUNG
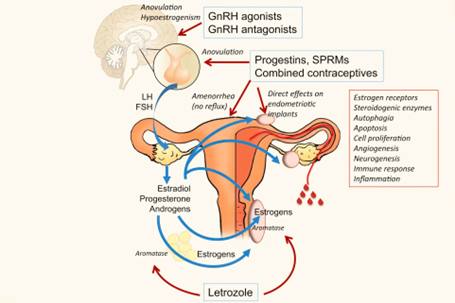
Tác động của progestin lên trục hạ đồi - tuyến yên - buồng trứng
Progestin có tác động từ những tầng trên của trục thông qua cơ chế: 1) ức chế vùng hạ đồi sản xuất hormone kích thích bài tiết hormone sinh dục (GnRH), 2) ức chế tuyến yên bài tiết hormone kích thích nang noãn (FSH) và hormone hoàng thể (LH). Ngoài ra, các progestin còn được đề xuất thêm hoạt tính giống hormone androgen (androgenic), góp phần vào tác động ức chế sản xuất hormone sinh dục (gonadotropin). Tuy nhiên, các hoạt chất có nguồn gốc từ 17-hydroxyprogesterone như MPA hoặc cyproterone acetate, đều có cả khả năng tác động giống hoặc kháng androgen nhưng vẫn sở hữu tác động khác gonadotropin. Một số hoạt chất khác như dẫn xuất của 19-norprogesterone, nomegestrol acetate (NOMAC) không có hoạt tính androgenic hoặc dẫn xuất của 19-nortestosterone, norethisterone acetate (NETA) có hoạt tính androgenic nhưng vẫn có tác động kháng gonadotropin. Do đó, đây không phải là yếu tố thiết yếu của progestin điều trị LNMTC.
Một hoạt chất điều trị LNMTC đã từng rất quen thuộc là Danazol. Chất này có tác động kháng gonadotropin và với liều uống hàng ngày 400 mg sẽ ức chế đồng thời đỉnh LH và sự phóng noãn. Tuy nhiên, với các tác dụng phụ liên quan đến hoạt tính androgenic nên phác đồ này đã không còn được sử dụng.
Với progestin được bào chế qua dạng đặt âm đạo (Hệ thống phóng thích levonorgestrel trong tử cung - LNG-IUS), dù cùng cơ chế tác động lên trục nhưng nồng độ FSH chỉ giảm về dưới giới hạn trên của pha hoàng thể bình thường, còn nhịp tiết và đỉnh LH trước phóng noãn vẫn xuất hiện.
Tác động lên thụ thể estrogen và quá trình tổng hợp estrogen
Tín hiệu từ PR sinh ra bởi progestin gây điều hòa xuống thụ thể của estrogen (ERs) và là cơ chế được lưu tâm nhất trong điều trị endometriosis. Tác động này còn xảy ra ở cả mô tuyến và mô chất nền của tổn thương LNMTC. Một con đường tác động khác của progestin lên quá trình sản xuất estradiol là ức chế sự biểu hiện men thơm hóa (aromatase), dẫn đến giảm tổng hợp estrogen; với điển hình là biệt dược dienogest. MPA cũng có khả năng tác động như trên.
Với dòng tế bào biểu mô Z-12 có trong tổn thương LNMTC ở phúc mạc, các hoạt chất như MPA, dydrogesterone và dienogest có thêm khả năng ức chế men 17 beta-hydroxysteroid dehydrogenase (17β-HSD) nhóm I, là enzyme xúc tác cho quá trình giảm phản ứng chuyển từ estrone sang estradiol (dạng không có hoạt tính cao hơn). Bên cạnh đó, các hoạt chất trên có khả năng điều hòa lên sự biểu hiện của 17β-HSD type 2, là men có khả năng bất hoạt estradiol.
Tuy nhiên, một số progestin có nguồn gốc từ 19-nor-testosterone như norethisterone, gestodene lại bị chuyển hóa thành dạng không thơm (non-phenolic) với cấu trúc giảm đi 1 vòng và lại có hoạt tính estrogen thông qua ERα.
Tác động lên quá trình tăng sinh và thoái hóa, phân bố mạch máu của tổn thương LNMTC
Các progestin tạo ra trực tiếp làm giảm mức độ của phản ứng viêm tại tổn thương và kích hoạt trạng thái giả thai kỳ (pseudo-pregnancy) với biểu hiện tăng phản ứng chết theo chương trình (apoptosis) tại tổn thương LNMTC, cuối cùng dẫn đến thu nhỏ kích thước của tổn thương [5]. Kết quả này đạt được thông qua các diễn tiến tuần tự sau khi sử dụng progestin gồm: 1) kích thích phản ứng chế tiết; 2) điều hòa giảm ER sau một vài chu kỳ; 3) tổn thương bị teo đi do các ống tuyến chuyển dạng đơn giản, các túi tiết nhỏ đi và mật độ tế bào tại mô đệm giảm xuống. Progestin còn kích thích làm giảm mật độ của các sợi thần kinh và nồng độ các yếu tố tăng trưởng thần kinh xung quanh các tổn thương LNMTC tại phúc mạc [5]. Tuy nhiên, không có một hình ảnh mô học của tổn thương LNMTC điển hình sau điều trị với các loại progestin khác nhau, nên đáp ứng điều trị trên lâm sàng cũng sẽ khác nhau.
Tác động lên phản ứng đáp ứng miễn dịch tại chỗ
Tổn thương LNMTC liên quan đến những thay đổi về miễn dịch dịch thể và miễn dịch qua trung gian tế bào. Biểu hiện thông qua tình trạng dịch phúc mạc của những phụ nữ bị LNMTC chứa các tế bào miễn dịch bài tiết các cytokine và yếu tố tăng trưởng, có vai trò trong quá trình duy trì - lan rộng tổn thương LNMTC xâm nhiễm.
Bằng chứng cho thấy progesterone, dienogest và danazol có khả năng làm giảm mức độ biểu hiện của interleukin (IL) - 8 thông qua giảm hoạt tính của yếu tố kapp B được hoạt hóa bởi yếu tố hoại tử khối u (NF-κB) [6]. Dienogest và danazol còn có khả năng đảo ngược một số phản ứng đáp ứng miễn dịch của hệ thống đối với tổn thương LNMTC.
Những tác động khác nhau của progestin lên NMTC và tổn thương LNMTC
Tổn thương LNMTC có điểm khác biệt rõ rệt với NMTC chính vị là tình trạng sản xuất một lượng rất lớn các gốc oxy tự do (ROS) như là hydrogen peroxide và các tế bào biểu mô của tổn thương không có khả năng giảm sản xuất ROS khi điều trị với cả danazol. Một nghiên cứu khác cho thấy các chất hóa học hấp dẫn (chemokine) bạch cầu eosinophi CCLI I được sản xuất ra bởi các tế bào biểu mô của tổn thương LNMTC khi chúng được kích thích với estradiol, MPA và các cytokine tiền viêm, kể cả khi vắng mặt các yếu tố kích thích viêm. Trong khi đó, tế bào biểu mô của nội mạc chính vị lại không giải phóng CCLI I kể cả khi kích thích bằng hormone hay phản ứng viêm.
Một cơ chế khác biệt quan trọng nữa liên quan đến yếu tố PTEN, là một chất ức chế khối u thông qua kích hoạt phản ứng chết theo chương trình tại tế bào mô đệm của nội mạc chính vị, với tác động ức chế AKT và hoạt hóa mTOR. Với NMTC chính vị, khi có sự hiện diện của progesterone thì dẫn đến tăng biểu hiện PTEN và giảm phosphoryl hóa AKT. Nhưng, các tế bào mô đệm của nang LNMTC và kể cả tế bào NMTC chính vị của những phụ nữ có tổn thương này cũng không có hiện tượng tăng PTEN khi tới pha chế tiết. Điều này dẫn đến con đường AKT/mTOR vẫn được hoạt hóa trong suốt chu kỳ kinh. Đây là những giả thuyết ban đầu giải thích cho hiện tượng thất bại điều trị LNMTC với progestin.
TẠI SAO ĐIỀU TRỊ LNMTC VỚI PROGESTIN CÓ THỂ THẤT BẠI
Đặc trưng của mỗi loại hoạt chất
Tất cả các hoạt chất progestin điều trị LNMTC hầu hết là được dán nhãn cho mục đích ngừa thai và/hoặc liệu pháp hormone thời kỳ mãn kinh, với liều dùng và liệu trình đủ để gây nên phản ứng màng rụng tại NMTC chính vị và ngăn ngừa tình trạng tăng sản NMTC. Bằng chứng lâm sàng để so sánh trực tiếp về hiệu quả giữa các hoạt chất này trong điều trị LNMTC còn ít.
Một nghiên cứu quan sát so sánh norethisterone acetate (NETA) và dienogest, sử dụng liên tiếp nhau, mỗi thuốc 6 tháng [7]. Kết quả cho thấy tỉ lệ tương đương giữa kết cục kiểm soát triệu chứng, cải thiện chất lượng cuộc sống giữa 2 nhóm. Tuy nhiên, còn nhiều điều chưa được làm sáng tỏ như: khả năng tác động lên tổn thương LNMTC để kích hoạt phản ứng apoptosis, khả năng ức chế sự nhân lên của tế bào, phản ứng xâm nhiễm xung quanh, phản ứng tân tạo mạch và phản ứng viêm.
Một nghiên cứu khác cho thấy hoạt chất chlormadinone acetate có khả năng ức chế sự tổng hợp men cyclooxygenase-2 với mức độ ổn định hơn so với tác động yếu của dienogest và drospirenone [8].
Cơ sở khác cho những trường hợp điều trị thất bại là sự xuất hiện đồng thời chất có hoạt tính estrogen cùng với progestin trong biệt dược. Kết quả từ một số nghiên cứu ngẫu nhiên có nhóm chứng (RCT) cho thấy những đối tượng nghiên cứu sử dụng đơn thuần progestin có mức độ cải thiện triệu chứng đau cao hơn nhóm sử dụng liệu pháp hormone kết hợp [9]. Việc tránh sử dụng hoạt chất có hoạt tính estrogen trong điều trị LNMTC hay ức chế tối đa quá trình tổng hợp estrogen là phù hợp.
Từ đây, chiến lược sử dụng chất đồng vận GnRH và các chất ức chế men aromatase (letrozole, anastrozole) là phù hợp. Tuy nhiên, các chất ức chế aromatase chỉ khởi động sự bài tiết các gonadotropin của tuyến yên để kích thích buồng trứng, nên phải sử dụng kết hợp thêm với 1 progestin hoặc chất ức chế gonadotropin khác khi điều trị cho những phụ nữ bị LNMTC giai đoạn tiền mãn kinh. Và đây được xem như là một lựa chọn thứ 2 cho chứng bệnh nhân điều trị thất bại với progestin.
Đặc trưng của liệu trình điều trị và đường dùng
Một nghiên cứu hồi cứu cắt ngang về độ sâu của tổn thương LNMTC ở các nhóm phụ nữ sử dụng các liệu pháp khác nhau (thuốc ngừa thai kết hợp - COC, progestin uống và chất đồng vận GnRH) với nhóm không điều trị [10]. Kết quả cho thấy có sự dao động lớn về kích thước tổn thương giữa các vị trí khác nhau, giữa các bệnh nhân khác nhau và giữa các lần điều trị khác nhau. Những tác động không nhất quán của progestin hệ thống lại trái ngược với sự ổn định của progestin tại chỗ LNG-IUS [11]. Một RCT khác cho thấy dạng cấy ghép của hoạt chất etonogestrel có hiệu quả tương đương với LNG-IUS trong kiểm soát đau và rối loạn kinh nguyệt [11].
Đặc trưng của kiểu hình bệnh lâm sàng
LNMTC có 3 loại kiểu hình lâm sàng khác nhau: endometriosis tại bề mặt, nang LNMTC tại buồng trứng, LNMTC thâm nhiễm sâu. Tùy vào việc sử dụng đặc điểm nào của tổn thương để đánh giá hiệu quả điều trị mà sẽ có các kết quả khác nhau. Với các tổn thương bề mặt, mức độ giảm tăng sinh mạch máu là đáng kể nhất so với các kiểu tổn thương khác. Còn với dienogest, sau 6 tháng điều trị vẫn chưa thể ức chế được phản ứng tân tạo mạch bên trong nang LNMTC. Với thông số kích thước, các khối LNMTC ở buồng trứng có xu hướng nhỏ lại đáng kể sau 6 tháng điều trị với norethisterone, drospirenone, dienogest [12]. Trái ngược lại, các tổn thương LNMTC thâm nhiễm sau lại có khả năng kháng với các liệu pháp điều trị nội khoa giảm khối của bộ phận hỗ trợ sinh sản.
Đặc trưng về dược động học của mỗi bệnh nhân
Đặc trưng về di truyền của mỗi cá nhân có thể ảnh hưởng đến hoạt tính sinh học của các thuốc chứa hormone trong điều trị LNMTC. Điều này giải thích một phần sự dao động trong kết quả điều trị. Một nghiên cứu bán định lượng về sinh thiết LNMTC sâu từ những phụ nữ đã điều trị liệu pháp hormone (như progestin, COC hoặc đồng vận GnRH) cho thấy kết quả có sự dao động lớn giữa kết quả nhuộm miễn dịch thụ thể ERα PR, đặc biệt là những nhóm điều trị với dienogest
[12]. Tính đa hình của gen ảnh hưởng đến quá trình chuyển hóa của hormone thông qua hệ thống chuyển hóa tại gan như cytochrome P450 3A, hay CYP34A, CYP2C19 [13]. Một nghiên cứu khác về các biến thể di truyền tại gen PGR ảnh hưởng tiêu cực đến tác động của progestin với các tổn thương lạc NMTC [14].
Có cơ hội nào để vượt qua tình trạng đề kháng với progestin tại mô LNMTC không?
Đề kháng với progesterone được định nghĩa là những đáp ứng của tế bào dưới mức bình thường khi có những tác động của progesterone tự nhiên, nhưng khái niệm này có thể mở rộng ra chi liệu pháp điều trị bằng progestin. Những cơ chế giả định về sự đề kháng với progestin trong điều trị LNMTC vẫn đang tiếp tục được cập nhật. Nhưng có thể tóm tắt thông qua cơ chế là sự thiếu hụt PRB do phiên mã, dịch mã không được thực hiện đầy đủ. Tình trạng này có thể do mắc phải hoặc do chính môi trường bên trong nang LNMTC nhiều các yếu tố gây viêm như ROS [15]. Và chiến lược để vượt qua hiện tượng này có thể là các chất chống oxy hóa.
VAI TRÒ CỦA CÁC CHẤT ĐIỀU HÒA CHỌN LỌC THỤ THỂ PROGESTERONE TRONG ĐIỀU TRỊ LNMTC
Các chất điều hòa chọn lọc thụ thể progesterone (SPRM) là các chất tổng hợp có khả năng tương tác với PR. Điểm khác biệt của các hoạt chất này là ái lực với PR và hoạt tính đối kháng [16].
Ulipristal acetate
Hoạt chất ulipristal acetate (UPA) đang được cấp phép cho điều trị ngừa thai khẩn cấp và điều trị trước phẫu thuật cho những trường hợp u xơ tử cung có triệu chứng. Đối với LNMTC, sự tái phát của tổn thương sau khi ngưng UPA sẽ chậm hơn với dydrogesterone [17]. Tuy nhiên, do nguy cơ độc cho gan nên vẫn cần thêm để làm rõ tác động này của thuốc.
Vilaprisan
Đây là một SPRM thế hệ mới, với nhiều ưu điểm hứa hẹn hơn và không có nguy cơ nhiễm độc cho gan. Với liều 2 mg/ngày, uống hàng ngày cho thấy làm giảm mức độ chảy máu và thể tích của khối u xơ tử cung [18].
Tuy nhiên, cho đến hiện tại, vẫn chưa có SPRM nào được cấp phép để điều trị endometriosis.
KẾT LUẬN
Dù đã được sử dụng để điều trị LNMTC hơn 60 năm, nhưng vẫn có những trường hợp thất bại với điều trị progestin. Tác động của các hoạt chất progestin phụ thuộc vào sự biểu hiện của PR. Nhưng sự biểu hiện này lại thường bị ức chế hoặc biến đổi trong tổn thương LNMTC. Rào cản này có thể được vượt qua bởi sự gia tăng liều thuốc hoặc thiết kế lại hoạt chất để tăng khả năng tương tác với PR. Các thuốc nội tiết ngừa thai phối hợp cũng có chung những giới hạn với hoạt chất progestin đơn độc và có thêm những ảnh hưởng từ hoạt tính estrogen lên tổn thương LNMTC. Việc hiểu về cơ chế của thành công và thất bại trong điều trị LNMTC bằng progestin sẽ giúp định hướng cho những quyết định trên lâm sàng và có thể mở ra những hướng nghiên cứu mới trong tương lai.
Các nghiên cứu thử nghiệm lâm sàng hiện nay đang tập trung vào các thuốc cũ với dạng bào chế mới (như vòng đặt âm đạo chứa danazol), hay thuốc mới nhưng cơ chế cũ (Đối vận GnRH dạng uống), hoặc cơ chế mới (như các chất ức chế enzyme tổng hợp hormone sinh dục) [19].
1. Ghiasi, M., M.T. Kulkarni, and S.A. Missmer, Is endometriosis more common and more severe than it was 30 years ago? Journal of minimally invasive gynecology, 2020. 27(2): p. 452-461.
2. Andrews, M.C., W.C. Andrews, and A.F. Strauss, Effects of progestin-induced pseudopregnancy on endometriosis: clinical and microscopic studies. American journal of obstetrics and gynecology, 1959. 78(4): p. 776-785.
3. Hill, K.K., et al., Structural and functional analysis of domains of the progesterone receptor. Molecular and cellular endocrinology, 2012. 348(2): p. 418-429.
4. Bedaiwy, M.A., et al., Abundance and localization of progesterone receptor isoforms in endometrium in women with and without endometriosis and in peritoneal and ovarian endometriotic implants. Reproductive Sciences, 2015. 22(9): p. 1153-1161.
5. Liang, B., et al., Efficacy, safety and recurrence of new progestins and selective progesterone receptor modulator for the treatment of endometriosis: a comparison study in mice. Reproductive Biology and Endocrinology, 2018. 16(1): p. 32.
6. Reis, F.M., et al., Progesterone receptor ligands for the treatment of endometriosis: the mechanisms behind therapeutic success and failure. Hum Reprod Update, 2020. 26(4): p. 565-585.
7. Vercellini, P., et al., Norethindrone acetate or dienogest for the treatment of symptomatic endometriosis: a before and after study. Fertil Steril, 2016. 105(3): p. 734-743.e3.
8. Roth, K., H.P. Zahradnik, and W.R. Schäfer, Effects of different progestins on prostaglandin biosynthesis in human endometrial explants. Contraception, 2019. 99(1): p. 61-66.
9. Morotti, M., et al., Progestogen-only contraceptive pill compared with combined oral contraceptive in the treatment of pain symptoms caused by endometriosis in patients with migraine without aura. Eur J Obstet Gynecol Reprod Biol, 2014. 179: p. 63-8.
10. Brichant, G., et al., Heterogeneity of estrogen receptor α and progesterone receptor distribution in lesions of deep infiltrating endometriosis of untreated women or during exposure to various hormonal treatments. Gynecol Endocrinol, 2018. 34(8): p. 651-655.
11. Engemise, S.L., et al., Changes in glandular and stromal estrogen and progesterone receptor isoform expression in eutopic and ectopic endometrium following treatment with the levonorgestrel-releasing intrauterine system. Eur J Obstet Gynecol Reprod Biol, 2011. 157(1): p. 101-6.
12. Lee, S.R., et al., Efficacy and Safety of Long-Term Use of Dienogest in Women With Ovarian Endometrioma. Reprod Sci, 2018. 25(3): p. 341-346.
13. Sapkota, Y., et al., Meta-analysis identifies five novel loci associated with endometriosis highlighting key genes involved in hormone metabolism. Nat Commun, 2017. 8: p. 15539.
14. D'Amora, P., et al., Disrupted cell cycle control in cultured endometrial cells from patients with endometriosis harboring the progesterone receptor polymorphism PROGINS. Am J Pathol, 2009. 175(1): p. 215-24.
15. Patel, B.G., et al., Progesterone resistance in endometriosis: origins, consequences and interventions. Acta Obstet Gynecol Scand, 2017. 96(6): p. 623-632.
16. Clemenza, S., et al., From pathogenesis to clinical practice: Emerging medical treatments for endometriosis. Best Pract Res Clin Obstet Gynaecol, 2018. 51: p. 92-101.
17. Liang, B., et al., Efficacy, safety and recurrence of new progestins and selective progesterone receptor modulator for the treatment of endometriosis: a comparison study in mice. Reprod Biol Endocrinol, 2018. 16(1): p. 32.
18. Bradley, L.D., et al., Vilaprisan in women with uterine fibroids: the randomized phase 2b ASTEROID 1 study. Fertil Steril, 2019. 111(2): p. 240-248.
19. Barra, F., et al., A comprehensive review of hormonal and biological therapies for endometriosis: latest developments. Expert Opin Biol Ther, 2019. 19(4): p. 343-360.