KS. Cao Vân Anh, ThS. Nguyễn Thị Liên Thi
Bệnh viện Đa khoa Gia đình Đà Nẵng
1. Giới thiệu
Tiêm tinh trùng vào bào tương noãn (Intracytoplasmic Sperm Injection – ICSI) ban đầu được phát triển để điều trị vô sinh nam, nhưng trong thập kỷ qua, chỉ định của kỹ thuật này đã mở rộng đáng kể và trở thành phương pháp được sử dụng thường quy tại nhiều trung tâm hỗ trợ sinh sản (HTSS). Tuy nhiên, trong thực hành ICSI thông thường, tinh trùng được lựa chọn dưới độ phóng đại 200–400 lần, điều này có thể tiềm ẩn nguy cơ lựa chọn phải tinh trùng mang các bất thường vi thể bao gồm rối loạn trung thể, tổn thương vật chất di truyền, giảm hàm lượng phospholipase C zeta (PLCζ), bất thường tỷ lệ protamine hoặc sai lệch methyl hóa DNA. Những khiếm khuyết này đã được chứng minh có thể ảnh hưởng tiêu cực đến quá trình hoạt hóa noãn, sự phát triển phôi sớm, khả năng làm tổ và kết cục thai kỳ [1].
Để tối ưu việc lựa chọn tinh trùng, nhiều chiến lược đã được phát triển. Tuy nhiên, do hạn chế của các phương pháp đánh giá tinh trùng sống hiện nay, việc quan sát tinh trùng ở độ phóng đại cao được xem là một trong những hướng tiếp cận khả thi nhất để nâng cao độ chính xác trong bước lựa chọn tinh trùng [2]. Trên cơ sở đó, kỹ thuật tiêm tinh trùng được chọn lọc hình thái bào tương (Intracytoplasmic Morphologically Selected Sperm Injection- IMSI) đã được phát triển, nhằm tối ưu hóa quá trình chọn lọc tinh trùng.
Mặc dù IMSI được kỳ vọng mang lại lợi ích lâm sàng, hiệu quả thực sự của kỹ thuật này vẫn còn nhiều tranh cãi. Vì vậy, mục tiêu của bài viết này nhằm hệ thống hóa các bằng chứng hiện có về cơ sở sinh học, hiệu quả lâm sàng và những giới hạn của IMSI, qua đó xác định vai trò phù hợp của kỹ thuật này trong thực hành hỗ trợ sinh sản hiện nay.
2. Cơ sở sinh học của việc chọn tinh trùng
Về nguyên tắc, có bốn đặc điểm khác nhau có thể được xem là cơ sở để lựa chọn một tinh trùng sống: (i) tính toàn vẹn của DNA, (ii) độ lưỡng chiết phản ánh cấu trúc tổ chức của đầu và cổ tinh trùng, (iii) mức độ trưởng thành chức năng, và (iv) hình thái được đánh giá ở độ phân giải cao.
Tuy nhiên, việc đánh giá các tiêu chí này trên tinh trùng sống dùng cho ICSI gặp nhiều hạn chế trong thực hành lâm sàng. Cụ thể, các xét nghiệm đánh giá đứt gãy DNA hầu như không thể thực hiện trên tinh trùng sống vì đa số phương pháp hiện nay gây tổn thương không hồi phục cho tế bào, khiến tinh trùng không còn khả năng sử dụng cho ICSI. Tương tự, việc sử dụng kính hiển vi phân cực để đánh giá tính chiết quang ở vùng đầu và cổ tinh trùng đòi hỏi hệ thống quang học chuyên biệt mà không phải trung tâm IVF nào cũng có thể đầu tư trong khi hiệu quả chưa được chứng minh rõ rệt. Trong khi đó, việc kiểm tra khả năng liên kết với thụ thể hyaluronic, một chỉ dấu của sự trưởng thành tinh trùng cũng còn nhiều tranh luận về hiệu quả. Chính vì những hạn chế này, việc quan sát tinh trùng sống ở độ phóng đại rất cao (khoảng 6.600 lần) trở thành phương pháp thực tiễn để đánh giá hình thái tinh trùng sinh lý [1].
3. Nguyên lý kỹ thuật IMSI
Kỹ thuật tiêm tinh trùng được chọn lọc hình thái bào tương là một cải tiến của ICSI, trong đó tinh trùng được lựa chọn ở độ phóng đại rất cao dựa trên tiêu chuẩn MSOME (Motile Sperm Organelle Morphology Examination) thay vì quan sát ở độ phóng đại 200–400 lần như ICSI thông thường. Năm 2001, Bartoov và cộng sự đã giới thiệu kỹ thuật đánh giá hình thái bào quan tinh trùng di động MSOME, cho phép quan sát hình thái nhân tinh trùng sống trong thời gian thực ở độ phóng đại cao. Phương pháp này sử dụng kính hiển vi đảo ngược được trang bị hệ quang học tương phản giao thoa vi sai (DIC-Differential Interference Contrast) công suất cao với độ phóng đại quang học 1500 lần, kết hợp với hệ thống ghi hình kỹ thuật số để đạt tổng độ phóng đại lên đến 6600 lần [3].
Ban đầu, MSOME đánh giá cấu trúc tinh trùng gồm acrosome, vùng sau acrosome, nhân, cổ, đuôi và ty thể. Tuy nhiên, các nghiên cứu sau đó cho thấy hình thái nhân tinh trùng là yếu tố có ảnh hưởng quyết định nhất đến kết quả ICSI. Ở mức phóng đại cao 6600 lần, tinh trùng có nhân bình thường được xác định dựa trên hình dạng bầu dục đều, bề mặt trơn láng, cấu trúc chromatin đồng nhất và không có không bào, hoặc chỉ có các không bào chiếm dưới 4% thể tích vùng nhân. Nhờ khả năng quan sát chi tiết này, MSOME cho phép phát hiện các bất thường bào quan vi thể ở tinh trùng di động – những bất thường thường bị bỏ sót khi đánh giá ở độ phóng đại 200–400 lần. Phương pháp này cũng cho thấy độ tin cậy cao khi phân tích lặp lại trên cùng bệnh nhân, với kết quả hình thái nhất quán [1].
Để thuận tiện cho việc đánh giá và phân tích thống kê, nhiều nhóm nghiên cứu đã sử dụng tiêu chuẩn MSOME để phân loại tinh trùng thành các nhóm hình thái khác nhau, từ đó chuẩn hóa quá trình lựa chọn tinh trùng trong IMSI.
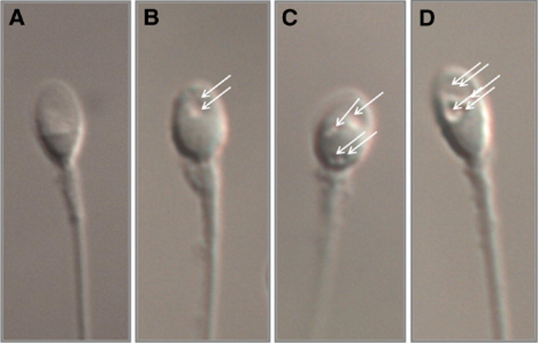
- Nhóm I: tinh trùng có đầu bình thường, không có không bào - đại diện cho nhóm tối ưu.
- Nhóm II: tinh trùng có tối đa hai không bào nhỏ.
- Nhóm III: tinh trùng có hơn hai không bào nhỏ hoặc ít nhất một không bào lớn.
- Nhóm IV: tinh trùng có không bào lớn kèm theo bất thường hình dạng đầu và các khiếm khuyết khác - là nhóm kém nhất [1].
Trong đó, nhóm 1 và nhóm 2 được xem ưu tiên sử dụng trong lựa chọn tinh trùng cho ICSI [4].
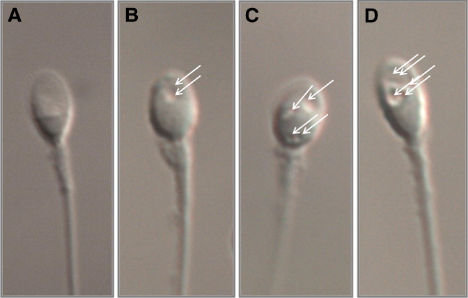
Hình 1. Các kiểu hình không bào trong đầu tinh trùng theo phân loại MSOME [5]
(A) Tinh trùng nhóm I, (B) Tinh trùng nhóm II, (C) Tinh trùng nhóm III, (D) Tinh trùng nhóm IV. Mũi tên chỉ vị trí các không bào trong đầu tinh trùng
4. Bằng chứng lâm sàng về hiệu quả của IMSI
Các nghiên cứu lâm sàng về hiệu quả của IMSI cho thấy kết quả không đồng nhất, phản ánh thực tế rằng IMSI không phải là kỹ thuật mang lại lợi ích cho mọi bệnh nhân, mà hiệu quả của nó phụ thuộc mạnh mẽ vào chất lượng tinh trùng và bối cảnh lâm sàng. Sự khác biệt giữa các nghiên cứu chủ yếu xuất phát từ thiết kế không đồng nhất, tiêu chí lựa chọn bệnh nhân khác nhau và sự khác biệt trong phương pháp phân loại hình thái tinh trùng ở độ phóng đại cao [6].
4.1. IMSI trong các trường hợp do yếu tố nam
Lợi ích của IMSI được ghi nhận rõ rệt ở các trường hợp vô sinh nam nặng, bao gồm tinh trùng dị dạng nặng (OAT) hoặc teratozoospermia. Việc chọn lọc tinh trùng ở độ phóng đại siêu cao trong IMSI giúp loại bỏ các giao tử kém chất lượng, từ đó cải thiện chất lượng phôi nang, tăng tỷ lệ làm tổ và nâng cao tỷ lệ sinh sống, với các báo cáo ghi nhận tỷ lệ trẻ sinh sống đạt khoảng 21–38% so với 12–20% ở ICSI thông thường ở nhóm bệnh nhân này [7], [8]. IMSI có thể cải thiện tỷ lệ thụ tinh ở các trường hợp vô tinh do tắc và dị dạng tinh trùng, đồng thời tăng tỷ lệ hình thành phôi nang ở những người vô tinh [9]. Vì vậy, IMSI có thể được coi là phương pháp điều trị được lựa chọn trong các trường hợp vô sinh nam nặng.
4.2. IMSI trong các trường hợp vô sinh không rõ nguyên nhân
Một bằng chứng quan trọng củng cố vai trò của IMSI đến từ nghiên cứu của Aula Asali và cộng sự (2020) trên nhóm vô sinh không rõ nguyên nhân. Nghiên cứu này cho thấy tỷ lệ tinh trùng bình thường theo MSOME có mối liên hệ nghịch với hiệu quả của IMSI. Cụ thể, tỷ lệ tinh trùng bình thường càng thấp thì hiệu quả của IMSI càng rõ rệt, do quá trình tìm kiếm tinh trùng trong IMSI được thực hiện kỹ lưỡng hơn dưới kính hiển vi siêu phóng đại, đặc biệt ở những trường hợp tinh trùng kém nặng. Ngay cả khi MSOME ban đầu không phát hiện tinh trùng bình thường, 89% cặp vợ chồng vẫn tìm được tinh trùng đạt chuẩn trong ngày chọc hút noãn nhờ quy trình tìm kiếm có mục tiêu [5]. Điều này cho thấy IMSI đặc biệt hữu ích trong những trường hợp rất khó tìm thấy tinh trùng bình thường.
4.3. IMSI trong các trường hợp thất bại ICSI nhiều lần (RIF-repeated ICSI failure)
Bartoov và cộng sự lần đầu tiên (2002) đánh giá IMSI ở 62 cặp vợ chồng có tiền sử ít nhất hai lần thất bại ICSI và so sánh với 50 cặp điều trị bằng ICSI thường quy tại cùng trung tâm. Mặc dù tỷ lệ thụ tinh và phôi chất lượng tốt không khác biệt, nhóm IMSI đạt tỷ lệ thai cao hơn và tỷ lệ sảy thai thấp hơn có ý nghĩa so với ICSI (66,0% so với 30,0%; 9,0% so với 33,0%; p < 0,01) [10]. Nhiều nghiên cứu tiếp theo đã xác nhận rằng những bệnh nhân có tối thiểu hai lần thất bại ICSI trước đó là nhóm hưởng lợi rõ rệt nhất từ IMSI. Antinori và cộng sự (2008) so sánh 227 chu kỳ IMSI với 219 chu kỳ ICSI và ghi nhận tỷ lệ thai lâm sàng cao hơn có ý nghĩa ở nhóm IMSI (39% so với 27%). Từ đó củng cố thêm giá trị của kỹ thuật IMSI trong thất bại ICSI nhiều lần [11].
4.4. IMSI đối với yếu tố noãn
Ở phụ nữ lớn tuổi, chất lượng noãn suy giảm làm giảm khả năng sửa chữa tổn thương tinh trùng sau thụ tinh, do đó vai trò của tinh trùng được chọn lọc trở nên quan trọng hơn [12]. Các nghiên cứu cho thấy IMSI có thể cải thiện chất lượng phôi ở phụ nữ lớn tuổi khi sử dụng tinh trùng có hình thái nhân tối ưu, giúp giảm ảnh hưởng bất lợi của tuổi mẹ [13]. Trong các chu kỳ xét nghiệm di truyền tiền làm tổ (PGT- Pre-implantation genetic testing), IMSI liên quan đến tỷ lệ phôi lệch bội và phôi đa bất thường thấp hơn, cũng như giảm số chu kỳ không có phôi để chuyển so với ICSI [13]. Tuy nhiên, bằng chứng hiện tại chưa thống nhất về khả năng IMSI làm giảm tỷ lệ lệch bội tổng thể của phôi. Nhìn chung, IMSI có thể mang lại lợi ích gián tiếp ở phụ nữ lớn tuổi bằng cách cải thiện chất lượng phôi và tăng cơ hội có phôi phù hợp để chuyển.
4.5. Nguy cơ sảy thai và dị tật bẩm sinh
Ngoài tỷ lệ mang thai, IMSI còn cho thấy ảnh hưởng tích cực lên kết cục thai kỳ muộn. Việc chọn lọc tinh trùng có nhân bình thường giúp giảm đáng kể nguy cơ sảy thai, với một số nghiên cứu ghi nhận giảm từ 57% xuống còn khoảng 10% [4]. Bên cạnh đó, một số bằng chứng cho thấy IMSI có thể góp phần giảm tỷ lệ dị tật bẩm sinh lớn (1,3% so với 3,8% ở ICSI) [14]. Tương tự, Hershko-Klement và cộng sự (2005) kết luận rằng quy trình IMSI không liên quan đến tỷ lệ dị tật tăng lên và có thể mang lại tỷ lệ dị tật thấp hơn [4]. Tuy nhiên, Gaspard (2018) xác nhận kết quả của hai nghiên cứu và cho thấy tỷ lệ dị tật được quan sát thấy ở nhóm IMSI và ICSI không khác biệt đáng kể [15].
4.6. IMSI ở các trường hợp không chọn lọc
Ở các bệnh nhân thực hiện chu kỳ ICSI đầu tiên, bằng chứng hiện tại không ủng hộ việc sử dụng IMSI thường quy. Năm 2021, Amr Moubasher và cộng sự nghiên cứu trên 525 cặp vợ chồng cho thấy ICSI mang lại tỷ lệ mang thai và sinh con sống cao hơn IMSI, trong khi tỷ lệ sảy thai không khác biệt. Kết quả này cho thấy IMSI không mang lại lợi ích nào thêm ở bệnh nhân điều trị lần đầu [16]. Ngoài ra, ở những cặp vợ chồng thực hiện ICSI trong trường hợp đáp ứng buồng trứng kém với kích thích buồng trứng có kiểm soát, IMSI không mang lại lợi ích lâm sàng rõ rệt [17]. Do đó, IMSI không được khuyến cáo cho những bệnh nhân có tinh trùng bình thường hoặc các cặp vợ chồng điều trị TTTON lần đầu tiên.
Tương tự nhận định này, một tổng quan phân tích của Teixeira và cộng sự (13 thử nghiệm ngẫu nhiên, 2.775 cặp vợ chồng) kết luận rằng bằng chứng hiện tại chưa đủ mạnh để khẳng định hoặc bác bỏ hiệu quả lâm sàng của IMSI. Độ chắc chắn về tác động của IMSI đối với tỷ lệ sinh con sống, sảy thai và dị tật bẩm sinh vẫn ở mức rất thấp, mặc dù có xu hướng tăng nhẹ tỷ lệ mang thai lâm sàng. Do đó, IMSI không được khuyến nghị áp dụng thường quy, mà chỉ nên cân nhắc cho các nhóm bệnh nhân chọn lọc. Các nghiên cứu tương lai cần thiết kế chặt chẽ hơn, với cỡ mẫu lớn và theo dõi dài hạn, nhằm đánh giá đầy đủ hiệu quả và độ an toàn của kỹ thuật này, đặc biệt đối với kết cục sinh sống và sức khỏe trẻ sơ sinh [18].
5. Hạn chế thực tiễn và hướng cải tiến của kỹ thuật IMSI
Mặc dù IMSI được xem là một kỹ thuật chọn lọc tinh trùng tiên tiến với nhiều lợi ích tiềm năng, việc ứng dụng rộng rãi trong thực hành lâm sàng vẫn gặp phải một số hạn chế thực tiễn quan trọng.
Thứ nhất, quy trình lựa chọn tinh trùng trong IMSI đòi hỏi thời gian dài hơn đáng kể so với ICSI thường quy, do chuyên viên phôi học phải tìm kiếm và đánh giá tinh trùng dưới độ phóng đại cao.
Thứ hai, chi phí triển khai IMSI cao do yêu cầu hệ thống kính hiển vi chuyên dụng có độ phóng đại lớn, hệ quang học DIC, hệ thống ghi hình kỹ thuật số và chi phí bảo trì, hiệu chuẩn định kỳ. Những yếu tố này làm gia tăng tổng chi phí điều trị, hạn chế khả năng tiếp cận của bệnh nhân và một số trung tâm hỗ trợ sinh sản, đặc biệt ở các quốc gia có nguồn lực hạn chế.
Thứ ba, IMSI đòi hỏi trình độ chuyên môn cao và đào tạo chuyên sâu cho chuyên viên phôi học. Việc nhận diện chính xác các bất thường vi thể của nhân tinh trùng, đặc biệt là không bào và các sai lệch hình thái, phụ thuộc nhiều vào kinh nghiệm và kỹ năng của người thao tác. Điều này làm tăng sự khác biệt về kết quả giữa các phòng lab và làm giảm mức độ đồng bộ trong kết quả nếu không có đào tạo chuẩn hóa.
Ngoài ra, tính chủ quan trong đánh giá hình thái tinh trùng vẫn là một thách thức đáng kể. Sự khác biệt giữa người quan sát có thể dẫn đến sai lệch trong lựa chọn tinh trùng, từ đó ảnh hưởng đến kết cục lâm sàng. Điều này nhấn mạnh nhu cầu cấp thiết về tiêu chuẩn hóa tiêu chí đánh giá tinh trùng trong IMSI nhằm giảm biến thiên giữa các trung tâm và nâng cao độ tin cậy của kết quả [2].
Do đó, trong tương lai, việc chuẩn hóa tiêu chí đánh giá hình thái tinh trùng, đào tạo chuyên môn cho chuyên viên phôi học và thiết kế các nghiên cứu ngẫu nhiên có đối chứng với cỡ mẫu lớn sẽ đóng vai trò then chốt trong việc xác định rõ giá trị lâm sàng thực sự của IMSI.
Trong khi các nỗ lực chuẩn hóa kỹ thuật và đào tạo vẫn đang được thúc đẩy, nhằm khắc phục rào cản chi phí, Huỳnh Gia Bảo và cộng sự (2012) đã đề xuất mô hình IMSI cải tiến tại Việt Nam, trong đó tinh trùng được đánh giá và lựa chọn ở độ phóng đại khoảng 600 lần (vật kính 40x kết hợp phóng đại phụ 1,5x), sau đó quay về độ phóng đại 200x để thực hiện ICSI thông thường. Tiêu chí lựa chọn tinh trùng dựa trên WHO 2010 và không có không bào. Kết quả cho thấy IMSI cải tiến không cải thiện tỷ lệ thụ tinh và chất lượng phôi, nhưng có xu hướng tăng tỷ lệ làm tổ và thai lâm sàng ở các trường hợp tinh trùng dị dạng. Với ưu điểm kỹ thuật đơn giản, chi phí thấp và dễ triển khai, IMSI cải tiến có thể là một lựa chọn thực tiễn nhằm cải thiện kết cục lâm sàng trong các chu kỳ ICSI do yếu tố nam. Hiện tại, phương pháp IMSI cải tiến này cũng đã được áp dụng rộng rãi ở các cơ sở HTSS của IVFMD [19].
6. Kết luận
IMSI có nhiều triển vọng trong lĩnh vực hỗ trợ sinh sản. Việc ứng dụng kính hiển vi độ phóng đại cao kết hợp với tiêu chí đánh giá hình thái MSOME nghiêm ngặt giúp cải thiện chất lượng tinh trùng được chọn lọc, đặc biệt ở các trường hợp vô sinh nam nặng, thất bại ICSI nhiều lần hoặc tuổi mẹ cao, khi chất lượng nhân tinh trùng ảnh hưởng trực tiếp đến sự phát triển phôi, khả năng làm tổ và kết cục thai kỳ.
Tuy bằng chứng hiện tại không ủng hộ việc áp dụng IMSI thường quy trong HTSS nhưng nhấn mạnh sự cần thiết phải tiếp tục nghiên cứu, nỗ lực hướng tới tiêu chuẩn hóa và kiểm tra toàn diện để đánh giá kỹ lưỡng hiệu quả của kỹ thuật và ý nghĩa của nó đối với các hoạt động hỗ trợ sinh sản. Đồng thời, cần có thêm các nghiên cứu theo dõi dài hạn nhằm đánh giá đầy đủ độ an toàn, sức khỏe và kết cục phát triển của trẻ sinh ra từ tinh trùng được chọn lọc bằng IMSI.
Tài liệu tham khảo
[1] Intracytoplasmic Morphologically Selected Sperm Injection’, Int. J. Fertil. Steril., vol. 8, no. 2, pp. 105–112, 2014.
[2] ‘Zhang, X., Chao, S., Ye, N., & Ouyang, D. (2024). Emerging trends in sperm selection: enhancing success rates in assisted reproduction. Reproductive Biology and Endocrinology, 22(1), 67.’
[3] E. Mangoli and M. A. Khalili, ‘The Beneficial Role of Intra Cytoplasmic Morphologically Selected Sperm Injection (IMSI) in Assisted Reproduction’, J. Reprod. Infertil., vol. 21, no. 1, pp. 3–10, 2020.
[4] ‘Berkovitz, A., Eltes, F., Yaari, S., Katz, N., Barr, I., Fishman, A., & Bartoov, B. (2005). The morphological normalcy of the sperm nucleus and pregnancy rate of intracytoplasmic injection with morphologically selected sperm. Human Reproduction, 20(1), 185-190.’
[5] A. Asali, N. Miller, Y. Pasternak, V. Freger, M. Belenky, and A. Berkovitz, ‘The possibility of integrating motile sperm organelle morphology examination (MSOME) with intracytoplasmic morphologically-selected sperm injection (IMSI) when treating couples with unexplained infertility’, PLOS ONE, vol. 15, no. 5, p. e0232156, May 2020, doi: 10.1371/journal.pone.0232156.
[6] A. Perrin, M. H. Nguyen, N. Douet-Guilbert, F. Morel, and M. De Braekeleer, ‘Intracytoplasmic morphologically selected sperm injection or intracytoplasmic sperm injection: Where are we 12 years later?’, Expert Rev. Obstet. Gynecol., vol. 8, pp. 261–270, May 2013, doi: 10.1586/eog.13.12.
[7] ‘Oliveira, J. B. A., Cavagna, M., Petersen, C. G., Mauri, A. L., Massaro, F. C., Silva, L. F., ... & Franco Jr, J. G. (2011). Pregnancy outcomes in women with repeated implantation failures after intracytoplasmic morphologically selected sperm injection (IMSI). Reproductive Biology and Endocrinology, 9(1), 99.’
[8] ‘El Khattabi L, Dupont C, Sermondade N, Hugues JN, Poncelet C, Porcher R, et al. Is intracytoplasmic morphologically selected sperm injection effective in patients with infertility related to teratozoospermia or repeated implantation failure? Fertil Steril. 2013;100(1):62–68. doi: 10.1016/j.fertnstert.2013.02.048.’
[9] ‘Gong, Y., Meng, X. Q., Liu, M., Wang, J., Xiong, F., Zhong, Y., & Quan, S. (2015). Intracytoplasmic injection of morphologically selected spermatozoa from patients with male factor infertility: clinical and embryo development outcomes. Nan Fang yi ke da xue xue bao= Journal of Southern Medical University, 35(10), 1428-1433.’
[10] ‘Pregnancy rates are higher with intracytoplasmic morphologically selected sperm injection than with conventional intracytoplasmic injection. Bartoov B, Berkovitz A, Eltes F, et al. Fertil Steril. 2003;80:1413–1419. doi: 10.1016/j.fertnstert.2003.05.016.’
[11] ‘Intracytoplasmic morphologically selected sperm injection: a prospective randomized trial. Antinori M, Licata E, Dani G, Cerusico F, Versaci C, D’angelo D, Antinori S. Reprod Biomed Online. 2008;16:835–841. doi: 10.1016/s1472-6483(10)60150-2.’
[12] ‘Cassuto, N. G., Bouret, D., Plouchart, J. M., Jellad, S., Vanderzwalmen, P., Balet, R., ... & Barak, Y. (2009). A new real-time morphology classification for human spermatozoa: a link for fertilization and improved embryo quality. Fertility and Sterility, 92(5), 1616-1625.’
[13] ‘Figueira Rde C, Braga DP, Setti AS, Iaconelli A, Jr, Borges E., Jr. Morphological nuclear integrity of sperm cells is associated with preimplantation genetic aneuploidy screening cycle outcomes. Fertil Steril. 2011;95(3):990–3.’
[14] ‘Cassuto NG, Hazout A, Bouret D, Balet R, Larue L, Benifla JL, et al. Low birthd efects by deselecting abnormal spermatozoa before ICSI. Reprod Biomed Online. 2014;28(1):47–53. doi: 10.1016/j.rbmo.2013.08.013.’
[15] ‘Gaspard, O., Vanderzwalmen, P., Wirleitner, B., Ravet, S., Wenders, F., Eichel, V., ... & Nisolle, M. (2018). Impact of high magnification sperm selection on neonatal outcomes: a retrospective study. Journal of Assisted Reproduction and Genetics, 35(6), 1113-1121.’
[16] ‘Moubasher A, Abdel-Raheem T, Ahmed H, Salem A, Doshi A, Abdel Raheem A. An Open Prospective Study on Whether Intracytoplasmic Morphologically Selected Sperm Injection (IMSI) Offers a Better Outcome Than Conventional Intracytoplasmic Sperm Injection (ICSI). Cureus. 2021 Nov 1;13(11):e19181. doi: 10.7759/cureus.19181. PMID: 34737916; PMCID: PMC8560014.’
[17] ‘Setti AS, Braga DP, Figueira RC, Iaconelli A, Jr, Borges E., Jr. Poor-responder patients do not benefit from intracytoplasmic morphologically selected sperm injection. J Assist Reprod Genet. 2015;32 (3):445–50.’
[18] ‘Teixeira, D. M., Miyague, A. H., Barbosa, M. A., Navarro, P. A., Raine‐Fenning, N., Nastri, C. O., & Martins, W. P. (2020). Regular (ICSI) versus ultra‐high magnification (IMSI) sperm selection for assisted reproduction. Cochrane Database of Systematic Reviews, (2).’
[19] ‘Tuấn, L. A., & Tường, H. M. HIỆU QUẢ CỦA KỸ THUẬT TIÊM TINH TRÙNG CÓ CHỌN LỌC HÌNH DẠNG (IMSI) CẢI TIẾN TRONG HỖ TRỢ SINH SẢN.’