ThS. Nguyễn Ngọc Yến Nhi, ThS. Nguyễn Thị Ngọc Hân, ThS.BS. Trần Phương Linh
Olea Fertility – Bệnh viện ĐKQT Vinmec Central Park
GIỚI THIỆU
Trong chu kỳ sinh sản tự nhiên, dịch nang noãn đóng vai trò như một vi môi trường sinh học, chứa nhiều hormone steroid như estradiol (E2), progesterone (P4) và androgen, bao quanh và nuôi dưỡng noãn trong suốt giai đoạn phát triển tiền rụng trứng. Các nghiên cứu gần đây cho thấy sự mất cân bằng các hormone steroid trong dịch nang, chẳng hạn giảm tiền chất androgen hoặc thay đổi tỉ lệ E2/P4, có thể ảnh hưởng đến chức năng ty thể, điều hòa biểu hiện gen, và làm giảm khả năng thụ tinh cũng như phát triển phôi nang 1–3 .Trong đó, P4 được biết đến là một trong những hormone quan trọng trong sản khoa, góp phần duy trì chức năng buồng trứng bình thường ở động vật có vú và có một số chức năng quan trọng trong quá trình phát triển và làm tổ của phôi, bao gồm khả năng tiếp nhận nội mạc tử cung, sự sống còn của phôi trong thời kỳ mang thai và sự chuyển đổi tế bào mô đệm nội mạc tử cung thành tế bào màng rụng.
Trong labo hỗ trợ sinh sản, các nghiên cứu trên mô hình động vật cho thấy vai trò tích cực của P4 đối với sự trưởng thành noãn, thụ tinh và sự phát triển của phôi in-vivo và in-vitro 4. Việc bổ sung P4 vào môi trường nuôi cấy phôi động vật tuy vẫn còn những kết quả trái chiều nhưng đa số cho thấy P4 cải thiện đáng kể sự phát triển phôi ở chuột và bò 5–7. Nghiên cứu về chủ đề này trên giao tử và phôi người còn khá hạn chế. Tuy vậy, những kết quả ban đầu này cũng gợi mở một hướng tiếp cận tiềm năng trong việc cải tiến thành phần môi trường nuôi cấy ở người.
TỔNG QUAN VỀ PROGESTERONE
Nguồn gốc
Progesterone – xuất phát từ gốc từ progestin (trong đó pro nghĩa là “hỗ trợ” và gest nghĩa là “thai kỳ”) – là một hormone steroid tự nhiên thuộc nhóm progestin, có công thức hóa học Pregn-4-ene-3,20-dione. Đây là một trong những hormone chủ đạo của tuyến sinh dục, được tổng hợp chủ yếu tại hoàng thể, nhau thai trong thai kỳ và tuyến thượng thận; ở nam giới, P4 cũng được tiết ra từ tinh hoàn và tuyến thượng thận 8. Trong buồng trứng, cholesterol được chuyển đổi thành pregnenolone, sau đó chuyển thành progesterone qua con đường Δ5 → Δ4 của steroidogenesis. Trong huyết thanh, P4 chủ yếu liên kết với albumin và có thời gian bán hủy ngắn, khoảng 5 phút 4. Ngoài vai trò sinh sản, P4 còn điều hòa miễn dịch, làm giãn cơ tử cung, ức chế sinh tổng hợp cholesterol và bảo vệ tế bào thần kinh thông qua các cơ chế tín hiệu ngoài nhân (non-genomic) 8.
Vai trò và cơ chế tác động
Progesterone được biết đến chủ yếu với vai trò điều hòa phiên mã để chuẩn bị nội mạc tử cung cho sự làm tổ, duy trì thai kỳ và kích thích tiết sữa. Ngoài ra, P4 còn là yếu tố cần thiết cho quá trình rụng trứng, tác động trực tiếp đến phức hợp cumulus-noãn 4. Các tác động sinh học của P4 được điều hòa thông qua hai cơ chế chính: trong nhân (genomic) và ngoài nhân (non-genomic).
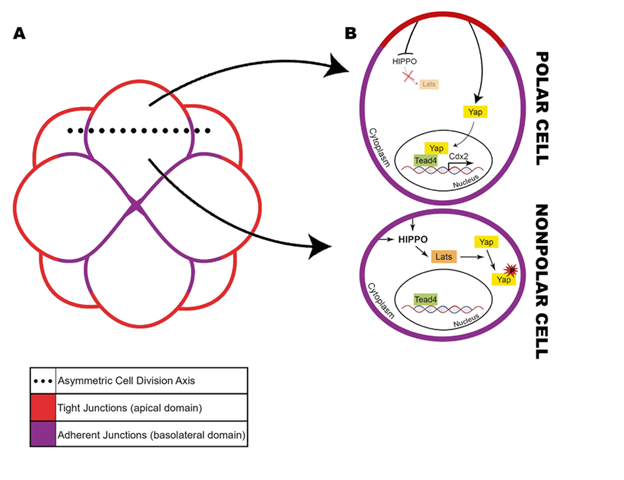
Ở cơ chế genomic, P4 gắn với các thụ thể nhân gồm ba dạng đồng phân PR-A, PR-B và PR-C. PR-A và PR-B được biểu hiện trong tế bào hạt của nang tiền rụng trứng, trong đó PR-A có vai trò ức chế mạnh hơn PR-B. Dù không có hoạt tính phiên mã, PR-C lại tham gia điều hòa chức năng của tế bào màng rụng trong giai đoạn thai kỳ muộn 4.
Ở cơ chế non-genomic, P4 hoạt động thông qua các thụ thể màng như progesterone membrane component 1/2 (PGRMC1/2) và mPR-α, β, γ, trung gian cho các tác động nhanh như điều hòa giảm phân ở noãn và giãn cơ tử cung 8,9. PGRMC1 kiểm soát chu kỳ phân bào và ức chế apoptosis, giúp duy trì sự sống của tế bào hạt và gián tiếp hỗ trợ sự phát triển của noãn và phôi. Trong khi đó, mPR hoạt động như thụ thể kết hợp protein G, truyền tín hiệu nhanh để điều hòa biệt hóa tế bào và chuyển hóa năng lượng 9–11.
Đáng chú ý, các nghiên cứu gần đây cho thấy thụ thể P4 trên màng ty thể (PR-M) cũng là một đích tác động quan trọng của P4. Ở giai đoạn noãn bào và phôi tiền làm tổ – khi thụ thể P4 nhân (nPR) thường vắng mặt – P4 phát huy hiệu quả chủ yếu thông qua PR-M 9. PR-M là dạng rút gọn của nPR, thiếu miền liên kết DNA nhưng có trình tự N-terminal đặc biệt giúp định vị tại ty thể 12. Khi P4 gắn vào PR-M, các quá trình phosphoryl hóa oxy hóa và oxy hóa acid béo được kích hoạt, làm tăng sản xuất ATP – nguồn năng lượng thiết yếu cho hoạt động của noãn và phôi 13.
BỔ SUNG PROGESTERONE VÀO MÔI TRƯỜNG NUÔI CẤY IN-VITRO
Môi trường nuôi cấy noãn, phôi
Nghiên cứu của Dai và cộng sự vào năm 2020 đã xác định được sự hiện diện của PR-M ở noãn và phôi tiền làm tổ của loài linh trưởng, giai đoạn thường vắng mặt sự xuất hiện của thụ thể P4 nhân (nPR) 9. Sau đó, nhóm nghiên cứu tiến hành xử lý noãn và phôi linh trưởng bằng P4 10-6M trong 48 giờ, ghi nhận sự gia tăng đáng kể điện thế màng ty thể, sự kiện này không ghi nhận ở phôi chuột và nhóm đối chứng (Hình 1). Từ những kết quả này, nhóm nghiên cứu đã ủng hộ giả thuyết rằng P4 có thể tác động đến các quá trình chuyển hóa ở noãn và phôi tiền làm tổ 12.
Đến năm 2024, sự biểu hiện PR-M cũng đã được ghi nhận trong tế bào lá nuôi (trophectoderm-TE) và khối tế bào bên trong (inner cell mass-ICM) ở dòng tế bào gốc phôi người trong nghiên cứu của Snow và cộng sự. Trong nghiên cứu này, nhóm tác giả cũng tiến hành nuôi cấy phôi sau rã đông giai đoạn phân chia đến giai đoạn phôi nang trong môi trường có bổ sung P4 10-6M. Phân tích RNA-seq cho thấy P4 tác động mạnh hơn đáng kể ở TE so với ICM.
Trong môi trường có bổ sung P4, phản ứng của TE bao gồm sự điều hòa tăng đáng kể các gen liên quan đến sao chép DNA, chuyển pha chu kỳ tế bào và các thay đổi khác liên quan quá trình phân bào. Trong đó, đặc biệt, kháng nguyên tế bào lympho 9 (LY-9) cũng là một gen được điều hòa tăng được tìm thấy trong TE và được biểu hiện rất sớm ở giai đoạn phôi nang. Việc điều hòa tăng LY-9 có thể hữu ích trong việc ngăn ngừa tình trạng đào thải thai kỳ sớm bởi phản ứng miễn dịch của cơ thể mẹ. Ngược lại, phần lớn các con đường trong ICM bị điều hòa giảm bao gồm phân tách nhiễm sắc thể, lắp ráp phức hợp tâm động và tái cấu trúc chromatin tại tâm động. Nhóm tác giả đi đến kết luận rằng phôi nang người biểu hiện PR-M ở cả TE và ICM và sự điều hòa gen bởi P4 khác biệt rất nhiều ở TE và ICM, với tác dụng chủ yếu là tăng sinh tế bào TE 9.
Môi trường nuôi cấy tinh trùng
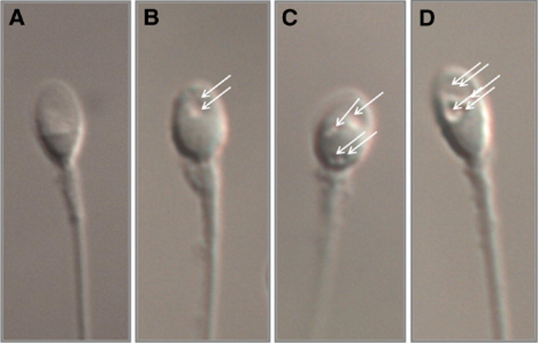
Đối với tinh trùng, P4 hoạt hóa kênh CatSper trên đuôi tinh trùng thông qua một cơ chế phức tạp liên quan đến α,β-hydrolase và được chứng minh có vai trò sinh lý trong quá trình thụ tinh 14. Một nghiên cứu đoàn hệ trên 24 nam giới đã ghi nhận việc xử lý tinh trùng với P4 10µM sau khi rửa tinh trùng và trước khi thụ tinh làm tăng khả năng vận động tăng động của tinh trùng, liên kết với hyaluronan và phosphoryl hóa tyrosine, mà không làm tăng phản ứng cực đầu sớm hoặc tổn thương DNA do oxy hóa (P < 0,05). Cũng trong nghiên cứu này, một số kết quả thử nghiệm về độ an toàn của việc bổ sung P4 cũng được đề cập. Nồng độ P4 10µM trong môi trường nuôi cấy phôi người đã đạt các thử nghiệm về an toàn phôi (thử nghiệm MEA và nội độc tố). Trong các mô hình tiền lâm sàng của IVF, việc cho tinh trùng tiếp xúc với P4 10µM và noãn tiếp xúc với P4 1µM được ghi nhận vẫn an toàn đối với giao tử, và làm tăng tỷ lệ thụ tinh ở chuột và số lượng phôi bào ở phôi nang ở chuột và lợn (P ≤ 0,03). Nghiên cứu sơ bộ quy mô nhỏ trên người (n=4), cũng cho thấy việc bổ sung P4 10µM vào tinh trùng sau lọc rửa bằng phương pháp bơi lên dường như không gây bất lợi cho kết quả lâm sàng trong IVF. Không có trường hợp nào bị thất bại thụ tinh hoàn toàn và tất cả phôi nang từ tinh trùng tiếp xúc với P4 đều dẫn đến kết cục sinh con sống. Hạn chế của nghiên cứu là cỡ mẫu còn hạn chế, tuy vậy, những kết quả thu được có thể mở đường cho các thử nghiệm với cỡ mẫu lớn hơn trong tương lai 15.
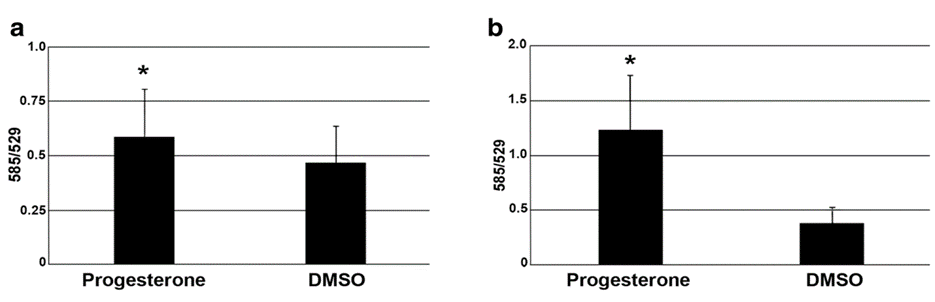
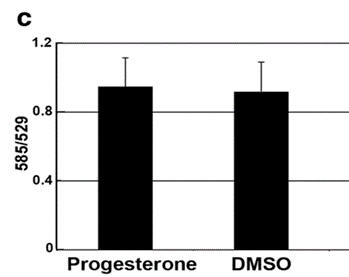
Hình 1: Sự thay đổi điện thế màng ty thể (Ψm) khi xử lý với P4 ở loài linh trưởng và chuột. (a) sự gia tăng Ψm ở noãn linh trưởng trong môi trường bổ sung P4 10−6 M so với nhóm đối chứng (p = 0,018, n = 7). (b) sự gia tăng Ψm ở phôi linh trưởng trong môi trường bổ sung P4 10−6 M so với nhóm đối chứng (p < 0,001, n = 6). (c) không có thay đổi về Ψm ở phôi chuột trong môi trường bổ sung P4 10−6 M so với nhóm đối chứng (p = 0,91, n = 11 đối với P4 và n = 9 đối với DMSO) 12.
KẾT LUẬN
Với các loại môi trường nuôi cấy trong labo hỗ trợ sinh sản, các chuyên gia đã và đang nỗ lực mô phỏng môi trường sinh lý trong sinh sản tự nhiên một cách hoàn hảo nhất có thể. Để có được những thành tựu như hiện nay, các chuyên gia đã trải qua một quá trình không ngừng nghiên cứu và phát triển. Với những bằng chứng có được về vai trò tích cực của P4 trong sự thụ tinh và phát triển của phôi, đây có thể là hướng mới cho những cải tiến trong tương lai về việc bổ sung hormone steroid vào môi trường nuôi cấy nhằm nâng cao hơn nữa hiệu quả thụ tinh trong ống nghiệm. Hạn chế chung của những thử nghiệm hiện tại là cỡ mẫu còn hạn chế. Do đó, cần có các thử nghiệm ngẫu nhiên có nhóm chứng quy mô lớn để xác định lợi ích lâm sàng thực sự, cũng như nồng độ tối ưu cho sự phát triển của giao tử và phôi ở người.
TÀI LIỆU THAM KHẢO