I. Bối cảnh
Đông lạnh mô buồng trứng (Ovarian Tissue Cryopreservation – OTC) đã trở thành một kỹ thuật quan trọng và ngày càng được ứng dụng rộng rãi trong bảo tồn khả năng sinh sản (KNSS) nữ giới. Theo báo cáo mới nhất 2024 ở Châu Âu, mỗi năm có khoảng 25.000 ca ung thư được chẩn đoán ở trẻ em và thanh thiếu niên với tỉ lệ sống sót sau 5 năm đạt khoảng 80% (1). Trong đó, có khoảng 76% người mong muốn có con (1,2). Ngoài đối tượng trẻ em trước tuổi dậy thì còn có những người trong độ tuổi sinh sản đang cần điều trị ung thư gấp. Bên cạnh phương pháp bảo tồn bằng đông lạnh noãn và phôi thì còn có đông lạnh mô buồng trứng. Chỉ định bảo tồn KNSS khác nhau phụ thuộc vào tình trạng bệnh lý của mỗi người. Nhưng OTC lại là lựa chọn duy nhất để bảo tồn KNSS cho trẻ trước tuổi dậy thì. Thống kê gần đây cũng cho thấy độ tuổi ở thời điểm đông lạnh mô có xu hướng giảm do tăng nhiều ở nhóm này, dẫn đến số ca OTC cũng tăng dần theo năm.
Nghiên cứu về cấy ghép mô buồng trứng (ovarian tissue transplantation – OTT) từ năm 2009 chỉ khoảng <10 công bố thì đến năm 2021-2022 đã đạt ngưỡng 35 bài, số lượt trích dẫn bài lên đến 1000 lượt (3). Điều này cho thấy sự tăng trưởng theo cấp số nhân trong hai thập kỷ qua đặc biệt là trong 5 năm gần đây. Hơn nữa, đã có 42 quốc gia trên toàn cầu tham gia và nghiên cứu sâu về OTC (3). Kỹ thuật này có tính đa ngành cao vì đòi hỏi sự hợp tác giữa các chuyên gia nội tiết sinh sản, bác sĩ ung bướu, phẫu thuật viên và chuyên viên phôi học. Quy trình chuẩn hóa và an toàn trong vận chuyển mẫu qua đêm trong vòng 24h ở 2-8°C cũng đang được áp dụng ở nhiều trung tâm (4). Theo hướng dẫn thực hành 2024, OTC-OTT là kỹ thuật khó, tiên tiến và sáng tạo. Do đó, các trung tâm có >10 ca OTT được xem là trung tâm lớn, nhưng trên toàn thế giới chỉ có hơn 20 trung tâm bảo quản đông lạnh mô buồng trứng lớn (5). Vì vậy nhiều nhà nghiên cứu đề nghị phương pháp đông lạnh mô buồng trứng nên được trung tâm hóa. Điều này cho thấy tầm quan trọng và xu hướng đang tăng dần của OTC.
II. Lịch sử phát triển và chỉ định OTC
Vào những năm 1990, kỹ thuật này chỉ được thử nghiệm trên mô hình động vật. Đến năm 1996, phương pháp OTC lần đầu tiên được mô tả trong y văn và 8 năm sau đó (2004), thế giới ghi nhận ca sinh sống đầu tiên sau OTT tự thân (1). Đây là cột mốc khẳng định tính khả thi của phương pháp. Sau đó, lần lượt các ca sinh sống khác cũng được ghi nhận và đến năm 2016, số ca sinh sống đã đạt 95 ca (1). Nhiều tổ chức quốc tế lần lượt công nhận giá trị của OTC. ASRM (2019) khẳng định OTC không còn là thử nghiệm (1). ESHRE (2020) ban hành hướng dẫn đầu tiên về OTC dựa trên bằng chứng (6). ASCO (2025) – Hiệp hội Ung thư lâm sàng Hoa Kỳ đã chính thức xem OTC là một phương pháp bảo tồn KNSS được khuyến nghị (7). Chẳng những vậy, kỹ thuật đông lạnh mô đang dần hoàn thiện và cải tiến, gần đây (2024) đã có ca sinh sống đầu tiên sau cấy ghép mô tự thân và mang thai tự nhiên được bảo quản bằng kỹ thuật thủy tinh hóa (8).
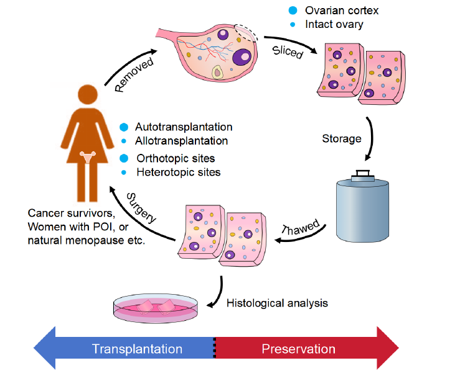
Về định nghĩa, đông lạnh mô buồng trứng là phẫu thuật cắt bỏ lớp vỏ buồng trứng chứa nang nguyên thủy, sau đó đông lạnh và bảo quản có kiểm soát với mục đích cấy ghép tự thân (hoặc sử dụng nang noãn phân lập) (6). Mục tiêu cuối cùng là khôi phục chức năng nội tiết tự nhiên của buồng trứng và khả năng sinh sản, giúp người phụ nữ có thể có kinh nguyệt trở lại và thậm chí là mang thai tự nhiên. Đây là định nghĩa OTC được trích dẫn nhiều nhất trong các hướng dẫn thực hành hiện đại.
Theo hướng dẫn thực hành gần nhất là ESHRE 2020 và ASCO 2025 đưa ra một số chỉ định OTC bao gồm những bệnh nhân không thể trì hoãn điều trị; bé gái trước tuổi dậy thì; những trường hợp đang điều trị bệnh có độc tính với tuyến sinh dục như lạc nội mạc tử cung nặng; bệnh nhân chuẩn bị ghép tế bào gốc tạo máu vì phải trải qua hóa trị liều cao gây suy buồng trứng (6,7). Ngoài ra, OTC cũng có thể chỉ định cho những bệnh nhân đang trong quá trình hóa trị các khối u ác tính vùng chậu, ung thư cổ tử cung biểu mô tế bào vảy; cũng như các trường hợp khác như rối loạn di truyền hoặc nhu cầu phục hồi chức năng nội tiết sau điều trị.
Quy trình xử lý mô hiện tại là mô buồng trứng được thu thập và vỏ buồng trứng được tách ra, xử lý và đông lạnh lại để bảo quản. Kích thước mảnh mô đông lạnh nên mỏng <2mm để tối ưu hóa sự khuếch tán chất bảo vệ lạnh (Cryoprotectant Agent - CPA). Phương pháp đông lạnh chậm (slow-freezing) đang là tiêu chuẩn vàng được sử dụng phổ biến trên toàn thế giới vì sử dụng nồng độ CPA thấp giúp giảm thiểu độc tính tiềm ẩn (9). Đối với phương pháp thủy tinh hóa (vitrification) thì số lượng ca sinh sống được báo cáo còn rất hạn chế và thiếu sự đồng thuận. Tính đến năm 2024, chỉ có khoảng 2 ca sinh sống sau bảo quản mô bằng thủy tinh hóa (7).
III. Kết quả đông lạnh mô buồng trứng
Khoảng 50% số mô đông lạnh sẽ được sử dụng trong lần cấy ghép đầu tiên với độ dày mảnh ghép khoảng 1mm (10). Vị trí ghép (cùng vị trí hoặc khác vị trí) tùy thuộc vào tình trạng bệnh lý, chỉ định và mục đích sử dụng của bệnh nhân. Trước tiên là hiệu quả trong việc phục hồi chức năng buồng trứng. Báo cáo trong các trường hợp thực hiện OTT có 95% đều khôi phục chức năng buồng trứng bình thường (FSH <25IU/L; LH <15IU/L; E2 tăng) (11). Trên hầu hết các báo cáo lớn từ Châu Âu, Úc và Bắc Mỹ trong 5 năm trở lại đây, tỉ lệ phục hồi chức năng buồng trứng sau OTT ổn định ở mức cao (12). Fabbri và cộng sự (2024) tại Bologna ghi nhận 92-94% hồi phục; mạng lưới FertiPROTEKT 2022 báo cáo 95%; kết quả nghiên cứu đoàn hệ ở Úc 2025 cũng tiệm cận 93% (11). Thời gian kinh nguyệt hoạt động lại là khoảng 18 tuần (3-6 tháng) (13). Chỉ số AMH thường biến thiên ít và không phải là dấu chỉ sinh học tin cậy của chức năng mảnh ghép. Cho đến nay, chỉ có khoảng <1% người cấy phép đến lần 3. Tỉ lệ thành công (thai lâm sàng và trẻ sinh sống) giảm đi đáng kể nếu lần cấy ghép đầu thất bại (14).
Khi đề cập đến tỉ lệ nang phát triển, báo cáo gần đây cho thấy có khoảng 7% nang bị mất sau đông lạnh, hơn 50% nang bị tổn hại sau cấy ghép vì thiếu máu cục bộ (13). Tỉ lệ nang nguyên thủy phát triển từ <20% đến trên 70% sau 7 ngày, 30 ngày và 60 ngày cấy ghép (15). Thời gian phát triển từ nang nguyên thủy đến nang thứ cấp (kích thước 21mm) là khoảng 4-6 tháng (15). Bên canh đó, khi phân tích mô học hình thái nang sau rã đông không ghi nhận khác biệt với mô tươi. Theo báo cáo gần đây (Fabbri và cộng sự 2024) cho thấy tỉ lệ nang có hình thái bình thường ở mô đông lạnh so với mô tươi tương đương nhau (83,5%±12,8% so với 91,6%±8,2%) (11).
Về sinh sản, tổng hợp đa trung tâm cho thấy đa số thai sau OTT là thai tự nhiên. Bằng chứng rõ ràng nhất là từ kết quả phân tích trên 58 nghiên cứu có 162 trẻ sinh (Ramirez và cộng sự 2024) thì tỉ lệ thai tự nhiên là 66,7% và thai thụ tinh trong ống nghiệm (in vitro fertilization – IVF) là khoảng 33,3% (13). FertiPROTEKT cũng khẳng định tỉ lệ tương tự (63% tự nhiên và 37% IVF); các trung tâm đơn lẻ khác cũng cho thấy thai tự nhiên nổi trội sau OTT cùng vị trí trong khi ghép dị vị ở bệnh nhân lớn tuổi hơn thường phải thực hiện IVF sau đó (14).
Nhìn chung, hiệu quả lâm sàng của OTC-OTT hiện đã được chứng minh ở nhiều quần thể khác nhau chứ không chỉ ở các báo cáo đơn trung tâm ban đầu. Tỉ lệ thành công chung khi có ít nhất một trẻ sinh sống trên mỗi bệnh nhân cấy ghép được dự đoán là khoảng 40% (16); tỉ lệ thai lâm sàng là 37% (95% KTC; 32-43%); tỉ lệ sảy thai 14% (95% KTC; 9-21%); tỉ lệ trẻ sinh sống 28% (95% KTC; 24-34%) (6). Báo cáo gần đây khi phân tích trên 170 trẻ sinh sau OTT tự thân thì 88,5% trường hợp đều sinh trẻ đúng tuổi thai và cân nặng bình thường (17).
Tuy nhiên, các nghiên cứu vẫn còn phân tán và rời rạc, cỡ mẫu tính trên báo cáo của từng trường hợp và chỉ công bố các kết quả thành công nên việc xử lý và phân tích chính xác các tỉ lệ này vẫn chưa thể kết luận. Thêm vào đó, tình trạng thiếu oxy cục bộ mà nang nguyên thủy sau cấy ghép bị mất đi rất nhiều khoảng 50-65% (10). Hiệu quả của OTC giảm dần ở thời điểm cấy ghép khi bệnh nhân >36 tuổi (14). Tỉ lệ thai sau lần đầu cấy ghép giảm đáng kể theo tuổi bệnh nhân tại thời điểm đông lạnh mô. Tỉ lệ trẻ sinh sống được báo cáo sau OTT dao động và không cao. Tỉ lệ quay trở lại sử dụng mô vẫn còn thấp chỉ khoảng 2,9-19% (6).
Bảng tóm tắt các kết quả OTC-OTT có liên quan đến độ tuổi, kỹ thuật và vị trí ghép (8,10,11,17).
|
Yếu tố |
Nhóm |
Phục hồi nội tiết |
Thai tự nhiên |
Thảo luận |
|
Tuổi tác |
<30 tuổi |
95-100% |
60-70% |
Kết quả tối ưu. |
|
30-35 tuổi |
90-95% |
40-55% |
Ưu tiên ghép cùng vị trí. |
|
|
>35-36 tuổi |
80-90% |
20-35% |
Tỉ lệ trẻ sinh sống giảm đáng kể. |
|
|
Kỹ thuật |
Đông lạnh chậm |
90-95% |
60-70% |
Tiêu chuẩn vàng. Nhiều ca sinh sống. |
|
Thủy tinh hóa |
Dữ liệu còn ít |
Ca sinh sống đầu tiên |
Cần thêm nhiều bằng chứng lâm sàng. |
|
|
Vị trí ghép |
Cùng vị trí |
90-95% |
>60% thai tự nhiên |
Nên lựa chọn nếu còn tử cung và vòi trứng. |
|
Khác vị trí |
85-90% |
Chủ yếu IVF |
Dễ theo dõi, thường chỉ định nếu vùng chậu khó. |
IV. Nguy cơ và hướng tiếp cận tương lai
Nguy cơ phổ biến của kỹ thuật này là tái phát tế bào ác tính, đây là rủi ro lý thuyết và lâm sàng nghiêm trọng nhất của OTT, đặc biệt đối với những bệnh nhân mắc ung thư máu (nguy cơ cao nhất là bạch cầu, u lympho), khả năng các tế bào ác tính xâm nhiễm vào mô buồng trứng (15). Vì vậy khuyến cáo hiện tại là nên đánh giá tế bào trước khi cấy ghép (6). Hiện nay, một số các phương pháp đã và đang được thử nghiệm để tránh sự tái phát này. Phương pháp nuôi trưởng thành noãn trích từ mô buồng trứng (Ovarian tissue oocyte - in vitro maturation – OTO-IVM) với mục đích tận dụng tối ưu mô buồng trứng để thu nhận và lựa chọn an toàn để tránh nguy cơ tái nhiễm tế bào ác tính khi cần IVF thay vì OTT (6). Mặc dù tỉ lệ trưởng thành noãn dao động 40-70%, dữ liệu lâm sàng về kết quả thai kỳ còn hạn chế nhưng IVM được xem là quy trình mang tính đổi mới, thuận tiện và an toàn (18). Ngoài ra, phương pháp hoạt hóa nang noãn (In vitro activation – IVA) dựa trên cơ chế phá vỡ đường truyền tín hiệu Hippo và kích hoạt Akt/PI3K được ứng dụng cho bệnh nhân suy buồng trứng sớm và đã có nhiều ca mang thai hoặc trẻ sinh sống được ghi nhận (12). Nuôi cấy nang noãn (In vitro growth – IVG) là phương pháp nuôi cấy nang noãn riêng lẻ in vitro để tránh nguy cơ tái nhiễm tế bào ác tính, đòi hỏi hệ thống nuôi cấy 3D phức tạp để mô phỏng môi trường tự nhiên (12). Tuy nhiên, chưa có trẻ sinh sống nào được ghi nhận từ noãn IVG.
Do đó, nhằm cải thiện hiệu quả của OTC-OTT cùng với các khuyến cáo liên quan thì một số hướng nghiên cứu đang được tiến hành. Việc cải tiến kỹ thuật như chuẩn hóa OTC bằng phương pháp thủy tinh hóa là cần thiết (7). Các đề xuất khác như lựa chọn cấy ghép toàn bộ buồng trứng thay vì cấy ghép một phần để giảm thiểu thiếu máu cục bộ; hoặc sử dụng robot hỗ trợ phẫu thuật và giàn giáo ngoại bào để kéo dài tuổi thọ mô ghép và đạt được sự phục hồi chức năng buồng trứng cao (6,7). Một số ví dụ khác như là đồng cấy ghép tế bào mô đệm trung mô (Mesenchymal Stem cells – MSCs) có nguồn gốc từ tủy xương hoặc mô mỡ cùng với mô vỏ buồng trứng được hỗ trợ bởi giàn giáo 3D giúp tăng cường tái tạo mạch máu, phản ứng miễn dịch, tái tạo mô và sửa chữa vết thương; từ đó tăng tỉ lệ sống sót của nang nguyên thủy trong mô hình ghép dị loài (10). Phương pháp Buồng trứng nhân tạo (Artificial Ovary – AO) sử dụng vật liệu hydrogel tự nhiên được quan sát thấy hỗ trợ hiệu quả sự phát triển nang người đã phân lập sau 1 tuần ghép dị loài (6). Ngoài ra, công nghệ Organ-on-a-chip (OOC) là thiết bị vi lỏng được thiết kế để tái tạo kiến trúc mô và mô phỏng điều kiện chất lỏng tương tự như trong cơ thể sống, đảm bảo bổ sung liên tục các chất dinh dưỡng và oxy giúp cải thiện sự phát triển nang noãn IVG (12).
IV. Kết luận
Tóm lại, đông lạnh mô buồng trứng là lựa chọn khả thi và hiệu quả cho bệnh nhân ung thư, đặc biệt là trẻ trước tuổi dậy thì. Kỹ thuật này có hiệu quả đáng kể về khả năng phục hồi chức năng buồng trứng và các báo cáo về ca sinh sống đang tăng dần trên toàn thế giới. Hơn nữa, nghiên cứu chuyển dịch về MSCs để tăng cường mạch máu hóa mô ghép và IVF để loại bỏ hoàn toàn nguy cơ tái phát tế bào ung thư đang được đẩy mạnh. Tuy nhiên, cần thêm nhiều dữ liệu về OTC bằng phương pháp thủy tinh hóa, kết quả theo dõi sức khỏe và sự phát triển của trẻ sinh sau cấy ghép mô.
Tài liệu tham khảo
-
McElhinney KL, Kennedy T, Rowell EE, và cs.; A dozen years of ovarian tissue cryopreservation at a pediatric hospital: tracking program and patient metrics while adapting to increasing needs; F S Rep; 2024; 5(2); 197–204.
-
Emrich NLA, Einenkel R, Färber CM, và cs.; Ovarian tissue cryopreservation for fertility preservation: a two-decade single-center experience with 451 children and adolescents; Reprod Biol Endocrinol; 2025; 23; 51.
-
Wu T, Zhao Y, Chen Y, và cs.; Global trends and collaboration in ovarian tissue transplantation: a 20-year bibliometric analysis; Reprod Fertil; 2025; 6(4); e250022.
-
Liebenthron J, Montag M, Reinsberg J, và cs.; Overnight ovarian tissue transportation for centralized cryobanking: a feasible option; Reprod Biomed Online; 2019; 38(5); 740–749.
-
Practice guidelines on ovarian tissue cryopreservation and transplantation in the prevention and treatment of iatrogenic premature ovarian insufficiency; Maturitas; 2024; 182; 107922.
-
ESHRE Guideline Group on Female Fertility Preservation; Anderson RA, Amant F, và cs.; ESHRE guideline: female fertility preservation. Hum Reprod Open; 2020; 2020(4); hoaa052.
-
Su HI, Lacchetti C, Letourneau J, và cs.; Fertility preservation in people with cancer: ASCO guideline update; J Clin Oncol; 2025; 43(12); 1488-1515.
-
Sänger N, John J, Einenkel R, và cs.; First successful delivery after retransplantation of vitrified, rapid-warmed ovarian tissue in Europe; Reprod Biomed Online; 2024; 49(1); 103940.
-
Thuwanut P, Leonel ECR, Rocha Ruiz TF, và cs.; Human ovarian tissue xenotransplantation: advancements, challenges, and future perspectives; Hum Reprod; 2025 Mar 1; 40(3); 410-419.
-
Zaninović L, Baškovic M, Ježek D, và cs.; Enhancement of vascularization and ovarian follicle survival using stem cells in cryopreserved ovarian tissue: a systematic review; Biology; 2024; 13; 342.
-
Fabbri R, Vicenti R, Macciocca M, và cs.; Ovarian tissue transplantation: ten years of experience at the University of Bologna; Front Endocrinol (Lausanne); 2024; 15; 1332673.
-
Malo C, Oliván S, Ochoa I, và cs.; In vitro growth of human follicles: current and future perspectives; Int J Mol Sci; 2024; 25(3); 1510.
-
Ramirez T, Pavone ME. Exploring the Frontiers of Ovarian Tissue Cryopreservation: A Review; J Clin Med; 2024; 13; 4513.
-
Lotz L, Bender LJ, Dittrich R, Häberle L, và cs.; FertiPROTEKT network. Determinants of transplantation success with cryopreserved ovarian tissue: data from 196 women; Hum Reprod; 2022; 37(12); 2787–2796.
-
Donnez J, Martinez-Madrid B, Jadoul P, và cs.; Ovarian tissue cryopreservation and transplantation: a review; Hum Reprod Update; 2006 Sep-Oct; 12(5); 519-35.
-
Finkelstein T, Rolnik DL, Agresta F, và cs.; Pregnancy outcomes following ovarian tissue cryopreservation: an Australian cohort study; Am J Obstet Gynecol; 2025; 233; 108.e1–108.e11.
-
Erden M, Uyanik E, Demeestere I, và cs.; Perinatal outcomes of pregnancies following autologous cryopreserved ovarian tissue transplantation: a systematic review with pooled analysis; Am J Obstet Gynecol; 2024; 231(5); 480–489.
-
De Roo C, Tilleman K. In Vitro Maturation of Oocytes Retrieved from Ovarian Tissue: Outcomes from Current Approaches and Future Perspectives. J Clin Med. 2021 Oct 13;10(20):4680. doi: 10.3390/jcm10204680.