CNSH. Lê Thị Quỳnh – IVFMD SIH – Bệnh viện Phụ sản Quốc tế Sài Gòn
TỔNG QUAN
Lạc nội mạc tử cung (LNMTC) là một tình trạng viêm mãn tính có liên quan đến hormone, đặc trưng bởi sự hiện diện của các mô tương tự như nội mạc tử cung (NMTC) ở bên ngoài buồng tử cung. Tình trạng này ảnh hưởng đến khoảng 1 trên 10 phụ nữ trong độ tuổi sinh sản và thường biểu hiện bằng những cơn đau vùng chậu dữ dội, mệt mỏi và nguy cơ vô sinh [1]. Trong giai đoạn vị thành niên, LNMTC không chỉ là một vấn đề phụ khoa mà còn là một gánh nặng tâm lý và xã hội, làm gián đoạn quá trình học tập và phát triển bản sắc cá nhân.
Song song với đó, các rối loạn hành vi ăn uống (Eating Disorders - ED) bao gồm chán ăn, cuồng ăn và rối loạn ăn không kiểm soát đang có xu hướng gia tăng mạnh mẽ ở thanh thiếu niên. Chán ăn được đặc trưng bởi việc hạn chế năng lượng nạp vào dẫn đến trọng lượng cơ thể thấp đáng kể, kèm theo nỗi sợ hãi mãnh liệt về việc tăng cân [2]. Cuồng ăn liên quan đến các đợt ăn không kiểm soát lặp đi lặp lại, sau đó là các hành vi đi kèm không phù hợp như nôn ói hoặc lạm dụng thuốc nhuận tràng. Rối loạn ăn không kiểm soát tương tự như cuồng ăn nhưng thiếu các hành vi đi kèm, thường dẫn đến tình trạng thừa cân và các biến chứng chuyển hóa [2].
Một trong những vấn đề nghiêm trọng nhất trong quản lý LNMTC ở thanh thiếu niên là sự chậm trễ trong chẩn đoán. Nghiên cứu tổng quan của Gayathri và cộng sự (2025) cho thấy thời gian trung bình từ khi xuất hiện triệu chứng đầu tiên đến khi có chẩn đoán xác định thường kéo dài từ 7 đến 10 năm, thậm chí lên đến 12 năm [3]. Sự chậm trễ này chủ yếu do hiện tượng "bình thường hóa" đau bụng kinh, khi mà những cơn đau dữ dội thường bị coi là một phần tất yếu của quá trình dậy thì [3].
Trong giai đoạn từ 2017 đến 2024, tỷ lệ chẩn đoán LNMTC hàng năm đã tăng 32%, từ 24,9 lên 32,8 trên 10.000 bệnh nhân [4]. Sự gia tăng này một phần phản ánh sự cải thiện trong nhận thức và công cụ chẩn đoán, nhưng cũng đặt ra câu hỏi về các yếu tố lối sống và môi trường, bao gồm cả thói quen ăn uống, có thể đang thúc đẩy sự tiến triển của bệnh.
Bài viết này tập trung phân tích mối liên hệ phức tạp giữa LNMTC và rối loạn ăn uống ở tuổi vị thành niên. Câu hỏi quan trọng được đặt ra là: Rối loạn ăn uống là hệ quả trực tiếp từ triệu chứng của LNMTC, hay bản thân các hành vi ăn uống bất thường là yếu tố nguy cơ làm thay đổi môi trường nội tiết và miễn dịch, từ đó thúc đẩy sự phát triển của các tổn thương lạc nội mạc? [3]. Việc làm rõ mối quan hệ này có ý nghĩa quan trọng trong việc xây dựng các phác đồ can thiệp, giúp cải thiện chất lượng cuộc sống và bảo vệ sức khỏe sinh sản cho bệnh nhân trẻ tuổi.
CƠ CHẾ LIÊN QUAN GIỮA RỐI LOẠN ĂN UỐNG VÀ LẠC NỘI MẠC TỬ CUNG
Vai trò của Estrogen
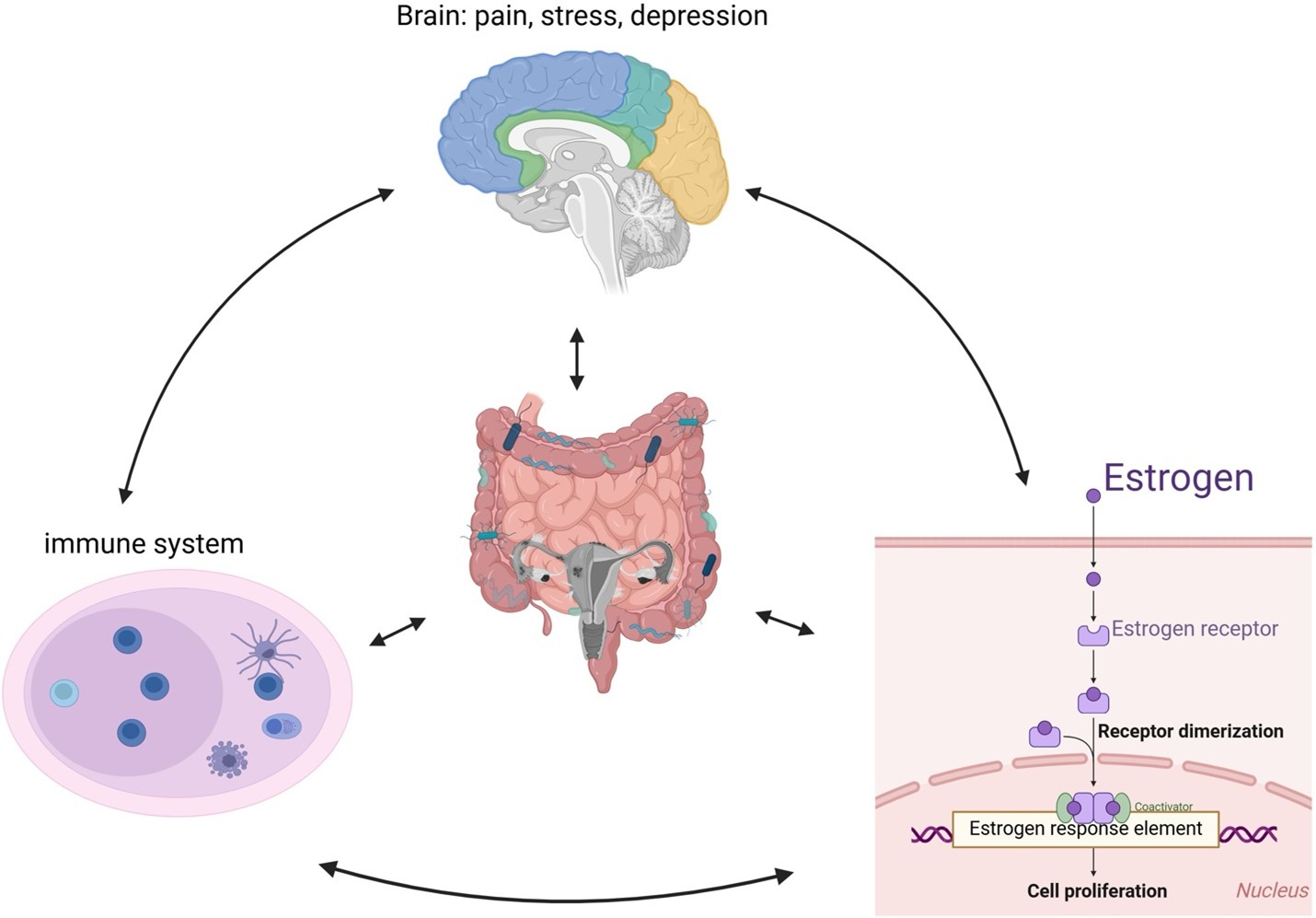
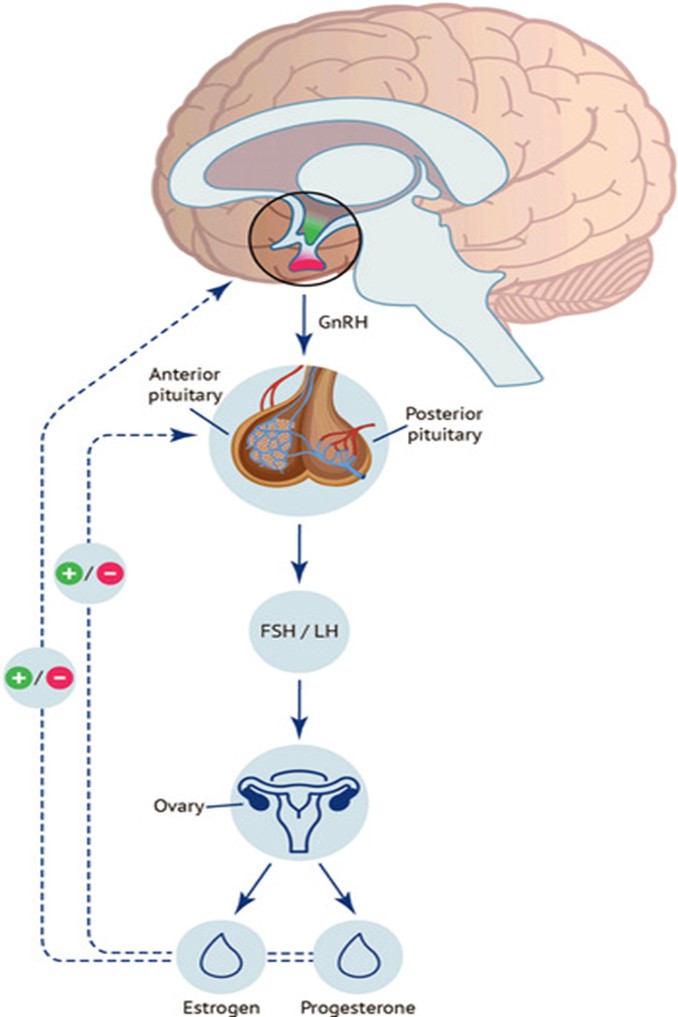
Estrogen đóng vai trò quan trọng trong việc thúc đẩy sự tăng sinh, xâm lấn và tồn tại của các tế bào NMTC bên ngoài tử cung [1]. Rối loạn ăn uống, đặc biệt là chán ăn, thường dẫn đến tình trạng vô kinh thứ phát do sự rối loạn của trục Hạ đồi - Tuyến yên - Buồng trứng [2].
Khi cơ thể thiếu hụt năng lượng nghiêm trọng, vùng hạ đồi giảm tiết hormone giải phóng gonadotropin (GnRH), dẫn đến giảm tiết FSH và LH từ tuyến yên [5]. Kết quả là nồng độ Estrogen trong máu sụt giảm mạnh, tạo ra một trạng thái "mãn kinh giả". Về mặt lý thuyết, mức Estrogen thấp có thể làm giảm các triệu chứng đau của LNMTC, tương tự như cơ chế của các thuốc ức chế GnRH thường dùng trong điều trị [6]. Tuy nhiên, sự sụt giảm này cũng đi kèm với những hệ lụy nghiêm trọng như loãng xương và rối loạn chuyển hóa, vốn đã là những nguy cơ ở bệnh nhân rối loạn ăn uống [6]. Bên cạnh đó, nồng độ Estrogen không ổn định do nhịn ăn và ăn bù có thể tạo ra các đợt viêm cấp tính [7].
Vai trò của Leptin và các Adipokine trong phản ứng viêm
Mô mỡ không chỉ là kho dự trữ năng lượng mà còn là một cơ quan nội tiết quan trọng tiết ra các adipokine, trong đó Leptin là hormone quan trọng điều hòa cơn đói và chuyển hóa năng lượng [8]. Ở những người có trọng lượng cơ thể ổn định, nồng độ Leptin tỷ lệ thuận với khối lượng mỡ cơ thể [9].
Ở bệnh nhân LNMTC, nồng độ Leptin được tìm thấy tăng cao đáng kể trong cả huyết thanh và dịch ổ bụng [8]. Leptin hoạt động như một chất trung gian gây viêm mạnh mẽ, kích thích sản sinh các cytokine tiền viêm như IL-6, IL-8 và TNF-α [8].
Đối với trẻ vị thành niên bị rối loạn ăn uống, sự biến động của nồng độ Leptin - sụt giảm khi nhịn ăn và tăng đột biến trong các đợt ăn không kiểm soát có thể làm rối loạn hệ thống miễn dịch [9]. Nghiên cứu trên mô hình chuột của Kim và cộng sự (2022) cho thấy thiếu hụt Leptin hoặc thụ thể Leptin thực sự làm ức chế sự phát triển của LNMTC [9]. Điều này gợi ý rằng ở bệnh nhân ED có BMI cực thấp, tình trạng thiếu hụt Leptin có thể tạm thời kìm hãm bệnh, nhưng sự mất cân bằng hormone này lại khiến cơ thể mất khả năng kiểm soát viêm khi bệnh nhân bắt đầu hồi phục cân nặng.
Mối liên hệ di truyền
Các bằng chứng từ nghiên cứu di truyền trong năm 2024 và 2025 đã làm sáng tỏ khả năng có chung nền tảng di truyền giữa LNMTC và rối loạn ăn uống [10].
Nghiên cứu liên kết di truyền của Dora và cộng sự (2023) thực hiện trên 8276 phụ nữ bị LNMTC so với 194.000 đối chứng đã phát hiện ra rằng LNMTC có mối tương quan thuận về mặt di truyền với rối loạn ăn uống. Điều này có nghĩa là những gen làm tăng nguy cơ mắc LNMTC cũng đồng thời làm tăng xu hướng mắc các rối loạn hành vi ăn uống [10]. Các locus gen cụ thể như DGKB (rs12666606) đã được xác định là có liên quan đến cả lạc nội mạc và trầm cảm, trong khi các vùng gen khác liên quan đến tín hiệu PI3K/AKT và thụ thể Estrogen cũng cho kết quả tương tự [11].
Hệ thống miễn dịch
Hệ vi sinh đường ruột có vai trò quan trọng trong việc điều hòa viêm hệ thống và chuyển hóa Estrogen. Trong LNMTC, các vi khuẩn đường ruột chịu trách nhiệm tiết enzyme β - glucuronidase, enzyme này giải phóng Estrogen về dạng hoạt động để tái hấp thu vào máu [12]. Khi hệ vi sinh bị rối loạn do hành vi ăn uống bất thường, quá trình này có thể bị đẩy mạnh dẫn tới trực tiếp kích thích sự phát triển của các tổn thương lạc nội mạc [13]. Bên cạnh đó, sự suy giảm các vi khuẩn sản xuất acid béo chuỗi ngắn như Lactobacillus và Actinobacteria ở bệnh nhân ED làm mất đi tác dụng bảo vệ chống viêm tự nhiên, tạo điều kiện cho các tổn thương LNMTC xâm lấn sâu hơn [12].
TÁC ĐỘNG HAI CHIỀU GIỮA LẠC NỘI MẠC TỬ CUNG VÀ RỐI LOẠN ĂN UỐNG
Rối loạn ăn uống dẫn đến nguy cơ lạc nội mạc tử cung
Mặc dù LNMTC có nguồn gốc từ các yếu tố di truyền, nhưng lối sống và dinh dưỡng đóng vai trò quan trọng trong việc "bật" hoặc "tắt" các phản ứng viêm liên quan. Bệnh nhân rối loạn ăn uống thường có chế độ ăn thiếu hụt các chất béo lành mạnh (như Omega-3 từ cá và các loại hạt) và thiếu chất xơ. Omega-3 có tác dụng ức chế sản sinh Prostaglandin loại 2 (gây đau và viêm), do đó việc thiếu hụt dưỡng chất này làm tăng cường phản ứng viêm toàn thân, khiến các tổn thương LNMTC dễ dàng bám dính và phát triển hơn [14].
Lạc nội mạc tử cung thúc đẩy rối loạn ăn uống
Ngược lại, LNMTC thường là yếu tố khởi phát cho các hành vi ăn uống bất thường. Tình trạng bụng chướng to do viêm và tích tụ khí trong ruột là một trải nghiệm không tốt cho trẻ vị thành niên. Khi thấy bụng mình to ra một cách bất thường mà không rõ nguyên nhân, nhiều trẻ có xu hướng nhịn ăn cực đoan vì nghĩ rằng mình đang bị béo phì hoặc tăng cân [2].
Hơn nữa, nhiều bệnh nhân nhận thấy một số loại thực phẩm làm trầm trọng thêm cơn đau hoặc tình trạng đầy hơi của họ [2]. Điều này dẫn đến sự hình thành "nỗi sợ thực phẩm", cách mà bệnh nhân tự hạn chế danh sách thực phẩm một cách khắt khe (ví dụ: cắt bỏ hoàn toàn gluten, sữa, đường, tinh bột) mà không có sự tư vấn y khoa. Sự hạn chế này dần dần tiến triển thành rối loạn ăn uống [2].
Tác động của thuốc điều trị nội tiết
Điều trị nội khoa cho LNMTC thường sử dụng các liệu pháp nội tiết như thuốc tránh thai kết hợp, Progestin hoặc các chất đối vận GnRH [15]. Một số tác dụng phụ phổ biến của các loại thuốc này bao gồm giữ nước, tăng cân, thay đổi tâm trạng và nổi mụn. Đối với thanh thiếu niên đang trong giai đoạn hình thành bản sắc và nhạy cảm với ngoại hình, những thay đổi này có thể ảnh hưởng rất lớn đối với chất lượng cuộc sống [16].
Nhiều bệnh nhân trẻ tuổi đã chia sẻ rằng họ thà chịu đựng cơn đau còn hơn phải đối mặt với việc tăng cân do thuốc. Phản ứng này có thể dẫn đến việc tự ý bỏ thuốc hoặc áp dụng các hành vi kiểm soát cân nặng nguy hiểm như tập thể dục quá độ hoặc dùng thuốc giảm cân, từ đó dẫn đến rối loạn ăn uống [16].
THÁCH THỨC VÀ GIẢI PHÁP CAN THIỆP ĐIỀU TRỊ Ở THANH THIẾU NIÊN
Rào cản tâm lý
Thanh thiếu niên thường gặp khó khăn trong việc mô tả cơn đau của mình. Nhiều trẻ cảm thấy xấu hổ khi nói về kinh nguyệt hoặc các hành vi ăn uống bất thường của mình [17]. Bên cạnh đó, việc đau bụng trong chu kỳ kinh nguyệt được coi là một phản ứng bình thường và là một phần của quá trình dậy thì.
Ngoài ra, các bác sĩ và cha mẹ đôi khi vô tình củng cố rào cản này bằng cách cho rằng cơn đau của trẻ là do "tâm lý" hoặc "muốn gây sự chú ý" [17]. Một khảo sát trực tuyến toàn quốc vào năm 2020 của Bontempo và cộng sự cho thấy gần một nửa số bệnh nhân LNMTC báo cáo rằng các nhà cung cấp dịch vụ y tế ban đầu đã kết luận các triệu chứng của họ là do vấn đề sức khỏe tâm thần trước khi đưa ra chẩn đoán chính xác [18]. Điều này tạo ra sự mất lòng tin vào hệ thống y tế, khiến trẻ vị thành niên càng thêm giấu diếm bệnh tật.
Những tiến bộ trong chẩn đoán không xâm lấn (2025)
Trong bối cảnh nội soi ổ bụng - "tiêu chuẩn vàng" để chẩn đoán LNMTC là một thủ thuật xâm lấn mà nhiều phụ huynh và bác sĩ e ngại thực hiện trên trẻ em, các đột phá công nghệ vào năm 2025 đã mang lại những giải pháp thay thế đầy hứa hẹn.
Xét nghiệm nước bọt Ziwig Endotest, sử dụng phân tích microRNA kết hợp với trí tuệ nhân tạo (Artificial Intelligence - AI), đã được chứng minh trong một nghiên cứu đa trung tâm trên 971 bệnh nhân là có độ chính xác lên đến 96,6% [19]. Phương pháp này phân tích 109 dấu hiệu microRNA đặc trưng cho LNMTC, cho phép chẩn đoán nhanh chóng mà không cần phẫu thuật. Việc áp dụng các xét nghiệm này cho thanh thiếu niên có nguy cơ cao (đặc biệt là những em có triệu chứng ED hoặc đau bụng không rõ nguyên nhân) có thể giúp rút ngắn thời gian chẩn đoán từ hàng năm xuống còn vài tuần, từ đó ngăn chặn các biến chứng lâu dài [19].
Chế độ ăn uống
Chế độ ăn được khuyến nghị cho bệnh nhân LNMTC bao gồm việc tăng cường rau xanh, trái cây có chỉ số đường huyết thấp, cá và các loại hạt giàu Omega-3. Tuy nhiên, đối với thanh thiếu niên đang hồi phục sau rối loạn ăn uống, việc áp dụng các chế độ ăn kiêng (như không gluten, không sữa) có thể sẽ tái diễn lại các hành vi ăn uống không kiểm soát.
Chiến lược dinh dưỡng an toàn nên tập trung vào việc bổ sung thêm các thực phẩm có lợi thay vì loại bỏ các nhóm thực phẩm. Các chất bổ sung như Magie (để giảm co thắt cơ), Vitamin D (để điều hòa miễn dịch) và kẽm cũng nên được cân nhắc để hỗ trợ cơ thể mà không cần thay đổi quá lớn cấu trúc bữa ăn của bệnh nhân [20].
Nâng cao nhận thức cho thanh thiếu niên và phụ huynh
Chương trình giáo dục cần được triển khai rộng rãi trong trường học để giúp học sinh nhận diện sớm các dấu hiệu của cả hai bệnh lý. Phụ huynh cần được trang bị kiến thức để không "bình thường hóa" những cơn đau bụng kinh dữ dội của con em mình và hiểu rằng sự thay đổi thói quen ăn uống của trẻ có thể là một tiếng chuông cảnh báo về sức khỏe phụ khoa [15].
KẾT LUẬN
Lạc nội mạc tử cung và rối loạn ăn uống ở tuổi vị thành niên không phải là hai bệnh lý riêng biệt mà là một quá trình tương tác sinh học và tâm lý phức tạp. Việc công nhận sự tồn tại của mối liên hệ này là bước đi đầu tiên và quan trọng nhất để cải thiện quy trình chẩn đoán và điều trị. Sự ra đời của các phương pháp chẩn đoán không xâm lấn như xét nghiệm microRNA nước bọt vào năm 2025 hứa hẹn sẽ mở ra một kỷ nguyên mới, nơi thanh thiếu niên có thể được bảo vệ khỏi những cơn đau đớn do LNMTC nhờ sự can thiệp sớm.
Từ khoá: lạc nội mạc tử cung, xét nghiệm microRNA nước bọt, rối loạn ăn uống, hệ vi sinh đường ruột.
Tài liệu tham khảo:
[1] Martire et al. (2025). Endometriosis and adenomyosis: From pathogenesis to follow-up. Current Issues in Molecular Biology, 47(5), 298. https://doi.org/10.3390/cimb47050298
[2] Panariello et al. (2023). Eating disorders and disturbed eating behaviors underlying body weight differences in patients affected by endometriosis: preliminary results from an Italian cross-sectional study. International Journal of Environmental Research and Public Health, 20(3), 1727.
[3] Delanerolle et al. (2025). Adolescent endometriosis: An overview of an overlooked condition (The ELEMI Programme). Preprints.org. https://doi.org/10.20944/preprints202507.2054.v1
[4] Bartelt et al. (2025). Endometriosis rates increasing across all ages, most common in women 35–49. Epic Research. https://www.epicresearch.org/articles/endometriosis-rates-increasing-across-all-ages-most-common-in-women-35-49
[5] Lord et al. (2024). Secondary amenorrhea. In StatPearls [Internet]. StatPearls Publishing.
[6] Villines, Z. (2025). Low estrogen: Causes, effects, and treatment options. Medical News Today. https://www.medicalnewstoday.com/articles/321064
[7] Vannuccini et al. (2022). Hormonal treatments for endometriosis: The endocrine background. Reviews in endocrine & metabolic disorders, 23(3), 333–355. https://doi.org/10.1007/s11154-021-09666-w
[8] Matarese et al. (2000). Increased leptin levels in serum and peritoneal fluid of patients with pelvic endometriosis. The Journal of clinical endocrinology and metabolism, 85(7), 2483–2487. https://doi.org/10.1210/jcem.85.7.6703
[9] Kim et al. (2022). Leptin Stimulates Endometriosis Development in Mouse Models. Biomedicines, 10(9), 2160. https://doi.org/10.3390/biomedicines10092160
[10] Koller et al. (2023). Epidemiologic and Genetic Associations of Endometriosis With Depression, Anxiety, and Eating Disorders. JAMA network open, 6(1), e2251214. https://doi.org/10.1001/jamanetworkopen.2022.51214
[11] Rostvall et al. (2025). Shared genetic architecture between endometriosis and psychiatric conditions may explain comorbidity. medRxiv. https://doi.org/10.1101/2025.10.22.25338556
[12] Qin et al. (2022). The gut microbiota and endometriosis: From pathogenesis to diagnosis and treatment. Frontiers in cellular and infection microbiology, 12, 1069557. https://doi.org/10.3389/fcimb.2022.1069557
[13] Yuanyue et al. (2025). Impact of gut microbiota on endometriosis: Linking physical injury to mental health. Frontiers in Cellular and Infection Microbiology, 15, 1526063. https://doi.org/10.3389/fcimb.2025.1526063
[14] Howell, K. (2023). Endometriosis diet: Foods to eat and avoid. Nurture Gynaecology. https://nurturegynaecology.com.au/endometriosis-diet-foods-to-eat-and-avoid/
[15] Panvino et al. (2025). Endometriosis in Adolescence: A Narrative Review of the Psychological and Clinical Implications. Diagnostics (Basel, Switzerland), 15(5), 548. https://doi.org/10.3390/diagnostics15050548
[16] De Sanctis et al. (2019). Long-term effects and significant Adverse Drug Reactions (ADRs) associated with the use of Gonadotropin-Releasing Hormone analogs (GnRHa) for central precocious puberty: a brief review of literature. Acta bio-medica : Atenei Parmensis, 90(3), 345–359. https://doi.org/10.23750/abm.v90i3.8736
[17] Delanerolle et al. (2025). Adolescent endometriosis: An overview of an overlooked condition (The ELEMI Programme). Preprints.org. https://doi.org/10.20944/preprints202507.2054.v1
[18] Bontempo et al. (2020). Patient perceptions of misdiagnosis of endometriosis: results from an online national survey. Diagnosis (Berlin, Germany), 7(2), 97–106. https://doi.org/10.1515/dx-2019-0020
[19] Taylor et al. (2024). A trial of relugolix combination therapy for endometriosis-associated pain. NEJM Evidence, 3(10), EVIDoa2400195. https://doi.org/10.1056/EVIDoa2400195
[20] Nap et al. (2022). Endometriosis and the effects of dietary interventions: what are we looking for?. Reproduction & fertility, 3(2), C14–C22. https://doi.org/10.1530/RAF-21-0110