ThS.BS Trần Huy Phan*, ThS.BS Phan Thị Thúy Vân*
*BM Phụ Sản, Khoa Y, Đại học Nguyễn Tất Thành
Tác giả liên lạc: Trần Huy Phan Email: huyphanyds@gmail.com SĐT: 0397759648
Từ khóa: Infertility, Oral antagonist, Elagolix
ĐẶT VẤN ĐỀ
Thụ tinh trong ống nghiệm (IVF) là một trong những thành tựu nổi bật nhất của ngành hỗ trợ sinh sản. Tại Việt Nam, gần 30 năm kể từ khi em bé thụ tinh trong ống nghiệm đầu tiên ra đời, đã có nhiều thay đổi về kỹ thuật cũng như phác đồ điều trị, tuy nhiên, IVF với kích thích buồng trứng có kiểm soát vẫn chiếm một vị trí hết sức quan trọng. Và một trong những bước quyết định cho sự thành công của quá trình này chính là ức chế đỉnh hormone luteinizing (LH).
Trong suốt nhiều thập kỷ, các chuyên gia không ngừng nỗ lực để tìm kiếm giải pháp ức chế đỉnh LH sao cho đảm bảo hiệu quả của kích thích buồng trứng, chất lượng của nội mạc tử cung, an toàn, ít xâm lấn và chi phí hợp lý, … Những thuốc đầu tiên được sử dụng để ức chế đỉnh LH là đồng vận hay đối vận với thụ thể hormone GnRH (GnRH agonist hoặc GnRH antagonist). GnRH agonist ức chế đỉnh LH thông qua cơ chế nội hóa các thụ thể GnRH tại tuyến yên, do đó làm giảm tiết hormone gonadotropin. Khi sử dụng GnRH agonist, gần như đỉnh LH sẽ không xuất hiện trong quá trình kích thích buồng trứng. Tuy nhiên, cần phải mất vài tuần để đạt được điều này do phản ứng dội trong giai đoạn đầu sau khi sử dụng dẫn đến việc sử dụng GnRH agonist làm tăng chi phí do phải dùng dài ngày và bệnh nhân cũng sẽ phải chịu nhiều mũi tiêm hơn. Từ đó, GnRH antagonist xuất hiện để khắc phục một số hạn chế của GnRH agonist: chỉ dùng thuốc trong những ngày có khả năng xảy ra đỉnh LH, có thể gây ức chế giải phóng gonadotropin tức thì, có thể đảo ngược và phụ thuộc vào liều lượng do cơ chế cạnh tranh các thụ thể GnRH tại tuyến yên [1]. Tuy nhiên, những đau đớn của bệnh nhân do việc phải tiêm thuốc nhiều ngày chính là nhược điểm cố hữu của hai thuốc này. Từ đó, các chuyên gia tiếp tục tìm kiếm các chất ức chế đỉnh LH khác, vừa đảm bảo hiệu quả vừa khắc phục được những nhược điểm của GnRH agonist và GnRH antagonist. Thuốc ức chế đỉnh LH đường uống ra đời.
Các thuốc ức chế đỉnh LH đường uống rất đa dạng. Đầu tiên phải kể đến loại thuốc phổ biến hiện nay là progestin (phác đồ PPOS-Progestin primed ovarian stimulation). Giống như progesterone nội sinh, progestin ức chế hạ đồi, từ đó sẽ ức chế đỉnh LH trong quá trình kích thích buồng trứng. Thuốc đầu tiên được sử dụng là Medroxyprogesterone acetate (MPA) đã cho kết quả ngoài mong đợi và dần dần phác đồ PPOS trở nên phổ biến. Hiện nay, các nhà lâm sàng còn sử dụng Dydrogesterone (Duphaston) cho phác đồ PPOS [2]. Ngoài phác đồ PPOS, các nhóm thuốc khác cũng được sử dụng để ức chế đỉnh LH như: chất điều hòa chọn lọc thụ thể progesterone (SPRM), chất điều hòa chọn lọc thụ thể estrogen (SERM). Với ưu thế ít xâm lấn, tiết kiệm, linh hoạt, … nhóm ức chế đỉnh LH đường uống đã khắc phục được những nhược điểm của GnRH agonist và GnRH antagonist đường tiêm cổ điển. Tuy nhiên, trở ngại của phác đồ PPOS là sẽ không thể chuyển phôi tươi vì nội mạc tử cung đã tiếp xúc với progestin sớm nên buộc phải đông lạnh phôi để chuyển phôi trữ sau đó. Để khắc phục nhược điểm của các thuốc ức chế đỉnh LH đường uống hiện tại và phát huy ưu điểm của GnRH antagonist đường tiêm cổ điển, các nhà nghiên cứu đã đặt nhiều kỳ vọng vào GnRH antagonist đường uống.
GnRH antagonist đường uống mang đầy đủ những ưu điểm của GnRH antagonist đường tiêm cổ điển so với GnRH agonist là ức chế đỉnh LH ngay lập tức và có thể đảo ngược tức thì mà không cần phải đợi kết thúc quá trình nội hóa thụ thể, do đó sẽ tiết kiệm chi phí và có thể sử dụng GnRH agonist để trigger nhằm giảm nguy cơ quá kích buồng trứng. Bên cạnh đó, GnRH antagonist đường uống đã giải quyết những đau đớn mà bệnh nhân phải chịu so với những thuốc đường tiêm, đồng thời cũng khắc phục những nhược điểm của các thuốc ức chế đỉnh LH đường uống trước đây: GnRH antagonist đường uống không tác động xấu lên nội mạc tử cung nên có thể chuyển phôi tươi khi cần thiết. Do đó, GnRH antagonist đường uống là thuốc rất hứa hẹn cho việc ức chế đỉnh LH khi kích thích buồng trứng [3].
CƠ CHẾ TÁC DỤNG
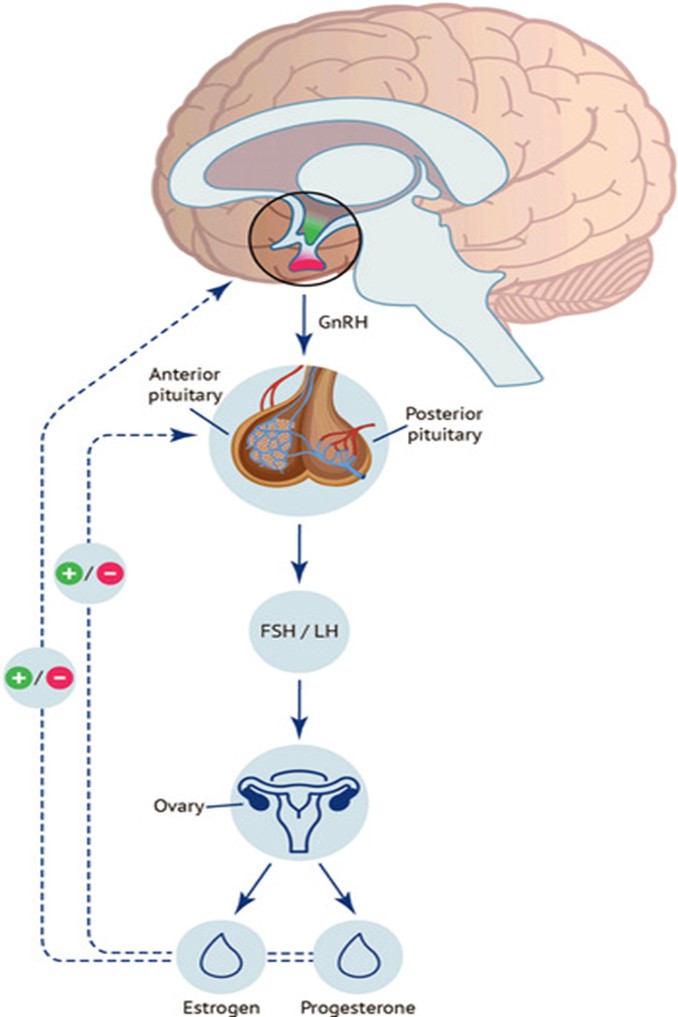
- antagonist đường uống hoạt động thông qua cơ chế cạnh tranh gắn với thụ thể GnRH tại tuyến yên, từ đó ngăn chặn hoàn toàn tín hiệu của GnRH nội sinh và làm suy giảm nhanh chóng sự phóng thích của hormone FSH và LH. Khi GnRH antagonist gắn vào thụ thể GnRH, con đường truyền tín hiệu G-protein không được kích hoạt, dẫn tới giảm phiên mã và tổng hợp các chuỗi β của LH và FSH, làm giảm mạnh nồng độ LH và FSH trong tuần hoàn [4].
- giống với GnRH agonist gây phản ứng dội ban đầu rồi mới tới giai đoạn ức chế, GnRH antagonist không kích hoạt thụ thể, do đó sẽ ức chế LH ngay lập tức-điều này đặc biệt quan trọng trong chu kỳ kích thích buồng trứng có kiểm soát vì giúp ngăn chặn đỉnh LH sớm-nguyên nhân chính làm rụng trứng trước thời điểm chọc hút [5].
- ra, GnRH antagonist đường uống thường có dược động học thuận lợi: hấp thu tốt qua đường tiêu hóa, khởi phát tác dụng và hồi phục chức năng tuyến yên sau khi ngưng thuốc tương đối nhanh. Điều này góp phần tạo nên sự linh hoạt trong điều chỉnh phác đồ kích thích buồng trứng, đặc biệt khi cần đồng bộ thời điểm trigger, giảm nguy cơ quá kích buồng trứng thông qua trigger bằng GnRH agonist, tối ưu hóa thời điểm trigger để thu được nhiều noãn trưởng thành [5].
- nghiên cứu dược lực học cho thấy mức độ ức chế gonadotropin phụ thuộc vào liều: ở liều thấp, thuốc ưu tiên ức chế LH hơn so với FSH (vì LH nhạy cảm hơn với tần số xung GnRH), trong khi tăng liều dần dẫn tới ức chế sâu cả LH và FSH. Tính chất này cho phép cá thể hóa phác đồ kích thích buồng trứng sao cho đạt được ức chế đủ để ngăn đỉnh LH nhưng không ảnh hưởng quá mức tới sự phát triển nang noãn và thu noãn [5]. GnRH antagonist đường uống cung cấp một chiến lược kiểm soát trục hạ đồi–tuyến yên–buồng trứng thông qua ức chế thụ thể GnRH, giúp ức chế nhanh và hiệu quả đỉnh LH, đồng thời đem lại ưu điểm về đường dùng thuận tiện và khả năng điều chỉnh linh hoạt trong lâm sàng hỗ trợ sinh sản.
CÁC CHẾ PHẨM GnRH ANTAGONIST ĐƯỜNG UỐNG
- vài năm gần đây, GnRH antagonist đường uống đã được phát triển và nghiên cứu nhiều trong kích thích buồng trứng. Một số chất nổi bật bao gồm: Elagolix, Relugolix, Linzagolix và SHR7280 (đang nghiên cứu).
- trước đây được sử dụng chủ yếu trong điều trị lạc nội mạc tử cung, nhưng gần đây cũng được thử nghiệm để ức chế đỉnh LH trong kích thích buồng trứng. Thuốc hấp thu nhanh qua đường tiêu hóa, đạt nồng độ đỉnh trong huyết tương trong vòng 30-60 phút, thời gian bán hủy dao động 4-6 giờ. Trong một nghiên cứu trên 269 bệnh nhân kích thích buồng trứng, 173 bệnh nhân được dùng Elagolix uống cách ngày và 96 bệnh nhân được tiêm Ganirelix/Cetrotide hàng ngày để ức chế đỉnh LH, khi so sánh kết quả cho thấy nồng độ LH và E2 trong máu trước khi uống và ngày sau khi dùng Elagolix hoặc Ganirelix/Cetrotide tương đương nhau. Khi so sánh kết quả chu kỳ thụ tinh ống nghiệm cho thấy số lượng noãn thu được, số lượng noãn trưởng thành, tỷ lệ thụ tinh, tỷ lệ phôi nang, tỷ lệ phôi nguyên bội và độ dày nội mạc tử cung tại thời điểm trigger tương đương nhau ở cả hai nhóm. Kết quả của nghiên cứu cho thấy GnRH antagonist đường uống có hiệu quả tương đương với GnRH antagonist đường tiêm nhưng rẻ hơn và ít xâm lấn hơn [6].
- được hấp thu nhanh qua đường tiêu hóa, với liều uống 40mg/ngày trước bữa sáng, thuốc đạt nồng độ tối đa trong máu sau 1,5-2 giờ và thời gian bán hủy 45 giờ. Trong một nghiên cứu tại Nhật Bản từ 3/2019 đến 1/2020 so sánh tỷ lệ rụng trứng khi dùng Relugolix 40mg/ngày với tiêm 0,25 mg Ganirelix acetate hoặc Cetrorelix acetate, thời điểm dùng GnRH antagonist trước khi LH tăng đột biến (<10 mIU/ml) cho thấy tỷ lệ rụng trứng ở cả 2 nhóm uống và tiêm đều rất thấp (p=0,838). Tuy nhiên khi dùng GnRH antagonist trong thời gian LH tăng đột biến (>10 mIU/ml), các chu kỳ sử dụng Relugolix ghi nhận tỷ lệ rụng trứng 40,9%, trong khi nhóm tiêm không có trường hợp rụng trứng nào (p = 0,002). Không có sự khác biệt đáng kể giữa hai nhóm về kết quả nuôi cấy phôi và các chỉ số thai kỳ. Điều này cho thấy Relugolix có tác dụng ức chế rụng trứng cao nhưng hiệu quả ức chế có thể bị giới hạn khi LH đã tăng [7]. Một nghiên cứu khác khi so sánh 125 chu kỳ dùng Relugolix và 658 chu kỳ dùng GnRH antagonist dạng tiêm cho thấy khi trigger bằng hCG hoặc dual-trigger số lượng nang noãn thu được tương tự ở 2 nhóm tuy nhiên khi trigger bằng GnRH agonist số noãn thu thấp hơn đáng kể ở nhóm dùng Relugolix, do đó cần thận trọng trong lựa chọn trigger khi dùng Relugolix [8].
- là GnRH antagonist đường uống tiềm năng khác, thuốc có dược động học ổn định, ít biến động, sinh khả dụng cao, thời gian bán hủy 14-15 giờ. Mặc dù các nghiên cứu lâm sàng trong kích thích buồng trứng còn hạn chế nhưng trong lĩnh vực điều trị u xơ tử cung/lạc nội mạc tử cung, Linzagolix đã cho thấy khả năng ức chế liều-phụ thuộc và kiểm soát hormone sinh dục khi dùng liều cao hoặc thấp, tùy thuộc mục tiêu điều trị. Liều 75 mg, uống một lần mỗi ngày, duy trì nồng độ E2 trong khoảng 20 đến 60 pg/mL, trong khi liều 200 mg, uống một lần mỗi ngày sẽ ức chế hoàn toàn nồng độ E2 (dưới 20 pg/mL) [9]. Tính linh hoạt về liều (từ ức chế một phần đến ức chế sâu) khiến Linzagolix là ứng viên hứa hẹn để cá thể hóa phác đồ kích thích buồng trứng, đặc biệt trong những trường hợp cần ức chế LH nhưng vẫn giữ được phát triển nang noãn.
- là một GnRH antagonist đường uống đang được nghiên cứu cho mục đích ức chế đỉnh LH trong kích thích buồng trứng. Mặc dù chưa có nhiều dữ liệu công bố rộng rãi, các thử nghiệm tiền lâm sàng giai đoạn 1, 2 cho thấy khả năng ức chế đỉnh LH hiệu quả. Thử nghiệm giai đoạn 2, nhãn mở, đa trung tâm để tìm liều lượng được tiến hành từ 26/01/2022 đến 03/08/2023 trên 85 phụ nữ vô sinh: liều khởi đầu của SHR7280 là 300 mg mỗi 12 giờ, sau đó thăm dò liều ở hai nhóm liều thấp hơn (200 mg mỗi 12 giờ và 200 mg mỗi 24 giờ) theo trình tự. Việc thăm dò liều sẽ dừng lại nếu xảy ra tăng đột biến LH. Trong 85 bệnh nhân có 40 người dùng 300mg mỗi 12 giờ, 42 người dùng 200mg mỗi 12 giờ và 3 người dùng 200mg mỗi 24 giờ, kết quả chỉ 1 bệnh nhân ở nhóm 200mg mỗi 24 giờ xuất hiện đỉnh LH sớm, tỷ lệ ức chế đỉnh LH đạt 98,8%, liều hiệu quả khuyến nghị là 200mg mỗi 12 giờ, thuốc được dung nạp tốt và an toàn. SHR7280 dạng uống là một lựa chọn đầy hứa hẹn cho bệnh nhân vô sinh cần kích thích buồng trứng trong hỗ trợ sinh sản [10].
SO SÁNH VỚI CÁC PHÁC ĐỒ HIỆN TẠI
Chưa có nhiều các nghiên cứu so sánh hiệu quả của GnRH antagonist đường uống so với các phác đồ hiện tại. Đa số các nghiên cứu được thực hiện để so sánh hiệu quả của GnRH antagonist đường uống với GnRH antagonist đường tiêm và thuốc được sử dụng trong các nghiên cứu này là Elagolix.
Năm 2025, Marco Mouanness và cộng sự đã thực hiện một nghiên cứu đoàn hệ trên 269 bệnh nhân kích thích buồng trứng với 173 mẫu sử dụng elagolix và 96 mẫu sử dụng ganirelix/cetrotide nhằm so sánh hiệu quả của Elagolix so với phác đồ GnRH antagonist chuẩn. Kết quả ghi nhận số trứng thu được, số trứng trưởng thành, tỷ lệ thụ tinh, tỷ lệ phôi nang, tỷ lệ phôi nguyên bội và bề dày nội mạc tử cung là tương đồng ở cả 2 nhóm (Bảng 1).
Bảng 1: So sánh kết quả chu kỳ IVF ở nhóm ganirelix/cetrotide và nhóm elagolix [6].
|
Đặc điểm so sánh |
Ganirelix/cetrotide (n=96) |
Elagolix (n=173) |
P |
|
Số trứng thu được |
5,2 ± 0,6 |
8,0 ± 0,7 |
0.10 |
|
Số trứng trưởng thành |
4,0 ± 0,5 |
5,8 ± 0,5 |
0.35 |
|
Tỷ lệ thụ tinh |
87,5% |
77,5% |
0.36 |
|
Tỷ lệ phôi nang |
56,0% |
58,6% |
0.42 |
|
Tỷ lệ phôi nguyên bội |
43,6% |
56,5% |
0.45 |
|
Bề dày nội mạc tử cung (mm) |
8,1 ± 0,3 |
7,8 ± 0,4 |
0.41 |
Trong một nghiên cứu đoàn hệ hồi cứu của David Soliman và cộng sự tại Canada năm 2024 trên 194 mẫu (71 mẫu ức chế đỉnh LH bằng Elagolix và 123 mẫu sử dụng Ganirelix) cho thấy: tỷ lệ hủy chu kỳ, tỷ lệ thai sinh hóa và tỷ lệ sẩy thai khác biệt không có ý nghĩa thống kê trong cả 2 nhóm, đặc biệt tỷ lệ làm tổ trên chu kỳ chuyển phôi trữ cao hơn ở nhóm sử dụng Elagolix trước đó (Bảng 2).
Bảng 2: So sánh các kết cục của COS khi sử dụng Elagolix và Ganirelix [11]
|
Đặc điểm so sánh |
Elagolix |
Ganirelix |
p |
|
Tỷ lệ hủy chu kỳ (%) |
7 |
4,9 |
0,5 |
|
Số trứng thu được (trung bình) |
12,7 |
12,4 |
0,9 |
|
Số trứng trưởng thành (trung bình) |
10,2 |
10,1 |
0,7 |
|
Số trứng thụ tinh (trung bình) |
8,6 |
8,2 |
0,9 |
|
% ISCI |
75,8 |
76,1 |
0,99 |
|
%IVF cổ điển |
24,2 |
23,9 |
0,99 |
|
Tỷ lệ thụ tinh |
84,4 |
81,1 |
0,07 |
|
Số phôi tạo ra (trung bình) |
5,2 |
5,2 |
0,6 |
|
Số phôi trữ (trung bình) |
4,9 |
4,5 |
0,5 |
|
Tỷ lệ làm tổ/chuyển phôi tươi |
33,3 |
37,5 |
0,8 |
|
Tỷ lệ làm tổ/chuyển phôi trữ |
74,5 |
55,9 |
0,02 |
|
Tỷ lệ thai diễn tiến/chuyển phôi tươi |
33,3 |
25 |
0,6 |
|
Tỷ lệ thai diễn tiến/chuyển phôi trữ |
51 |
40 |
0,2 |
|
Tỷ lệ sẩy thai/chuyển phôi tươi |
0,0 |
33,3 |
0,3 |
|
Tỷ lệ sẩy thai/chuyển phôi trữ |
<
|