Tin chuyên ngành
on Friday 20-11-2020 11:22am
Danh mục: Vô sinh & hỗ trợ sinh sản
CVPH_Trần Hà Lan Thanh - IVFMD Phú Nhuận
Lựa chọn phôi chuyển là một trong các bước quan trọng để có một chu kỳ TTTON thành công. Hiện nay có 2 xu hướng chuyển phôi dựa theo tuổi phôi là phôi ngày 3 hoặc phôi ngày 5. Mỗi xu hướng đều có ưu, nhược điểm riêng và hiệu quả của chuyển phôi ngày 3 hoặc ngày 5 là vấn đề được quan tâm nghiên cứu nhiều. Việc lựa chọn phôi ở giai đoạn nào để chuyển phụ thuộc vào từng trường hợp bệnh nhân cụ thể và chính sách sử dụng phôi của mỗi trung tâm TTTON.
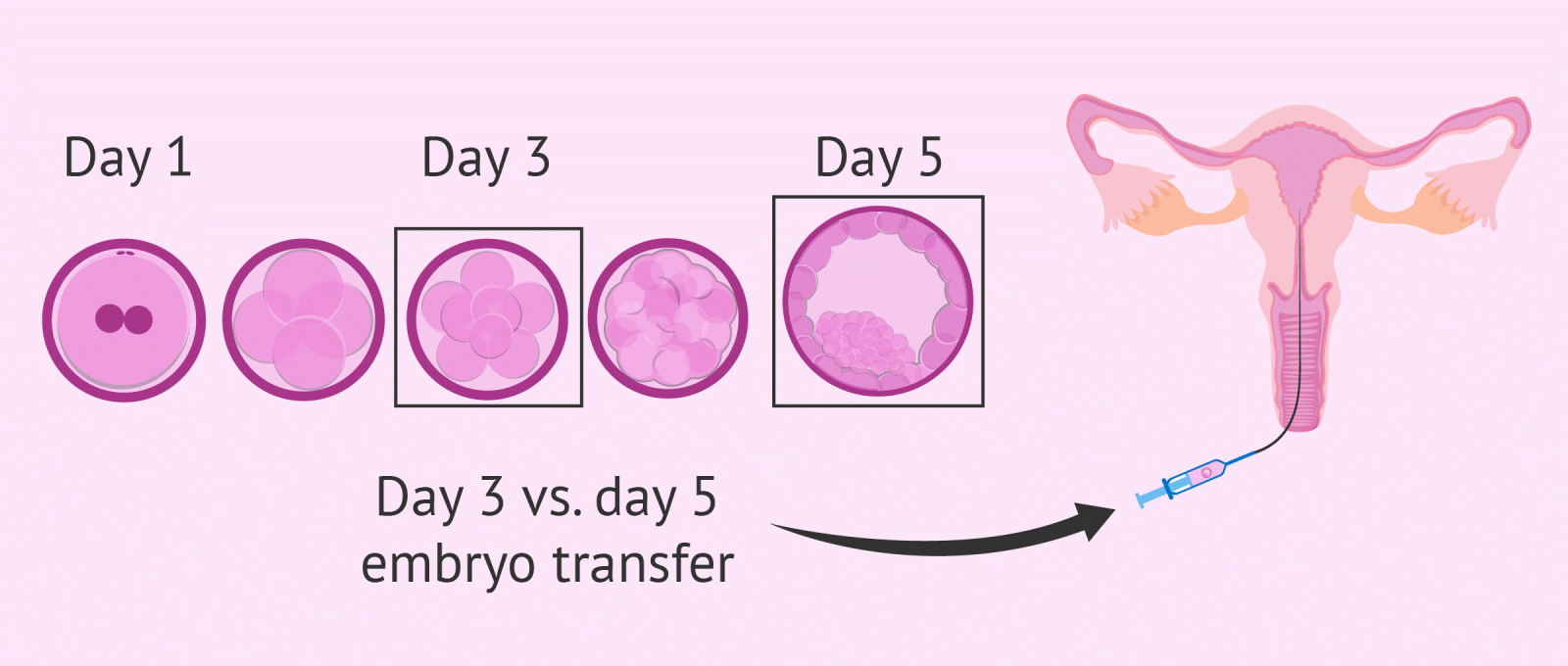
1. Sự phát triển của phôi
Sự phát triển của phôi trước khi làm tổ có thể chia làm 3 giai đoạn: (1) giai đoạn phôi phân chia, đặc trưng bằng sự phân chia đơn giản và liên tục của các phôi bào; (2) Giai đoạn phôi dâu, đặc trưng bằng sự kết khối và tăng mối liên kết thông tin giữa các phôi bào lân cận; (3) Giai đoạn hình thành phôi nang, đặc trưng bằng sự hình thành nang chứa dịch ở giữa phôi và sự biệt hoá của các tế bào.
Khoảng 24 giờ sau thụ tinh, hợp tử bắt đầu lần phân bào đầu tiên. Phân bào lần 2 diễn ra khoảng 40 giờ sau thụ tinh. Vào ngày thứ 3, phôi có khoảng 6-12 tế bào và vào ngày 4, phôi có từ 16-32 tế bào. Phôi dâu hình thành cuối giai đoạn nén. Lúc này, phôi dâu là một khối tế bào hình cầu. Sau đó, bên trong phôi dâu bắt đầu hình thành các khoang chứa dịch, lúc này phôi ở giai đoạn 16-32 tế bào. Khi khoang chứa dịch được hình thành, phôi bước vào giai đoạn phôi nang. Các khoang này phát triển nhanh và lớn dần tạo thành một khoang lớn giữa phôi. Còn ngoài cùng là một lớp tế bào dẹt, lớn gọi là lớp tế bào lá nuôi (Trophectoderm - TE) và tại một điểm ở mặt trong của lớp tế bào này có một khối tế bào riêng biệt, gọi là khối tế bào bên trong (Inner Cell Mass - ICM) của phôi nang. Vào thời điểm 5 ngày sau thụ tinh có số tế bào trong phôi đạt gần 100 tế bào.
2. Những điểm mạnh, điểm yếu của 2 xu hướng chuyển phôi theo tuổi phôi
Khoảng 24 giờ sau thụ tinh, hợp tử bắt đầu lần phân bào đầu tiên. Phân bào lần 2 diễn ra khoảng 40 giờ sau thụ tinh. Vào ngày thứ 3, phôi có khoảng 6-12 tế bào và vào ngày 4, phôi có từ 16-32 tế bào. Phôi dâu hình thành cuối giai đoạn nén. Lúc này, phôi dâu là một khối tế bào hình cầu. Sau đó, bên trong phôi dâu bắt đầu hình thành các khoang chứa dịch, lúc này phôi ở giai đoạn 16-32 tế bào. Khi khoang chứa dịch được hình thành, phôi bước vào giai đoạn phôi nang. Các khoang này phát triển nhanh và lớn dần tạo thành một khoang lớn giữa phôi. Còn ngoài cùng là một lớp tế bào dẹt, lớn gọi là lớp tế bào lá nuôi (Trophectoderm - TE) và tại một điểm ở mặt trong của lớp tế bào này có một khối tế bào riêng biệt, gọi là khối tế bào bên trong (Inner Cell Mass - ICM) của phôi nang. Vào thời điểm 5 ngày sau thụ tinh có số tế bào trong phôi đạt gần 100 tế bào.
2. Những điểm mạnh, điểm yếu của 2 xu hướng chuyển phôi theo tuổi phôi
Xu hướng chuyển phôi nang ở ngày 5 đang được các trung tâm IVF trên thế giới đẩy mạnh dựa trên một số ưu điểm. Thứ nhất, chuyển phôi ngày 5 tối ưu hóa sự đồng bộ giữa nội mạc tử cung và tuổi phôi. Thứ hai, biểu hiện gene ở phôi nang được hoàn thiện hơn, cho phép phôi tự sàng lọc và có tiềm năng làm tổ cao và giảm tỉ lệ phôi lệch bội hơn phôi giai đoạn phân chia ngày 3. Thứ ba, dữ liệu điều trị cho thấy chuyển phôi ngày 5 cho kết quả tốt hơn so với sử dụng phôi ngày 3 ở một số nhóm bệnh nhân [1][2]. Tuy vậy, nuôi cấy phôi dài ngày phát triển lên phôi nang cũng gặp nhiều bất lợi như: tăng nguy cơ không có phôi chuyển cho bệnh nhân, tăng áp lực công việc cho chuyên viên phôi học,…[3]. Đồng thời, việc nuôi phôi kéo dài ở điều kiện nhân tạo cũng có thể thay đổi biểu hiện gene (di truyền biểu sinh-epigenetic), tiềm ẩn nguy cơ tác động đến sức khoẻ lâu dài của trẻ [3]–[5].
Ngoài ra, chuyển phôi nang cũng có một số nguy cơ cao hơn so với chuyển phôi phân chia như sinh non, sinh đôi cùng hợp tử (MZT), mất cân bằng giới tính trẻ (tỉ lệ sinh bé trai cao hơn bé gái) [4]–[7]. Sinh đôi cùng hợp tử có nhiều nguy cơ ảnh hưởng đến sức khoẻ cả mẹ và trẻ hơn sinh đôi khác hợp tử và sinh đơn. Theo nghiên cứu của MacKenna và cộng sự (2020), tỉ lệ sinh đôi cùng hợp tử tăng đáng kể về mặt thống kê khi chuyển phôi nang so với phôi giai đoạn phân chia (lần lượt là 3,4% so với 2,0%; OR = 1,70, 95% CI 1,05-2,76) [6]. Ngoài ra, chuyển đơn phôi chọn lọc ngày 3 (eSET D3) hoặc ngày 5 (eSET D5) kết hợp với phôi được lựa chọn phôi bằng động học hình thái qua time lapse cho thấy không có sự khác biệt về kết cục thai (như tỉ lệ làm tổ, sẩy thai sớm, thai diễn tiến, trẻ sinh sống) và kết cục sản khoa sơ sinh (tỉ lệ sinh non, tuổi thai, cân nặng, chiều cao của trẻ lúc sinh). Tỉ lệ MZT ở nhóm eSET D5 cao hơn đáng kể so với eSET D3 (6.98% so với 0.00%; p<0.05) [8].
Mặt khác, nuôi cấy phôi dài ngày lên phôi nang ảnh hưởng nhiều bởi điều kiện nuôi cấy bên ngoài, do đó bệnh nhân có thể đối mặt với nguy cơ không có phôi cao hơn so với chuyển phôi ở giai đoạn sớm hơn. Theo phân tích tổng quan của ASRM, tỉ lệ không có phôi ngày 5 là 8.9% so với phôi ngày 3 là 2.8% (phân tích từ 16 RCTs, OR 2.85; 95% CI, 1.97–4.11), nhưng ở nhóm bệnh nhân tiên lượng tốt thì không khác biệt (phân tích số liệu từ 9 RCTs, OR 1.50; 95% CI, 0.79–2.84) [3]. Theo các số liệu đã được báo cáo năm 2011 thì tỉ lệ lên phôi nang ngày 5 là khoảng 35-45% [9]. Chính vì vậy, việc nuôi cấy phôi dài ngày chỉ nên được thực hiện khi labo IVF có hệ thống nuôi cấy phôi ổn định.
3. Hiệu quả của chuyển phôi ngày 3 hoặc ngày 5
Ngoài ra, chuyển phôi nang cũng có một số nguy cơ cao hơn so với chuyển phôi phân chia như sinh non, sinh đôi cùng hợp tử (MZT), mất cân bằng giới tính trẻ (tỉ lệ sinh bé trai cao hơn bé gái) [4]–[7]. Sinh đôi cùng hợp tử có nhiều nguy cơ ảnh hưởng đến sức khoẻ cả mẹ và trẻ hơn sinh đôi khác hợp tử và sinh đơn. Theo nghiên cứu của MacKenna và cộng sự (2020), tỉ lệ sinh đôi cùng hợp tử tăng đáng kể về mặt thống kê khi chuyển phôi nang so với phôi giai đoạn phân chia (lần lượt là 3,4% so với 2,0%; OR = 1,70, 95% CI 1,05-2,76) [6]. Ngoài ra, chuyển đơn phôi chọn lọc ngày 3 (eSET D3) hoặc ngày 5 (eSET D5) kết hợp với phôi được lựa chọn phôi bằng động học hình thái qua time lapse cho thấy không có sự khác biệt về kết cục thai (như tỉ lệ làm tổ, sẩy thai sớm, thai diễn tiến, trẻ sinh sống) và kết cục sản khoa sơ sinh (tỉ lệ sinh non, tuổi thai, cân nặng, chiều cao của trẻ lúc sinh). Tỉ lệ MZT ở nhóm eSET D5 cao hơn đáng kể so với eSET D3 (6.98% so với 0.00%; p<0.05) [8].
Mặt khác, nuôi cấy phôi dài ngày lên phôi nang ảnh hưởng nhiều bởi điều kiện nuôi cấy bên ngoài, do đó bệnh nhân có thể đối mặt với nguy cơ không có phôi cao hơn so với chuyển phôi ở giai đoạn sớm hơn. Theo phân tích tổng quan của ASRM, tỉ lệ không có phôi ngày 5 là 8.9% so với phôi ngày 3 là 2.8% (phân tích từ 16 RCTs, OR 2.85; 95% CI, 1.97–4.11), nhưng ở nhóm bệnh nhân tiên lượng tốt thì không khác biệt (phân tích số liệu từ 9 RCTs, OR 1.50; 95% CI, 0.79–2.84) [3]. Theo các số liệu đã được báo cáo năm 2011 thì tỉ lệ lên phôi nang ngày 5 là khoảng 35-45% [9]. Chính vì vậy, việc nuôi cấy phôi dài ngày chỉ nên được thực hiện khi labo IVF có hệ thống nuôi cấy phôi ổn định.
3. Hiệu quả của chuyển phôi ngày 3 hoặc ngày 5
Theo số liệu ghi nhận Cochrane so sánh hiệu quả chuyển phôi ngày 3 và ngày 5, tỉ lệ sinh sống/ lần chuyển phôi tươi lần đầu tiên của ngày 5 cao hơn ngày 3, nhưng tỉ lệ trẻ sinh sống cộng dồn lại cao hơn ở phôi ngày 3 [10]. Tỉ lệ này gợi lên câu hỏi liệu tỉ lệ thai tăng có phải là dấu hiệu dự đoán tăng nguy cơ sẩy thai khi chuyển phôi phân chia mà những phôi này không thể phát triển được tới giai đoạn phôi nang trong in vitro. Còn kết quả của nghiên cứu tổng quan hệ thống từ 10 RCT cho thấy tỉ lệ trẻ sinh sống, thai lâm sàng, sẩy thai không có sự khác biệt giữa chuyển phôi nang với phôi giai đoạn phân chia [2]. Nghiên cứu tổng quan hệ thống trên Cochrane (2016) phân tích 27 RCT gồm 4031 bệnh nhân nhằm đánh giá chuyển phôi nang (ngày 5 hoặc 6) có cải thiện các kết cục lâm sàng khi so với chuyển phôi giai đoạn phân chia (phôi ngày 2 hoặc 3). Kết quả thu được là tỉ lệ thai lâm sàng, trẻ sinh sống ở nhóm chuyển phôi nang cao hơn đáng kể. Trong khi đó, tỉ lệ đa thai, thai cộng dồn không khác biệt giữa 2 nhóm. Tuy nhiên, chất lượng chứng cứ còn ở mức thấp hoặc rất thấp nên cần có nhiều nghiên cứu hơn để khẳng định hiệu quả của chuyển phôi nang [1]. Nghiên cứu hồi cứu năm 2019, cho thấy lần chuyển phôi thứ nhất tỉ lệ trẻ sinh sống ở nhóm chuyển phôi nang cao hơn đáng kể so với phôi phân chia, nhưng không có sự khác biệt về tỉ lệ trẻ sinh sống cộng dồn. Chuyển phôi nang tăng nguy cơ sinh non đơn thai (32-37 tuần) hơn chuyển phôi giai đoạn phân chia. Tuy nhiên, không có sự khác biệt giữa nguy cơ sinh quá non (<32 tuần), trẻ nhẹ cân (1500-2500 gam) và rất nhẹ cân (< 1500 gam) giữa 2 nhóm [11]. Bên cạnh đó, chuyển phôi nang còn cho tỉ lệ sinh non và nguy cơ dị tật bẩm sinh cao hơn phôi phân chia [12].
Bài tổng quan hệ thống năm 2016 đã đề cập đến kết cục sản khoa và chu sinh sau chuyển phôi nang so với chuyển phôi phân chia. Chuyển giai đoạn phôi nang có liên quan đến tăng nguy cơ sinh non (<37 tuần), sinh rất non (<32 tuần), thai lớn so với tuổi thai (LGA) và tử vong sơ sinh, mặc dù phát hiện này chỉ được xác định từ một nghiên cứu. Ngược lại, chuyển giai đoạn phôi nang có liên quan đến giảm nguy cơ trẻ nhỏ so với tuổi thai và hiện tượng mất thai trong song thai, mặc dù trường hợp này chỉ được một nghiên cứu báo cáo. Bản chất quan sát của các nghiên cứu được đưa vào và một số điểm không nhất quán và thiếu chính xác trong phân tích đã làm giảm chất lượng bằng chứng [13].
Nghiên cứu phân tích từ 3 nghiên cứu RCT đã cho thấy cân nặng của trẻ sinh đơn của chuyển đơn phôi giai đoạn phân chia không có sự khác biệt đáng kể so với phôi nang, ngay cả khi đã phân tích hồi quy đa biến các biến từ mẹ và trẻ sơ sinh. Tương tự, tuổi thai lúc sinh không có sự khác biệt đáng kể giữa 2 nhóm. Một hạn chế của nghiên cứu là dữ liệu phân tích đã lâu từ những năm 2004-2006. Cần có những nghiên cứu phân tích hệ thống so sánh kết cục chu sinh của chu kỳ chuyển đơn phôi nang với phân giai chia [14].
4. Kết luận
Bài tổng quan hệ thống năm 2016 đã đề cập đến kết cục sản khoa và chu sinh sau chuyển phôi nang so với chuyển phôi phân chia. Chuyển giai đoạn phôi nang có liên quan đến tăng nguy cơ sinh non (<37 tuần), sinh rất non (<32 tuần), thai lớn so với tuổi thai (LGA) và tử vong sơ sinh, mặc dù phát hiện này chỉ được xác định từ một nghiên cứu. Ngược lại, chuyển giai đoạn phôi nang có liên quan đến giảm nguy cơ trẻ nhỏ so với tuổi thai và hiện tượng mất thai trong song thai, mặc dù trường hợp này chỉ được một nghiên cứu báo cáo. Bản chất quan sát của các nghiên cứu được đưa vào và một số điểm không nhất quán và thiếu chính xác trong phân tích đã làm giảm chất lượng bằng chứng [13].
Nghiên cứu phân tích từ 3 nghiên cứu RCT đã cho thấy cân nặng của trẻ sinh đơn của chuyển đơn phôi giai đoạn phân chia không có sự khác biệt đáng kể so với phôi nang, ngay cả khi đã phân tích hồi quy đa biến các biến từ mẹ và trẻ sơ sinh. Tương tự, tuổi thai lúc sinh không có sự khác biệt đáng kể giữa 2 nhóm. Một hạn chế của nghiên cứu là dữ liệu phân tích đã lâu từ những năm 2004-2006. Cần có những nghiên cứu phân tích hệ thống so sánh kết cục chu sinh của chu kỳ chuyển đơn phôi nang với phân giai chia [14].
4. Kết luận
Mỗi xu hướng đều có ưu, nhược điểm riêng và hiệu quả của chuyển phôi ngày 3 hoặc ngày 5 là vấn đề được quan tâm nghiên cứu nhiều. Nuôi cấy phôi đến ngày 5 chỉ nên được thực hiện khi labo IVF có hệ thống nuôi cấy phôi ổn định và cần cân nhắc giữa lợi ích và nguy cơ có thể phát sinh trong quá trình nuôi cấy phôi dài ngày. Việc lựa chọn phôi ở giai đoạn nào để chuyển phụ thuộc vào từng trường hợp bệnh nhân cụ thể và chính sách sử dụng phôi của mỗi trung tâm TTTON cũng như điều kiện hệ thống nuôi cấy của labo IVF.
Hơn nữa, các bằng chứng cho tới nay để khẳng định hiệu quả của việc chuyển phôi ngày 5 còn ở mức thấp hoặc rất thấp và còn nhiều tranh cãi nên cần có nhiều nghiên cứu hơn [1].
Tài liệu tham khảo
[1] D. Glujovsky et al., “Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology ( Review ),” Cochrane Database Syst Rev, 2016.
[2] W. P. Martins et al., “Blastocyst vs cleavage-stage embryo transfer: systematic review and meta-analysis of reproductive outcomes,” Ultrasound Obstet. Gynecol., vol. 49, no. 5, pp. 583–591, May 2017.
[3] ASRM , “Blastocyst culture and transfer in clinical-assisted reproduction: A committee opinion,” Fertil. Steril., 2013.
[4] D. Glujovsky and C. Farquhar, “Cleavage-stage or blastocyst transfer : what are the benefits and harm?,” Fertil. Steril., 2016.
[5] A. Maheshwari et al., “Should we be promoting embryo transfer at blastocyst stage ?,” Reprod. Biomed. Online, 2016.
[6] A. Mackenna et al., “Factors associated with embryo splitting and clinical outcome of monozygotic twins in pregnancies after IVF and ICSI,” Hum. Reprod. Open, 2020.
[7] A. Busnelli et al., “Risk factors for monozygotic twinning after in vitro fertilization: a systematic review and meta-analysis,” Fertil. Steril., v 2019.
[8] S. Wang et al., “Comparison of the pregnancy and obstetric outcomes between single cleavage-stage embryo transfer and single blastocyst transfer by time-lapse selection of embryos,” Gynecol. Endocrinol., 2019.
[9] S. J. Sepúlveda et al., “Extended culture up to the blastocyst stage: A strategy to avoid multiple pregnancies in assisted reproductive technologies,” Biol. Res., 2011.
[10] M. I. Cedars, “Fresh versus frozen: initial transfer or cumulative cycle results: how do we interpret results and design studies?,” Fertil. Steril., 2016.
[11] Q. Zhu et al., “Live birth rate and neonatal outcome following cleavage-stage embryo transfer versus blastocyst transfer using the freeze-all strategy,” Reprod. Biomed. Online, 2019.
[12] S. Dar et al., “Neonatal outcomes among singleton births after blastocyst versus cleavage stage embryo transfer : a systematic review and meta-analysis,” Hum. Reprod. Update, 2014.
[13] W. P. Martins et al., “Obstetrical and perinatal outcomes following blastocyst transfer compared to cleavage transfer: A systematic review and meta-analysis,” Hum. Reprod., 2016.
[14] A. De Vos et al., “Birthweight of singletons born after blastocyst-stage or cleavage-stage transfer: analysis of a data set from three randomized controlled trials,” J. Assist. Reprod. Genet., 2020.
Hơn nữa, các bằng chứng cho tới nay để khẳng định hiệu quả của việc chuyển phôi ngày 5 còn ở mức thấp hoặc rất thấp và còn nhiều tranh cãi nên cần có nhiều nghiên cứu hơn [1].
Tài liệu tham khảo
[1] D. Glujovsky et al., “Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology ( Review ),” Cochrane Database Syst Rev, 2016.
[2] W. P. Martins et al., “Blastocyst vs cleavage-stage embryo transfer: systematic review and meta-analysis of reproductive outcomes,” Ultrasound Obstet. Gynecol., vol. 49, no. 5, pp. 583–591, May 2017.
[3] ASRM , “Blastocyst culture and transfer in clinical-assisted reproduction: A committee opinion,” Fertil. Steril., 2013.
[4] D. Glujovsky and C. Farquhar, “Cleavage-stage or blastocyst transfer : what are the benefits and harm?,” Fertil. Steril., 2016.
[5] A. Maheshwari et al., “Should we be promoting embryo transfer at blastocyst stage ?,” Reprod. Biomed. Online, 2016.
[6] A. Mackenna et al., “Factors associated with embryo splitting and clinical outcome of monozygotic twins in pregnancies after IVF and ICSI,” Hum. Reprod. Open, 2020.
[7] A. Busnelli et al., “Risk factors for monozygotic twinning after in vitro fertilization: a systematic review and meta-analysis,” Fertil. Steril., v 2019.
[8] S. Wang et al., “Comparison of the pregnancy and obstetric outcomes between single cleavage-stage embryo transfer and single blastocyst transfer by time-lapse selection of embryos,” Gynecol. Endocrinol., 2019.
[9] S. J. Sepúlveda et al., “Extended culture up to the blastocyst stage: A strategy to avoid multiple pregnancies in assisted reproductive technologies,” Biol. Res., 2011.
[10] M. I. Cedars, “Fresh versus frozen: initial transfer or cumulative cycle results: how do we interpret results and design studies?,” Fertil. Steril., 2016.
[11] Q. Zhu et al., “Live birth rate and neonatal outcome following cleavage-stage embryo transfer versus blastocyst transfer using the freeze-all strategy,” Reprod. Biomed. Online, 2019.
[12] S. Dar et al., “Neonatal outcomes among singleton births after blastocyst versus cleavage stage embryo transfer : a systematic review and meta-analysis,” Hum. Reprod. Update, 2014.
[13] W. P. Martins et al., “Obstetrical and perinatal outcomes following blastocyst transfer compared to cleavage transfer: A systematic review and meta-analysis,” Hum. Reprod., 2016.
[14] A. De Vos et al., “Birthweight of singletons born after blastocyst-stage or cleavage-stage transfer: analysis of a data set from three randomized controlled trials,” J. Assist. Reprod. Genet., 2020.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
Năm 2020
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Năm 2020
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
GIỚI THIỆU SÁCH MỚI
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...
FACEBOOK








