.jpg)
BS. Âu Nhựt Luân
ĐẶT VẤN ĐỀ
Kể từ khi GnRH đối vận (GnRH-anta) được sử dụng trong các chu kỳ kích thích buồng trứng cho IVF và kể từ khi hCG được xác định là điều kiện đủ để gây ra quá kích buồng trứng (OHSS), GnRH đồng vận (GnRH-a) đã được dùng để khởi động trưởng thành cuối cùng của noãn bào trong chu kỳ IVF sử dụng GnRH-anta nhằm mục đích loại trừ hoàn toàn OHSS. Những kỳ vọng đặt ra cho kiểu khởi động trưởng thành cuối cùng của noãn bào này là tạo ra một đỉnh gonadotrophin gần với sinh lý hơn, loại trừ được OHSS, và thân thiện với bệnh nhân hơn. Tuy nhiên, ngay từ những ngày đầu tiên, một RCT nghiên cứu việc khởi động trưởng thành cuối cùng của noãn bào sử dụng GnRH-a trên chu kỳ kích thích buồng trứng IVF có dùng GnRH-anta đã phải bỏ dở do tỉ lệ thai lâm sàng quá thấp đến mức không thể chấp nhận được. Nhiều lý giải đã được đưa ra, và dần dần được chứng minh. Vấn đề quan trọng nhất của khởi động trưởng thành cuối cùng của noãn bào sử dụng GnRH-a trên chu kỳ kích thích buồng trứng IVF dùng GnRH-anta là tình trạng tiêu hủy hoàng thể sớm và bất hồi phục, dẫn đến kết cục xấu của các chu kỳ IVF với chuyển phôi tươi. Tuy nhiên, do có khả năng loại trừ hoàn toàn OHSS, nên đã có rất nhiều nỗ lực đã được thực hiện nhằm giải quyết vấn đề cốt lõi này, đưa khởi động trưởng thành cuối cùng của noãn bào dùng GnRH-a trên chu kỳ IVF dùng GnRH-anta thành một phác đồ thường qui ở các đối tượng với nguy cơ cao.
TỔNG QUAN VỀ KHỞI ĐỘNG TRƯỞNG THÀNH CUỐI CÙNG CỦA NOÃN BÀO SỬ DỤNG GnRH-a
Trong chu kỳ kích thích buồng trứng IVF sử dụng GnRH-anta để ngăn đỉnh LH sớm, khi ta dùng GnRH-a để tạo ra một đỉnh gonadotropin nội sinh, GnRH-a sẽ dời chỗ GnRH-anta ra khỏi thụ thể của GnRH. Sự chiếm đoạt thụ thể này của GnRH-a từ GnRH-anta sẽ gây nên hiệu ứng flare up, với một đỉnh gonadotropin nội sinh. Kỳ thực, đỉnh gonadotropin nội sinh gây bởi một bolus GnRH-a không hoàn toàn giống với đỉnh gonadotropin trong chu kỳ tự nhiên. Đỉnh LH tạo bởi GnRH-a chỉ có 2 pha và kéo dài khoảng 20 giờ, với sự tăng cao nhanh chóng của cả 2 loại gonadotropin là LH và FSH. Trong khi đó, đỉnh gonadotropin sinh lý của chu kỳ tự nhiên dài hơn, và có 3 pha. Cả 2 đỉnh này có một khác biệt quan trọng so với khởi động bằng hCG là sự hiện diện của đỉnh FSH, một thành tố quan trọng được cho rằng có nhiều ảnh hưởng trên nhân tế bào cũng như trên khối tế bào hạt thông qua tạo lập thụ thể LH (Hình 1) .
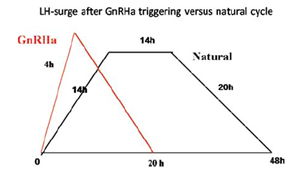
Hình 1: Diễn biến nồng độ Gonadotropin nội sinh trong chu kỳ tự nhiên và sau khởi động với GnRH-a. Ghi nhận dạng 2 pha sau GnRH-a.
Ngoài ra, khi khởi động trưởng thành noãn bào bằng đỉnh gonadotropin nội sinh, người ta tránh được việc phải dùng hCG. Không dùng hCG đồng nghĩa với loại bỏ điều kiện đủ để xảy ra quá kích buồng trứng, từ đó cho phép loại trừ hoàn toàn OHSS (Biểu đồ rừng 1).
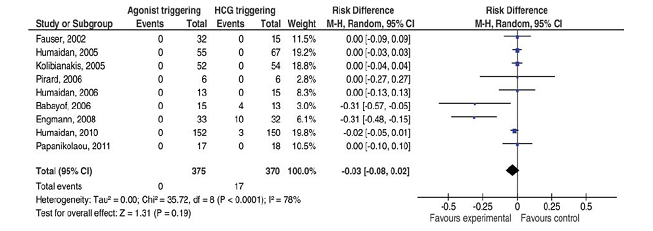
Biểu đồ rừng 1: OHSS và cách khởi động trưởng thành noãn.
P. Humaidan, S. Kol, EG Papanikolaou, Hum Reprod Update, Vol.17, No.4 pp. S10-S24, 2011
Trong biểu đồ rừng trên, ta thấy rõ sự khác biệt về tần suất xảy ra OHSS khi thực hiện khởi động trưởng thành cuối cùng của noãn bào bằng hCG và GnRH-a. Một quan sát tương tự, thực hiện trên các chu kỳ cho-nhận noãn cho thấy rõ sự vắng mặt hoàn toàn của OHSS khi khởi động trưởng thành cuối cùng noãn bào ở người cho noãn bằng GnRH-a (Biểu đồ rừng 2).
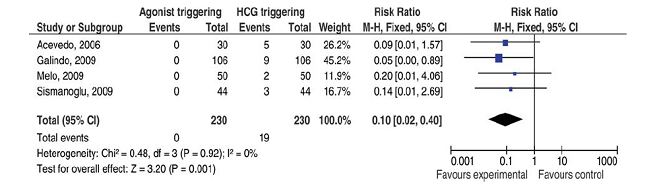
Biểu đồ rừng 2: OHSS trên chu kỳ cho-nhận noãn.
P. Humaidan, S. Kol, EG Papanikolaou, Hum Reprod Update, Vol.17, No.4 pp. S10-S24, 2011
Tuy nhiên, như đã trình bày, nhược điểm lớn nhất của khởi động bằng GnRH-a chính là kết cục xấu của chu kỳ IVF-ET, dựa trên các kết quả là tỉ lệ có thai (PR), tỉ lệ sinh sống (LBR) ở chu kỳ phôi tươi. Một điều quan trọng là các kết cục này lại diễn biến theo chiều hướng khác hẳn trên các chu kỳ phôi trữ và ở các chu kỳ cho-nhận noãn. Điều này gợi ý một nguyên nhân nằm ở pha hoàng thể của chu kỳ khởi động với GnRH-a hoặc ở nội mạc tử cung.
TIÊU HỦY SỚM VÀ KHÔNG HỒI PHỤC CỦA HOÀNG THỂ SAU KHỞI ĐỘNG GnRHa TRONG CHU KỲ KÍCH THÍCH BUỒNG TRỨNG IVF SỬ DỤNG GnRH-anta
Tiêu hủy hoàng thể trong chu kỳ IVF sử dụng GnRH-anta khởi động bằng GnRH-a có hai đặc điểm là (1) xảy ra rất sớm và (2) không hồi phục nếu can thiệp muộn. Từ đó, dẫn đến một kết cục xấu cho chu kỳ phôi tươi, bất chấp việc đã thực hiện một can thiệp hỗ trợ hoàng thể tiêu chuẩn sau đó. Vì thế, khi muốn thực hiện việc khởi động trưởng thành cuối cùng của noãn bào bằng GnRH-a, cần phải giải quyết bằng được vấn đề hỗ trợ hoàng thể (Luteal Phase Support: LPS).
Trong pha hoàng thể của chu kỳ tự nhiên, nồng độ steroid chỉ ở mức sinh lý. Nồng độ sinh lý của steroid, đặc biệt là progesterone đảm bảo việc duy trì của xung LH ở mức sinh lý. Sự hiện diện của LH đảm bảo cho việc up-regulate VEGFA, FGF2 và các cytokins, đồng thời kích thích các thụ thể ngoài tuyến sinh dục của LH ở nội mạc tử cung. Pha hoàng thể của chu kỳ IVF sử dụng GnRH-a để khởi động trưởng thành cuối cùng của noãn bào đặc trưng bởi các nồng độ trên mức sinh lý của steroids, đặc biệt là của progesterone. Nồng độ cao của progesterone sẽ ức chế các xung LH, làm cho nồng độ LH trở nên thấp dưới mức bình thường, dẫn đến ly giải hoàng thể sớm, rút ngắn pha này và thất bại làm tổ.
Khởi động với GnRH-a còn có đặc trưng là các biến động của steroids sau khởi động. Trong khởi động với GnRH-a, đỉnh LH và FSH đều ngắn, steroids biến động theo 3 pha. Trước chọc hút noãn, ghi nhận có một giai đoạn ngắn, trong đó nồng độ của E2 tăng song hành với tăng P4. Nồng độ của 2 steroids này đều giảm ngay trước chọc hút noãn. Sau chọc hút noãn, nồng độ P4 tăng lại, trong khi nồng độ E2 tiếp tục giảm. Sau chọc hút noãn, có khả năng tuyến Yên bị down-regulated, LH bị ức chế, dẫn đến ly giải hoàng thể hoàn toàn, sớm và không hồi phục. Các chất chỉ báo hoàng thể là Inhibin A, pro-aC đều sút giảm xác nhận giả thuyết này. Việc cho hCG trễ không cứu vãn được hoàng thể đã bị ly giải.
Khởi động với hCG gây nên hiện tượng “tăng LH” đơn độc, kéo dài. Trong kiểu khởi động này, nồng độ E2 giảm song hành với P4 ở thời điểm trước chọc hút noãn, và rồi tăng song hành trở lại sau chọc hút noãn. Ly giải hoàng thể xảy ra muộn do thời gian bán hủy dài của hCG. Ly giải hoàng thể trong khởi động với hCG còn có đặc điểm là có thể hồi phục với hCG muộn.
Như vậy, cần phải những can thiệp chuyên biệt cho hoàng thể sau khởi động với GnRH-a.
LPS QUI ƯỚC VÀ MODIFIED LPS
Nhiều nỗ lực giải cứu hoàng thể đã được nghiên cứu. Các modified LPS có thể được chia ra các dạng thức sau:
1. Một bolus hCG
2. Boluses hCG lập lại
3. Progesterone và estradiol liều cao
4. rec-LH lập lại[1]
5. GnRH-a tác dụng nhanh liều duy nhất[2]
Các nỗ lực này đã dẫn đến việc “bình thường hóa” pha hoàng thể sau khởi động trưởng thành cuối cùng của noãn bào bằng GnRH-a (Biểu đồ rừng 3).
Một bolus hCG
Mục tiêu của can thiệp này là xử lý vấn đề LH nội sinh thấp sau khởi động với GnRH-a. Can thiệp này sử dụng một bolus duy nhất 1500 IU hCG, vào ngày chọc hút noãn. Kèm theo sau bolus này vẫn là LPS qui ước sử dụng E2 và P4. So với khởi động bằng 10.000 IU hCG và LPS qui ước, chu kỳ khởi động GnRH-a có hỗ trợ hoàng thể bằng một bolus 1500 IU hCG không khác biệt về LBR và không xảy ra OHSS. Tỉ lệ mất thai sớm cũng giảm (Papanikolaou 2005; Humaidan 2006; Humaidan 2009; Humaidan 2010).
Boluses hCG lập lại
[1] Chỉ là các pilot study
[2] Chưa có RCTs
Mục tiêu của can thiệp này cũng là xử lý vấn đề LH nội sinh thấp sau GnRH-a. Can thiệp này sử dụng ba boluses lập lại của 500 IU hCG, vào các ngày [OPU+1], [OPU+4], [OPU+7] kèm theo LPS qui ước với P4. So với khởi động bằng 10.000 IU hCG với LPS qui ước, khởi động với GnRH-a kèm theo 3 boluses lập lại 500 IU (từ 200-1000) không khác biệt về LBR. Tuy nhiên, trong kiểu can thiệp này, ghi nhận có 4.2% OHSS trung bình và 3.6% OHSS nặng. Các trường hợp OHSS này có 3 đặc điểm: (1) là các OHSS muộn và (2) xảy ra trên đa thai và (3) hiếm xảy ra hơn khi dùng liều hCG là 250-500 IU (Castillo 2010)
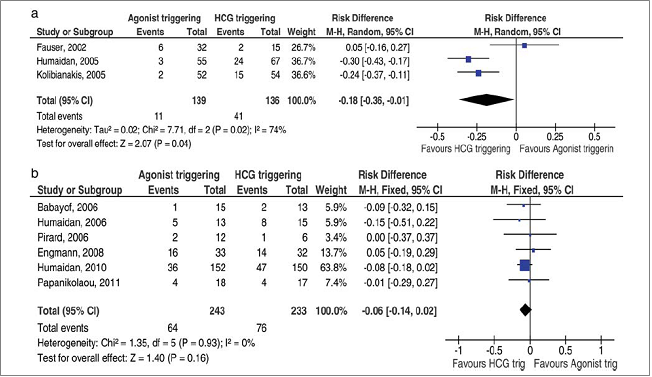
Biểu đồ rừng 3: OHSS và cách khởi động trưởng thành noãn.
(a) Ongoing pregnancy rate after conventional LPS (b) Delivery rate after modified LPS
P. Humaidan, S. Kol, EG Papanikolaou, Hum Reprod Update, Vol.17, No.4 pp. S10-S24, 2011
E2 và P4 tăng cường
Mục tiêu của can thiệp này là xử lý vấn đề nồng độ steroid thấp sau khởi động với GnRH-a. Can thiệp bằng E2 tăng cường được thực hiện qua da với các patch estradiol liều 0.1-0.4 mg mỗi ngày có kèm theo hay không kèm theo E2 đường uống, với mục tiêu là duy trì nồng độ E2 ở mức >200 pg/mL. P4 tăng cường được thực hiện qua đường tiêm bắp với liều 50-75 mg mỗi ngày có kèm hoặc không kèm theo P4 đường âm đạo qui ước, với mục tiêu là duy trì được nồng độ P4 >20 ng/mL. So với khởi động bằng hCG, khởi động bằng GnRH-a với LPS dùng Estradiol và Progesterone tăng cường không dẫn đến OHSS, với 53% thai tiến triển (Engmann 2008); Tuy nhiên, các kết quả rất mâu thuẫn., Zarutski 2009, Fatemi 2009, Mitwally 2010 tìm lại được các kết quả của Engmann; trong khi đó, với cùng phác đồ, Babayof 2006 chỉ thu được 6% thai tiến triển, với 80% sẩy thai sớm.
Khuyến cáo từ The
Trong chu kỳ kích thích buồng trứng IVF sử dụng GnRH-anta khởi động với GnRH-a và thực hiện modified LPS:
1. OHSS được loại trừ hoàn toàn trong các modied LPS không dùng hCG và được loại trừ gần như hoàn toàn trong các modified LPS có hCG mà không cần bất cứ biện pháp dự phòng OHSS nào khác (e.g Cabergolin, coasting…)
2. LBR được phục hồi nhưng vẫn còn tồn tại 6% khác biệt, thiên về khởi động với hCG.
3. Chưa xác định được phác đồ LPS lý tưởng cho chu kỳ GnRH-anta khởi động với GnRH-a.
4. Trữ phôi toàn bộ cho phép tránh được việc phải thực hiện một LPS tăng cường và tránh chuyển phôi trên một nội mạc tử cung bị “out of phase” do các nồng độ trên sinh lý của steroids.
SGART: 3 NĂM KINH NGHIỆM KHỞI ĐỘNG TRƯỞNG THÀNH CUỐI CÙNG CỦA NOÃN BÀO VỚI GnRH-a
Trong 3 năm 2008-2011, chúng tôi thực hiện khởi động trưởng thành cuối cùng của noãn bào bằng GnRH-a trên chu kỳ IVF dùng GnRH-anta cho cho các chu kỳ IVF với bệnh nhân đáp ứng cao hoặc các chu kỳ IVF cho-nhận noãn. Trong thời gian đầu, chúng tôi thực hiện trữ phôi toàn bộ. Kể từ năm 2011, chúng tôi thực hiện chuyển phôi tươi với modified LPS. Tuy nhiên, do chưa có khuyến cáo về phác đồ modified LPS lý tưởng, chúng tôi thực hiện việc chuyển các phôi dùng được nhưng không có khả năng để trữ. Tất cả các phôi có khả năng trữ lạnh được trữ vời phương pháp vitrification và chuyển trong các chu kỳ rã đông.
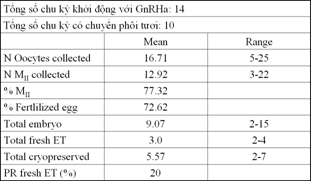
Âu Nhựt Luân, số liệu năm 2011, chu kỳ khởi động với GnRH-a
Bảng kết quả cho thấy chất lượng noãn bào khá tốt với tỉ lệ noãn bào ở MII cao. Chỉ duy nhất một trường hợp xảy ra OHSS trung bình sau liều thứ nhì 200 IU hCG. 10 chu kỳ được chuyển phôi tươi, với PR là 20% khi sử dụng phôi low-score. Chưa đủ số liệu để nói về LBR và EPLR trên chu kỳ phôi tươi.
Do chưa tìm được phác đồ lý tưởng cho modified LPS, chúng tôi vẫn chủ trương rằng chuyển phôi tươi với phôi low-score và thực hiện vitrification cho phép tăng tỉ lệ phôi khả dụng, do PR và LBR của chúng tôi rất ổn định trong các chu kỳ chuyển phôi trữ.
KẾT LUẬN
Qua khuyến cáo của Workshop Copenhagen 2010 và từ kinh nghiệm thực tiễn ở điều kiện Việt Nam, chúng tôi thiết nghĩ nên chọn IVF dùng phác đồ kích thích buồng trứng cho IVF với GnRH-anta cho các bệnh nhân nguy cơ cao OHSS dựa trên AFC và AMH hoặc IVF trên PCOS hoặc IVF donation. Ở nhóm bệnh nhân này, thực hiện khởi động với GnRH-a thường qui hoặc khi có nguy cơ cao OHSS.
Việc thực hiện chuyển phôi tươi thường qui với modified LPS dùng một bolus hCG 1500 IU; hoặc 3 boluses hCG 500 IU là hợp lý trong điều kiện Việt
REFERENCES
1. P. Humaidan, S. Kol, E.G. Papanikolaou. GnRH agonist for triggering of final oocyte maturation: time for a change of practice? Human Reproduction Update, Vol.17, No.4 pp. 510-524, 2011
2. S. Kol, P. Humaidan, J. Itskovitz-Eldor. GnRH agonist ovulation trigger and hCG-based, progesterone-free luteal support: a proof of concept study. Hum. Reprod. Advance Access published July 21, 2011
3. D. Kyrou, E.M. Kolibianakis, H.M. Fatemi, T.B. Tarlatzi, P. Devroey, and B.C. Tarlatzis. Increased live birth rates with GnRH agonist addition for luteal support in ICSI/IVF cycles: a systematic review and meta-analysis. Human Reproduction Update Advance Access published July 6, 2011
4. J. Tesarik, A. Hazout, R. Mendoza-Tesarik,
5. L. Engmann, A. Di Luigi, D. Schmidt, J. Nulsen, D. Maier, and C. Benadiva. The use of gonadotropin-releasing hormone (GnRH) agonist to induce oocyte maturation after cotreatment with GnRH antagonist in high-risk patients undergoing in vitro fertilization prevents the risk of ovarian hyperstimulation syndrome: a prospective randomized controlled study. Fertil Steril. 2008;89:84–91
6. C. Pirard, J. Donnez and E. Loumaye. GnRH agonist as luteal phase support in assisted reproduction technique cycles: results of a pilot study. Human Reproduction Vol.21, No.7 pp. 1894–1900, 2006
7. P. Humaidan, H. Ejdrup Bredkjær, L.Bungum, M.Bungum, M.L. Grøndahl, L. Westergaard and C. Yding Andersen. GnRH agonist (buserelin) or hCG for ovulation induction in GnRH antagonist IVF/ICSI cycles: a prospective randomized study. Human Reproduction Vol.20, No.5 pp. 1213–1220, 2005
8. T.A. Gelbaya, M. Kyrgiou,
9. P.W. Zarutskie, and J.A. Phillips. A meta-analysis of the route of administration of luteal phase support in assisted reproductive technology: vaginal versus intramuscular progesterone. Fertil Steril. 2009;92:163–9
10. B.S. Shapiro, S.T. Daneshmand, F.C. Garner, M. Aguirre, C. Hudson. Comparison of ‘‘triggers’’ using leuprolide acetate alone or in combination with low-dose human chorionic gonadotropin. Fertil Steril. Vol. 95, No. 8, June 30, 2011
11. J.A. Garcia-Velasco, L. Motta, A. Lopez, M. Mayoral, M. Cerrillo, A. Pacheco. Low-dose human chorionic gonadotropin versus estradiol/progesterone luteal phase support in gonadotropin-releasing hormone agonist–triggered assisted reproductive technique cycles: understanding a new approach. Fertil Steril. Vol. 94, No. 7, December 2010
12. P. Humaidan, E.G. Papanikolaou, and B.C. Tarlatzis. GnRHa to trigger final oocyte maturation: a time to reconsider. Human Reprod. Vol.24, No.10 pp. 2389–2394, 2009
Thứ bảy ngày 22 . 11 . 2025 (9:30 - 12:00), khách sạn Equatorial (số ...
New World Saigon Hotel, thứ bảy ngày 17 tháng 01 năm 2026
Hội Nội tiết Sinh sản và Vô sinh TP. Hồ Chí Minh (HOSREM) sẽ ...
Sách ra mắt ngày 14 . 11 . 2025 và gửi đến quý hội viên trước ...

Ấn phẩm CẬP NHẬT KIẾN THỨC VỀ QUẢN LÝ SỨC KHỎE TUỔI MÃN ...
Y học sinh sản được phát ngày ngày 21 . 9 . 2025 và gởi đến ...








