 ThS. Huỳnh Gia Bảo
ThS. Huỳnh Gia Bảo
IVFAS, Bệnh viện An Sinh
TỔNG QUAN
Louise Brown ra đời vào 07/1978 đã cho thấy IVF (In Vitro Fertilization) có hiệu quả trong điều trị các trường hợp vô sinh do người vợ, đặc biệt là nguyên nhân từ tai vòi (Edwards và cs., 1980). Vài năm sau đó, IVF cũng được áp dụng thành công cho các cặp vợ chồng vô sinh chưa rõ nguyên nhân, vô sinh nam và lạc nội mạc tử cung (Mahadevan và cs., 1983). Tuy nhiên, với những trường hợp vô sinh do chất lượng tinh trùng (mật độ ít, di động yếu, dị dạng) thì hiệu quả của IVF vẫn còn thấp do tỉ lệ thụ tinh thấp dẫn đến số lượng phôi tốt ít.
Vào cuối thập niên 80, một số phương pháp hỗ trợ thụ tinh đã được phát triển và áp dụng cho các cặp vợ chồng không thực hiện được IVF. Kỹ thuật đầu tiên là tạo lỗ thủng trên màng trong suốt – PZD (Partial Zona Dissection) cho phép tinh trùng tiếp xúc trực tiếp đến màng bào tương noãn, kỹ thuật tiêm tinh trùng vào khoang noãn – SUZI (Sub Zonal Insemination). Nhìn chung với kỹ thuật PZD và SUZI thì tỉ lệ noãn được thụ tinh vẫn còn thấp, chỉ có một hoặc 2 phôi được chuyển cho bệnh nhân do đó tỉ lệ thai thấp và số em bé ra đời ít nên khó có thể xem PZD và SUZI là phương pháp điều trị thông thường.
Năm 1992, Palermo đã báo cáo trường hợp thai đầu tiên sau kỹ thuật tiêm tinh trùng vào bào tương noãn – ICSI (Intra Cytoplasmic Sperm Injection), một phương pháp hỗ trợ sinh sản mới. Trong ICSI, một tinh trùng đã được bất động sẽ được tiêm vào bên trong bào tương noãn sau khi đi xuyên màng trong suốt. ICSI giúp đạt được tỉ lệ thụ tinh cao cũng như tỉ lệ thai cao hơn mà không cần quan tâm đến các các yếu tố mật độ, di động của tinh trùng. ICSI giúp cho các bệnh nhân bất thường tinh trùng nặng, dị dạng, không có tinh trùng, hay tinh trùng từ phẫu thuật, có thể được làm bố. Do đó, nó trở thành một cuộc cách mạng mới trong công cuộc điều trị vô sinh nam (Devroey và Van Steirteghem, 2004).
Việc lựa chọn tinh trùng tốt nhất để tiêm vào bào tương noãn dựa vào hình dạng tinh trùng ở độ phóng đại 200-300 lần vẫn là phương pháp sử dụng chủ yếu từ trước đến nay trong kỹ thuật ICSI. Chất lượng của tinh trùng được sử dụng có thể ảnh hưởng đến tỉ lệ thủ tinh, tỉ lệ phân chia, chất lượng phôi, tỉ lệ làm tổ và tỉ lệ có thai sau đó (Boitrelle và cs., 2011; Said và Land, 2011; Ortega và cs., 2011; De Vos và cs., 2003). Do đó, để góp phần gia tăng tỉ lệ thành công cho việc chọn lựa tinh trùng trong ICSI, kỹ thuật tiêm tinh trùng có chọn lọc hình dạng vào bào tương noãn – IMSI (Intracytoplasmic Morphologically Selected Sperm Injection) được đưa ra bởi Bartoov và cộng sự (2002) giúp chọn lựa tinh trùng với hình dạng bình thường và không có không bào ở độ phóng đại cao hơn 6.600 lần dựa theo tiêu chuẩn MSOME (Motile Sperm Organellar Morphology Examination) (Watanabe và cs., 2011; Boitrelle và cs., 2011). Cùng với sự phát triển của kỹ thuật IMSI thì tiêu chuẩn chọn tinh trùng trong IMSI cũng nghiêm ngặt hơn, ngoài tiêu chuẩn về hình dạng bên ngoài (đầu, cổ, giữa, đuôi) thì thành phần của đầu tinh trùng cũng được quan tâm và được đưa vào làm tiêu chuẩn của một tinh trùng bình thường. Bartoov và cộng sự (2002) lần đầu tiên miêu tả tiêu chuẩn MSOME, và tiêu chuẩn này cho phép lựa chọn hình dạng tinh trùng di động một cách dễ dàng ở độ phóng đại cao trên 6.000 lần. Với MSOME bất thường của hình dạng bên ngoài có thể dễ dàng quan sát ở độ phóng đại thấp, tuy nhiên những bất thường như trung tử, không bào và sự hiện diện của những hốc nhỏ ở đầu tinh trùng không thể nhận thấy ở độ phóng đại thấp. Những bất thường này chỉ có thể được phát hiện ở độ phóng đại cao. Dựa trên những tiêu chí này nên tiêu chuẩn MSOME được áp dụng để lựa chọn tinh trùng trong IMSI. Hiệu quả của IMSI liên quan tới sự phát triển của phôi tiếp theo sau đang trở thành chủ đề của những nghiên cứu gần đây trên thế giới (Boitrelle và cs., 2011). Bên cạnh đó, cơ chế giải thích cách chọn lựa tinh trùng theo tiêu chuẩn MSOME vẫn là chủ đề tranh luận (Watanabe và cs., 2011; Perdrix và cs., 2011).
Theo Bartoov và cộng sự (2002), không bào được coi là lớn khi nó chiếm trên 4% thể tích vùng nhân khu vực đầu và được coi là bất thường (Berkovitz và cs., 2006; Peer và cs., 2007; Sermondade và cs., 2007; Vanderzwalmen và cs., 2008). Tuy nhiên Franco và cộng sự (2008) lại cho rằng không bào được coi là lớn khi nó chiếm trên 50% tổng thể tích vùng đầu. Trong những năm gần đây đã có những nghiên cứu sâu hơn về ảnh hưởng của không bào và những ảnh hưởng của nó đến vật chất di truyền.
Wantanabe và cộng sự (2008) đã nghiên cứu ảnh hưởng của không bào đến bất thường ADN, kết quả cho thấy không bào không ảnh hưởng đến sự phân mảnh ADN, và chỉ ra rằng không bào không phải là dấu hiệu của bệnh lý hoặc gây thiệt hại ADN, tỉ lệ tinh trùng có không bào ở nhóm bệnh nhân vô sinh nam so với tinh trùng của người hiến là tương đương nhau (4,6% so với 4,2%), và tỉ lệ bất thường ADN của hai nhóm này cũng không có sự khác biệt (3,3% so với 3,5%).
Năm 2011, Perdrix và cộng sự khi khảo sát trên 20 cặp bệnh nhân có bất thường hình dạng tinh trùng, kết quả cho thấy các không bào nhỏ không ảnh hưởng đến bất thường ADN còn tinh trùng có không bào lớn, tỉ lệ phân mảnh ADN cao hơn so với tinh trùng nhóm chứng (77,6% so với 70,6%), bất thường acrosome và sự cô đặc nhiễm sắc thể cũng cao hơn, lần lượt là (77,6% so với 70,6%) và (50,4% so với 26,5%). Từ những nghiên cứu trên cho thấy không bào ở tinh trùng là đặc điểm phổ biến và không ảnh hưởng đến tổn thương ADN. Tuy nhiên, sự hiện diện của các không bào lớn có thể làm tăng tỉ lệ tổn thương ADN của tinh trùng.
THIẾT BỊ
IMSI hệ thống
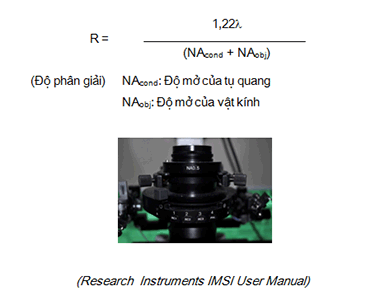
Hệ thống phóng đại bao gồm: hệ thống quang học DIC kết hợp với phản pha Normarski, sử dụng vật kính 100X để phóng đại tinh trùng, đồng thời kết hợp với hệ thống dẫn truyền đặc biệt để phóng đại hình ảnh trên màn hình. Tổng cộng độ phóng đại cuối cùng của cả hệ thống trên màn hình kỹ thuật số là 6.600 lần. Độ phóng đại này giúp ta có nhiều thông tin hơn về hình dạng để chọn lựa tinh trùng để tiêm vào noãn. Tuy nhiên, việc chọn tinh trùng cần được thực hiện trên đĩa thủy tinh có phủ dầu.

IMSI cải tiến
Qui trình tiêm tinh trùng vào bào tương noãn có chọn lựa tinh trùng ở độ phóng đại cao sử dụng vật kính 40X (IMSI cải tiến) tương tự như qui trình ICSI, chỉ khác ở chỗ việc chọn lựa và bất động tinh trùng được thực hiện ở độ phóng đại cao hơn (600x), sau đó chuyển về độ phóng đại 200x thông thường và thực hiện ICSI. Tiêu chuẩn về hình dạng để chọn lựa tinh trùng được dựa theo tiêu chuẩn WHO 2010 và không có không bào.
|
 |

|
CÁC BẰNG CHỨNG Y HỌC VỀ HIỆU QUẢ CỦA IMSI
Mặc dù đã được giới thiệu trên 10 năm, cho đến nay, y văn có rất ít nghiên cứu ngẫu nhiên có đối chứng so sánh hiệu quả của IMSI và ICSI, đồng thời đối tượng nghiên cứu và phương pháp đánh giá không đồng nhất. Chúng tôi xin trình bày một số các nghiên cứu quan trọng về hiệu quả của IMSI cho đến hiện nay.
Những nghiên cứu đồng thuận
Kỹ thuật IMSI được phát triển đầu tiên bởi nhóm nghiên cứu của giáo sư Bartoov từ Israel. Năm 2002, nhóm của ông đã sử dụng một kính hiển vi có độ phóng đại cao được hỗ trợ để xác định đặc điểm hình thái của tinh trùng có thể ảnh hưởng đến kết quả ICSI. Họ cho rằng tỉ lệ mang thai của ICSI có thể bị ảnh hưởng bởi bất thường trong hình dạng hạt nhân của tinh trùng mà chuyên viên phôi học không thể phát hiện được trong quá trình lựa chọn tinh trùng bình thường trong ICSI.
Năm 2003, Bartoov và cs đã công bố một số nghiên cứu về việc lựa chọn tinh trùng bằng kỹ thuật IMSI, đã cải thiện tỉ lệ mang thai ở các cặp vợ chồng thất bại trong ICSI lặp lại nhiểu lần. Nghiên cứu so sánh 50 cặp vợ chồng trong mỗi nhóm. Họ nhận thấy rằng các cặp vợ chồng trải qua IMSI có được tỉ lệ mang thai cao hơn những bệnh nhân thực hiện ICSI (66% so với 33%).
Những phát hiện này được lặp lại khi Berkovitz và cộng sự (2006) nghiên cứu so sánh 80 cặp vợ chồng trải qua IMSI với 80 cặp vợ chồng trải qua ICSI. Kết quả cho thấy tỉ lệ mang thai ở nhóm IMSI cao hơn so với nhóm ICSI (60% so với 25%) và tỉ lệ sẩy thai cũng thấp hơn (14% so với 40%). Cùng năm này, Hazout và cộng sự cũng tìm thấy những cải thiện trong tỉ lệ đậu thai, mang thai và sinh bé bằng cách sử dụng IMSI ở những bệnh nhân đã thất bại nhiều lần ICSI.
Theo Antinori và cộng sự (2008), khi so sánh kết quả lâm sàng của hai nhóm IMSI và ICSI trên 446 cặp bệnh nhân, thì thấy rằng những cặp vợ chồng sử dụng IMSI có tỉ lệ mang thai cao hơn nhóm ICSI thường qui (39,2% so với 26,5%), và tỉ lệ sẩy thai ở nhóm IMSI cũng thấp hơn (17,4% so với 37,5%).
Phần lớn các nghiên cứu trên được thực hiện tại Israel, Ý và Pháp. Kết quả của các nghiên cứu cho thấy rằng IMSI làm tăng tỉ lệ mang thai và giảm tỉ lệ sẩy thai sớm so với ICSI.
Những nghiên cứu không đồng thuận
Tuy nhiên bên cạnh những nghiên cứu cho thấy kỹ thuật IMSI đem lại sự thành công hơn trong ICSI, thì những nghiên cứu gần đây lại cho rằng không có sự cải thiện về tỉ lệ thai trong ICSI khi sử dụng IMSI.
Trong một nghiên cứu thực hiện trên 30 bệnh nhân cho thấy rằng tỉ lệ thụ tinh ở hai nhóm IMSI và ICSI tương đương nhau (70,9% so với 70,4%), cũng như tỉ lệ phôi phân chia (66,9% so với 60,4%) và tỉ lệ phôi tốt (57,8% so với 52,2%) không có sự khác biệt (Mauri và cs., 2010).
Năm 2010, Setti và cộng sự đã tổng hợp và phân tích những nghiên cứu về ảnh hưởng của IMSI đến quả trong ICSI. Kết quả đã tìm được 5 nghiên cứu so sánh IMSI và ICSI, chọn được 3 nghiên cứu tương đối đủ điều kiện để phân tích, 2 nghiên cứu so sánh không ngẫu nhiên và 1 nghiên cứu ngẫu nhiên.
Nghiên cứu của João Batista A Oliveira và cộng sự (2011) cũng đã so sánh kết quả thụ tinh, tỉ lệ thai lâm sàng của hai nhóm IMSI và ICSI trên 200 cặp bệnh nhân, kết quả đạt được không có sự khác biệt giữa hai nhóm IMSI và ICSI về tỉ lệ thụ tinh (65,4% so với 62%), tỉ lệ phôi làm tổ (13,6% so với 9,8%), và tỉ lệ thai lâm sàng (26% so với 19%).
Năm 2011, Banlaban và cộng sự cũng đã khảo sát ảnh hưởng của IMSI đến kết quả lâm sàng trong ICSI trên 168 cặp bệnh nhân. Và kết quả cho thấy không có sự cải thiện hơn về tỉ lệ phôi tốt được chuyển ở nhóm IMSI so với ICSI (2,72% so với 2,76%) cũng như tỉ lệ trẻ sinh ra (43,7% so với 38,3%). Cùng năm 2011, nhóm tác giả De Vos và cộng sự cũng đã nghiên cứu về sự ảnh hưởng của IMSI đến hiệu quả của ICSI, kết quả thu được một lần nữa khẳng định không có sự khác biệt về tỉ lệ thụ tinh cũng như tỉ lệ phôi tốt giữa hai nhóm IMSI và ICSI (81,9% so với 79,7%) và (34,8% so với 35,4%).
Nghiên cứu trong nước
Hiện nay, chi phí đầu tư cho một hệ thống phóng đại hình ảnh kỹ thuật số trong kỹ thuật IMSI còn khá cao ở Việt Nam đồng thời sự tương thích về mặt quang học cho kỹ thuật này vẫn đang còn tranh cãi (hình ảnh không rõ, khoảng không làm việc giảm, bổ sung đĩa thủy tinh và vật kính dầu, tăng thời gian ICSI), đồng thời hiệu quả của kỹ thuật chưa được chứng minh rõ ràng (Bảng 4). Điều này có thể dẫn đến sự đầu tư lãng phí theo trào lưu chung trên thế giới mà không đạt mang lại hiệu quả thật sự cho bệnh nhân và các trung tâm TTTON.
Nói chung, các vấn đề lớn của kỹ thuật IMSI đi kèm với hệ thống hình ảnh kỹ thuật số là:
- Chi phí đầu tư rất cao mà có thể chỉ có hiệu quả trên một số ít trường hợp.
- Sử dụng hệ thống đánh giá hình dạng khác với tiêu chuẩn quen thuộc của Tổ chức Y tế thế giới.
- Kỹ thuật phức tạp, thời gian thực hiện kỹ thuật tiêm tinh trùng vào bào tương noãn (ICSI) kéo dài.
- Hiệu quả điều trị và chỉ định chưa rõ ràng.
Trước tình hình đó, nhóm nghiên cứu thuộc CGRH đã phối hợp với Đơn vị Hỗ trợ sinh sản (IVFAS) thuộc Bệnh viện An Sinh triển khai áp dụng kỹ thuật IMSI cải tiến nhằm khắc phục được các khuyết điểm trên mà vẫn đảm bảo hiệu quả chọn lọc tinh trùng trong điều trị.
Về thực chất, khái niệm IMSI là kỹ thuật tiêm tinh trùng có chọn lọc kỹ về hình dạng để tiêm vào bào tương noãn, dựa vào việc chọn lọc tinh trùng ở độ phóng đại cao. Việc chọn lựa tinh trùng về hình dạng không nhất thiết phải sử dụng hệ thống phóng đại cao kỹ thuật số, chi phí cao, trên thị trường hiện nay. Về cơ bản, kỹ thuật IMSI cải tiến, sử dụng vật kính tương phản pha 40X, kết hợp hệ thống phóng đại phụ có sẵn và chọn lựa tinh trùng bình thường theo hình dạng và sự hiện diện của không bào, theo tiêu chuẩn WHO 2010 (World Health Organization 2010) dưới độ phóng đại 600 lần, dựa trên hệ thống quang học chuẩn của kính hiển vị đảo ngược.
Bảng 1. So sánh giữa 2 tiêu chuẩn WHO 2010 và MSOME
|
|
WHO 2010 |
MSOME |
|
Hình dạng tổng quát |
Láng, cân đối và hình ovan |
Láng, cân đối, hình ovan |
|
Chiều dài |
3,7-4,7mm |
4,75 ± 0,28mm |
|
Chiều rộng |
2,5-3,2mm |
3,28 ± 0,20mm |
|
Không bào |
Không có không bào lớn hoặc không nhiều hơn 2 không bào nhỏ và nhỏ hơn 20% thể tích vùng đầu |
Không nhiều hơn 1 không bào và nhỏ hơn 4% thể tích vùng nhân |
Nhóm nghiên cứu thiết lập một qui trình chọn lọc tinh trùng bằng cách phóng đại tối đa kích thước tinh trùng bằng hệ thống quang học tiêu chuẩn của các kính hiển vi đảo ngược thông thường, dựa trên điều kiện hiện có tại các trung tâm ở Việt nam. Mục tiêu của qui trình IMSI cải tiến là giúp chọn lựa tinh trùng tốt hơn, chi phí thấp, phù hợp với hầu hết trung tâm và thuận tiện của người thực hiện, cũng như giảm thiểu thời gian thực hiện nhằm tăng chất lượng phôi. Mục tiêu nghiên cứu là đánh giá hiệu quả của kỹ thuật IMSI về tạo phôi (tỉ lệ thụ tinh, tỉ lệ phát triển phôi và tỉ lệ phôi tốt). Đồng thời tính tỉ lệ làm tổ của phôi và tỉ lệ có thai của các chu kỳ chuyển phôi từ kỹ thuật IMSI cải tiến.
Đây là một nghiên cứu ngẫu nhiên có nhóm chứng với 1336 noãn trưởng thành của 85 cặp vợ chồng vô sinh do tinh trùng dị dạng thực hiện TTTON tại Đơn vị IVFAS, Bệnh viện An Sinh từ 04/2012-06/2012. Nghiên cứu do CGRH quản lý và triển khai thực hiện.
Các kết quả chính của nghiên cứu được trình bày dưới đây.
Bảng 2. So sánh các chỉ số tỉ lệ thụ tinh, tỉ lệ phân chia, tỉ lệ phôi tốt giữa 2 nhóm
|
Các chỉ số |
Hình dạng tinh trùng 0%
|
Hình dạng tinh trùng >0% |
||||
|
IMSI |
ICSI |
Giá trị P |
IMSI |
ICSI |
Giá trị P |
|
|
Tỉ lệ thụ tinh |
76,0% |
75,9% |
NS |
74,7% |
72,1% |
NS |
|
Tỉ lệ phân chia |
97,7% |
95,1% |
NS |
96,5% |
97,2% |
NS |
|
Tỉ lệ phôi tốt |
36,9% |
39,6% |
NS |
37,6% |
33,6% |
NS |
Số liệu chi tiết so sánh giữa 2 nhóm IMSI cải tiến và ICSI thông thường trong nghiên cứu cho thấy không có sự khác biệt ý nghĩa ở tỉ lệ thụ tinh, tỉ lệ phân chia, tỉ lệ phôi tốt. Kết quả này cũng tương tự như những báo cáo lớn có độ tin cậy gần đây của các nhóm nghiên cứu uy tín khác trên thế giới.
Bảng 3. Kết quả có thai của IMSI cải tiến
|
|
IMSI cải tiến |
|
Tỉ lệ β-hCG |
47/85 (55,3%) |
|
Tỉ lệ thai lâm sàng |
39/85 (45,9%) |
|
Tỉ lệ thai sinh hóa |
8/85 (9,4%) |
|
Tỉ lệ sẩy thai |
1/39 (2,6%) |
|
Tỉ lệ làm tổ |
69/337 (20,5%) |
Tỉ lệ có thai của kỹ thuật IMSI là khá cao so với tỉ lệ có thai chung của TTTON. Điều này cho thấy IMSI cải tiến, thông qua việc chọn lọc tinh trùng, có thể giúp tăng được chất lượng và khả năng phát triển của phôi. Kinh nghiệm cho thấy IMSI cải tiến cho hình ảnh tinh trùng với độ phóng đại khá cao, hình ảnh rõ nét và thuận tiện cho người sử dụng.
Việc áp dụng thành công kỹ thuật IMSI cải tiến và đạt tỉ lệ có thai lâm sàng cao là một ví dụ cho sự năng động, áp dụng các quan điểm mới trong lĩnh vực TTTON trên thế giới vào thực tế lâm sàng ở Việt Nam, nhằm theo kịp các tiến bộ trên thế giới và không ngừng cải thiện tỉ lệ thành công. Một trong những vấn đề cần được ghi nhận là khả năng áp dụng các quan điểm mới một cách sáng tạo để làm giảm chi phí đầu tư, đơn giản hóa qui trình mà vẫn giúp tăng hiệu quả trong điều trị.
Bảng 4. So sánh giữa hệ thống IMSI cải tiến và hệ thống IMSI kèm hệ thống kỹ thuật số
|
|
IMSI cải tiến |
IMSI kèm hệ thống |
|
Thời gian ICSI |
Đơn giản, bình thường |
Phức tạp, chậm |
|
Chi phí đầu tư |
Thấp (<50 triệu đồng) |
Cao (800 triệu đến >1 tỉ đồng) |
|
Hiệu quả |
Tương đương |
Tương đương |
KẾT LUẬN
Ảnh hưởng của kỹ thuật IMSI được áp dụng cho những cặp vợ chồng vô sinh do yếu tố nam nặng và có những chu kỳ điều trị vô sinh thất bại nhiều lần hiện nay trên thế giới cho thấy được những vấn đề như sau:
- Việc lựa chọn tinh trùng trong ICSI đóng vai trò quan trọng.
- Không bào trong tinh trùng là hiện tượng phổ biến. Mối liên quan đến chất lượng tinh trùng thể hiện rõ hơn ở những trường hợp bất thường tinh trùng nặng và không bào kích thước lớn.
- Lựa chọn tinh trùng dựa vào hình dạng dưới độ phóng đại cao IMSI là một bước tiến nhanh và phù hợp với xu hướng hiện nay.
- Chưa đủ dữ liệu để chứng minh IMSI có hiệu quả cải thiện kết quả ICSI nói chung.
- IMSI có thể có hiệu quả trên tinh trùng bất thường nặng.
- Khi thực hiện ICSI nên loại bỏ những tinh trùng có không bào lớn.
- Cần có thêm những nghiên cứu về hiệu quả cũng như giải thích cơ chế hiệu quả của IMSI. Cũng như ảnh hưởng của không bào đến bất thường DNA.
- Hiện nay kỹ thuật IMSI cải tiến cũng mang lại kết quả tốt trong ICSI và chi phí cho kỹ thuật này thấp hơn so với IMSI hệ thống rất nhiều.
- Kỹ thuật IMSI cải tiến không làm tăng hiệu quả tạo phôi dựa trên các tỉ lệ thụ tinh, phân chia, phôi tốt.
- Kỹ thuật IMSI cải tiến có thể cải thiện tỉ lệ thai, tỉ lệ làm tổ của phôi.
- Kỹ thuật IMSI cải tiến đơn giản, tiết kiệm chi phí đầu tư và có thể giúp cải thiện tỉ lệ thành công trong hỗ trợ sinh sản.
Tài liệu tham khảo
1. Antinori M, Licata E, Dani G, Cerusico F, Versaci C, d’Angelo D, Antinori S. Intracytoplasmic morphologically selected sperm injection: a prospective randomized trial. Reproductive BioMedicine Online 2008; 6(6):835-841.2. Balaban B, Yakin K, Alatas C, Oktem O, Isiklar A, Urman B. Clinical outcome of intracytoplasmic injection of spermatozoa morphologically selected under high magnification: a prospective randomized study. Reproductive BioMedicine Online 2011; 22:472-476.
3. Bartoov B, A Berkovitz, F Eltes, Kogosowski A, Menezo Y, Barak Y (2002). Good real-time morphology of the cells of the human sperm is associated with IVF-ICSI outcome. J Androl; 23:1-8.4. Berkovitz et al. (2006). How to improve IVF-ICSI outcome by sperm selection Reproductive BioMedicine Online 12 (5): 634-8.
5. Boitrelle F, Ferfouri F, Petit JM, Segretain D, Tourain C, Bergere M, Bailly M, Vialard F, Albert M, Selva J. Large human sperm vacuoles observed in motile spermatozoa under high magnification: under thumbprints linked to failure of chromatin condensation. Human Reproduction 2011; 0:1-9.6. De Vos A, De Velde HV, Joris H, Verheyen G, Devroey P, Steirteghem AV. Influence of individual sperm morphology on fertilization, embryo morphology and pregnancy outcome of intracytoplasmic sperm injection. Fertility and Sterility 2003; 79(1):42-49.
7. Mauri AL, Peterson CG, Oliveira JBA, Massaro FC, Baruffi RLR, Franco JG. Comparison of day 2 embryo quality after conventional ICSI versus intracytoplasmic norphologically selected sperm injection (IMSI) using sibling oocytes. European J of Obst & Gyn and Rep Bio 2010. 150(1):42-46.8. Ortega C, Verheyen G, Raick D, Camus M, Devroey P, Tournaye H. Absolute asthenozoospermia and ICSI: whar are the option? Human Reproduction Updates 2011; 17(5):684-692.
9. Perdrix A, Travers A, Chelli MH, Escalier D, Do Rego JL, Milazzo JP, Mousset – Simeon N, Mace B, Rives N. Assessment of acrosome and nuclear abnormalities in human spermatozoa with large vacuoles. Human Reproduction 2011; 26(1):47-58.
10. Said TM and Land JA. Effects of advanced selection methods on sperm quality and ART outcome: a systematic review. Human Reproduction Update 2011; 0:1-15.
11. Setti AS, Ferreira RC, Braga DPA, Figueira RCS, Iaconelli A, Borges D. Intracytoplasmic sperm injection outcome versus intracytoplasmic morphologically selected sperm injection outcome: a meta-analysis. Reproduction BioMedicine Online 2010; 21:450-455.12. Setti AS, Figueira RCS, Braga DPAF, Iaconelli A, Borges D. Intracytoplasmic morphologically selected sperm injection benefits for patients with oligo-astheno-zoospermia according to the 2010 World Health Organization reference values. Fertility and Stertility 2011; 95(8):2711-2714.
13. Textbook of Assisted Reproductive Techniques. Fourth Edition, Volume 1: Laboratory Perspectives.14. Watanabe S, Tanaka A, Fujii S, Mizunuma H, Fukui A, Fukuhara R, Nakamura R, Yamada K, Tanaka I, Awata S, Nagayoshi M. An investigation of the potential effect of vacuoles in human sperm on DNA damage using a chromosome assay and the TUNEL assay. Human Reproduction 2011; 26(5):978-986.
15. WHO (2010). Laboratory manual for the examination and processing of human semen. Fifth edition, New York: Cambridge University Press.
New World Saigon Hotel (Số 76 Lê Lai, Phường Bến Nghé, Quận 1, ...
Caravelle Hotel Saigon, chiều thứ bảy 20.4 và chủ nhật 21.4.2024
Khách sạn Caravelle Saigon, Chủ nhật 21.1.2024 (9:00 - 11:15)
Sách dự kiến phát hành đầu tháng 6.2024
Sách ra mắt ngày 9 . 3 . 2024 và gửi đến quý hội viên trước ...
Y học sinh sản số 68 ra mắt ngày 25 . 12 . 2023 và gửi đến quý ...






