Tin chuyên ngành
on Wednesday 11-03-2015 10:32am
Danh mục: Sản khoa & nhi sơ sinh
ĐẶT VẤN ĐỀ
Nhiễm trùng bào thai ảnh hưởng nghiêm trọng đến sức khỏe và sự sống thai nhi, ngoài ra, nhiễm trùng bào thai còn để lại những di chứng nặng nề gây ảnh hưởng trầm trọng đến chất lượng sống của trẻ và là gánh nặng của gia đình, xã hội.
Tùy vào thời điểm nhiễm bệnh, tỉ lệ con bị hội chứng Rubella bẩm sinh rất thay đổi: 90-100% khi thai dưới 8 tuần, 50% khi thai 8-12 tuần, 20% ở tuổi thai 12-20 tuần, sau 20 tuần thì tỉ lệ này khoảng <1%.
Ngoài ra, thai phụ còn có thể bị nhiễm các virus khác như cúm, viêm gan B, quai bị, sởi, thủy đậu, đậu mùa… cũng có thể gây ra hội chứng nhiễm trùng bào thai và để lại hậu quả nghiêm trọng cho bé sau sinh.
Chính vì tính chất nghiêm trọng của nhiễm trùng bào thai, đặc biệt là Rubella nên phụ nữ trong độ tuổi sinh sản đã được khuyến cáo nên chủ động đi tiêm chủng vaccine Rubella trước khi quyết định có thai. Tuy nhiên, cũng có một số trường hợp vô tình đã tiêm vaccine này quanh thời điểm thụ thai. Điều này đã khiến không ít gia đình quyết định bỏ thai. Vậy tiêm vaccine Rubella có an toàn trong thời điểm này không? Có nên khuyên thai phụ bỏ thai nếu vô tình tiêm MMR trước và sau thời điểm có thai 3 tháng không?
CẬP NHẬT HƯỚNG DẪN TIÊM VACCINE TRONG THAI KỲ (CDC, 2013)
Vaccine giúp bảo vệ thai phụ và thai nhi phát triển khỏe mạnh. Trước khi mang thai, phụ nữ trong độ tuổi sinh sản nên được tiêm đầy đủ các loại vaccine theo chương trình tiêm chủng. Điều này giúp bảo vệ bà mẹ và con của họ.
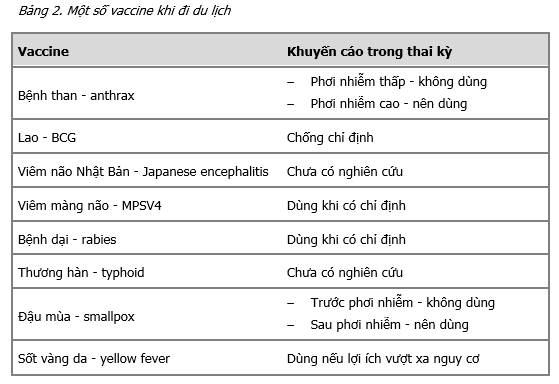
Những vaccine sống nên được tiêm trước khi có thai ít nhất 1 tháng. Những vaccine bất hoạt có thể tiêm trước hoặc trong thai kỳ nếu cần thiết. Một số vaccine được CDC khuyến cáo dùng trong thai kỳ: cúm, Tdap (27-36 tuần) và một số vaccin cho thai phụ khi đi du lịch.
Tiêm chủng cho sản phụ ngay sau sinh theo chương trình tiêm chủng được khuyến cáo là an toàn cho sản phụ và trẻ sơ sinh, ngay cả trong thời kỳ cho con bú. Sản phụ chưa được tiêm vaccine Tdap trong thai kỳ thì nên tiêm chủng ngay sau sinh, điều này cũng giúp bảo vệ bé. Nếu sản phụ chưa được chủng ngừa MMR thì nên tiêm vaccine này cho bà mẹ ngay trước khi xuất viện. Vaccine cúm bất hoạt chưa được tiêm trong thai kỳ thì cũng nên tiêm cho bà mẹ ngay sau khi sinh để bảo vệ con của họ. Ngoài ra, có thể dùng vaccine cúm sống giảm độc lực để tiêm cho bà mẹ.
.PNG)
ĐÁNH GIÁ SƠ LƯỢC MỘT SỐ TRƯỜNG HỢP TIÊM VACCINE SỞI - QUAI BỊ - RUBELLA TRONG VÒNG 3 THÁNG QUANH THỜI ĐIỂM THỤ THAI
Nhận xét:
Trong tổng số 162 trường hợp đã tiêm MMR trong thời gian 3 tháng quanh thời điểm thụ thai, chúng tôi nhận thấy:
Trong khảo sát của chúng tôi, có 41 ca IgM dương tính kéo dài 1-10 tháng sau tiêm MMR. Tuy nhiên, chúng tôi chưa ghi nhận trường hợp nào bị hội chứng Rubella bẩm sinh. Đây là trường hợp cần theo dõi và tư vấn kỹ cho bệnh nhân về vấn đề IgM kéo dài sau tiêm, khả năng ảnh hưởng đến thai hầu như không có.
Khoảng 53,85% trường hợp tiêm MMR trong thời gian 1 tháng trước và sau thụ thai, tuy nhiên, chúng tôi chưa ghi nhận trường hợp nào bị biến chứng Rubella bẩm sinh.
PHÂN LOẠI VACCINE CỦA FDA
FDA đề ra bảng phân loại vaccine trong thai kỳ:
Năm 1962, Parman và Weller phân lập được virus Rubella; đến năm 1969, vaccine Rubella ra đời. Meruvax, Rubelogen, Cendevax (1969), Meruvax – RA 27/3 (1979) là vaccine sống giảm độc lực, hiệu quả trong 95%, có tác dụng tạo miễn dịch suốt đời.
Tác dụng không mong muốn: sốt (5%), nổi ban (5%), đau khớp cấp (25%), giảm tiểu cầu (1/30.000), viêm tuyến mang tai, điếc rất hiếm, bệnh lý não (<1/1.000.000). Trước khi tiêm MMR, nên hỏi bệnh nhân xem có dự định có thai trong vòng 4 tuần sau tiêm không? Nếu trả lời có, không nên tiêm MMR hoặc giải thích nguy cơ lý thuyết CRS # 0-1,6% và tiêm MMR. Không có chỉ định tiêm MMR cho phụ nữ mang thai.
CDC khuyến cáo nên có thai tối thiểu 28 ngày sau khi tiêm. Tiêm MMR hay varicella vaccine trong thai kỳ không phải là lý do để CDTK.
Năm 1971-1989, CDC nghiên cứu trên 321 phụ nữ tiêm vaccine Rubella trước và sau thụ thai 3 tháng, kết quả 324 trẻ sinh sống và không có bằng chứng CRS. Mặc dù người ta xét nghiệm máu trẻ sơ sinh tìm thấy khoảng 1-2% trẻ sinh ra có virus Rubella trong máu. Độ tin cậy 95%. (CDC, 1989).
Nghiên cứu tại Hoa Kỳ, giai đoạn 1971-1981, trên 700 thai phụ đã vô tình tiêm vaccine Rubella RA 27/3 trong thời gian 3 tháng trước và trong thai kỳ, không một trẻ sơ sinh nào bị CRS.
Nghiên cứu cũng cho thấy nếu nhiễm quai bị trong tam cá nguyệt I có thể làm tăng nguy cơ sẩy thai tự nhiên. Không có bằng chứng vaccine quai bị gây dị tật bẩm sinh ở người (Rubella vaccination during pregnancy - United States, 1971-1981. MMWR 31(35):477-481, September 10,1982).
Nghiên cứu CDC năm 1971-1989 trên 226 phụ nữ tiêm RA 27/3 Rubella vaccine trước và sau thụ thai 3 tháng, kết quả không có bằng chứng nhiễm Rubella bẩm sinh sau sinh (CDC, 1998).
Nghiên cứu của ACIP năm 1989, nhiễm sởi trong thai kỳ làm tăng nguy cơ cho bào thai như làm tăng tỉ lệ sẩy thai, thai lưu, dị tật bẩm sinh, sinh non… Chưa có nghiên cứu thích hợp đối với tiêm vaccine sởi trong thai kỳ. Tuy nhiên, nên cẩn trọng khi thừa nhận những vaccine sống có thể tác hại lên bào thai (ACIP, 1989).
Một số nghiên cứu gần đây chỉ ra rằng khi tiêm MMR trong thời gian hậu sản thì virus Rubella có thể tiết ra trong sữa mẹ. Huyết thanh học của trẻ cho thấy có nhiễm virus Rubella, tuy nhiên, không có trường hợp mắc bệnh nghiêm trọng nào được báo cáo (Lerman, 1981).
Theo báo cáo của OTIS (organization of Teratology Information Specialists) năm 2010, nghiên cứu trên một số lượng lớn các thai phụ có tiêm MMR trong thai kỳ, người ta nhận thấy không có trường hợp nào bị hội chứng Rubella bẩm sinh và MMR không làm tăng tỉ lệ trẻ dị tật sau sinh (www.OTISpregnancy.org).
KẾT LUẬN
Tiếng Việt
1. CDC (1989). Rubella vaccination during pregnancy - United State, 1971-1988, MMWR; 38:289-293.
2. CDC (1994). Typhoid immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 43 (No.RR-14):7.
3. CDC (1997). Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 46 (No.RR-8):6.
4. CDC (1998). Measles, mumps, and rubella - vaccine use and strategies for elimination of measles, rubella, and congenital rubella syndrome and control of mumps: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1998; 47 (No.RR-8):18, 32-33.
5. CDC (2000). Poliomyelitis prevention in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 49 (No.RR-5):14.
6. CDC (2001). Control and Prevention of rubella: evaluation and management of suspected outbreaks, rubella in pregnant women, and surveillance for congenital rubella syndrome. MMWR; 50 (No.PR-12):1-30.
7. CDC (2001). Notice to readers: revised ACIP recommendation for avoiding pregnancy after receiving a rubella-containing vaccine. MMWR; 50 (No.49):1117.
8. CDC (2001). Vaccinia (smallpox) vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2001; 50 (No.RR-10):12 & 19.
9. CDC (2003). Recommendations for using smallpox vaccine in a pre-event vaccination program: supplemental recommendations of the Advisory Committee on Immunization Practices (ACIP) and the Healthcare Infection Control Practices Advisory Committee (HICPAC). MMWR; 52 (No.RR-7):9-11.
10. CDC (2006). A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 2: immunization of adults. MMWR; 55 (No.RR-16):13.
11. CDC (2007). Prevention of varicella: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 56 (No.RR-4):28,31.
12. CDC (2008). Human rabies prevention - United States, 2008: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 57 (No.RR-3):20-21.
13. CDC (2008). Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 57 (No.RR-5):21.
14. CDC (2008). Prevention of pertussis, tetanus, and diphtheria among pregnant and postpartum women and their infants: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 57 (No.RR-4):49.
15. CDC (2009). Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 54 (No.RR-7):15.
16. CDC (2010). FDA licensure of bivalent human papillomavirus vaccine (HPV2, Cervarix) for use in females and updated HPV vaccination recommendations from the Advisory Committee on Immunization Practices (ACIP). MMWR; 59 (No.20):629.
17. CDC (2010). Japanese encephalitis vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 49 (No.RR-1):12-15.
18. CDC (2010). Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010. MMWR; 59 (No. RR-8):39.
19. CDC (2010). Use of anthrax vaccine in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 59 (No.RR-6):19-21.
20. CDC (2010). Yellow fever vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 59 (No.RR-7):13 & 21.
21. CDC (2011). General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 60 (No.2):26-27.
22. CDC (2011). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine (Tdap) in pregnant women and persons who have or anticipate having close contact with an infant aged <12 months - Advisory Committee on Immunization Practices (ACIP), 2011. MMWR; 60 (No.41):1426.
23. CDC (2012). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis vaccine (Tdap) in pregnant women - Advisory Committee on Immunization Practices (ACIP), 2012. MMWR; 62 (No.7):131-35.
24. CDC (2013). Advisory Committee on Immunization Practices (ACIP) recommended immunization schedules for persons aged 0 through 18 years and adults aged 19 years and older - United States, 2013. MMWR; 62 (Suppl 1):11.
25. CDC (2013). Guidelines for vaccinating pregnant women: Abstracted from recommendations of the Advisory Committee on Immunization Practices (ACIP).
26. CDC (2013). Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 62 (No.RR-2):18.
27. CDC. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 1: immunization of infants, children, and adolescents. MMWR 2005; 54 (No. RR-16):14.
28. CDC. website http://www.cdc.gov/tb/publications/factsheets/vaccine/BCG.htm.
29. Eberhart-Phillips JE et al. (1993). Measles in pregnancy: a descriptive study of 58 cases. Obstetrics and Gynecology; 82(5):797-801.
30. Jespersen CS et al. (1977). Measles as a cause of fetal defects: a retrospective study of ten measles epidemics in Greenland. Acta Paediatr Scand; 66:367-372.
31. Landes RD, Bass JW, Millunchick EW, Oetgen WJ (1980). Neonatal rubella following postpartum maternal immunization. J Pediatr; 97:465-467.
32. Lerman SJ (1981). Neonatal rubella following postpartum maternal immunization. J Pediatr; 98: 668. (Letter).
33. Losonsky GA, Fishaut JM, Strussenber J, Ogra PL (1982). Effect of immunization against rubella on lactation products. II. Maternal-neonatal interactions. J Infect Dis; 145:661-666.
34. Recommendations of the Immunization Practices Advisory Committee (ACIP) (1989). Mumps Prevention, MMWR 38(22): 388-400, June 9, 1989.
35. Rubella vaccination during pregnancy - United States, 1971-1981 (1982). MMWR; 31(35): 477-481, September 10, 1982.
Nhiễm trùng bào thai ảnh hưởng nghiêm trọng đến sức khỏe và sự sống thai nhi, ngoài ra, nhiễm trùng bào thai còn để lại những di chứng nặng nề gây ảnh hưởng trầm trọng đến chất lượng sống của trẻ và là gánh nặng của gia đình, xã hội.
Tùy vào thời điểm nhiễm bệnh, tỉ lệ con bị hội chứng Rubella bẩm sinh rất thay đổi: 90-100% khi thai dưới 8 tuần, 50% khi thai 8-12 tuần, 20% ở tuổi thai 12-20 tuần, sau 20 tuần thì tỉ lệ này khoảng <1%.
Ngoài ra, thai phụ còn có thể bị nhiễm các virus khác như cúm, viêm gan B, quai bị, sởi, thủy đậu, đậu mùa… cũng có thể gây ra hội chứng nhiễm trùng bào thai và để lại hậu quả nghiêm trọng cho bé sau sinh.
Chính vì tính chất nghiêm trọng của nhiễm trùng bào thai, đặc biệt là Rubella nên phụ nữ trong độ tuổi sinh sản đã được khuyến cáo nên chủ động đi tiêm chủng vaccine Rubella trước khi quyết định có thai. Tuy nhiên, cũng có một số trường hợp vô tình đã tiêm vaccine này quanh thời điểm thụ thai. Điều này đã khiến không ít gia đình quyết định bỏ thai. Vậy tiêm vaccine Rubella có an toàn trong thời điểm này không? Có nên khuyên thai phụ bỏ thai nếu vô tình tiêm MMR trước và sau thời điểm có thai 3 tháng không?
CẬP NHẬT HƯỚNG DẪN TIÊM VACCINE TRONG THAI KỲ (CDC, 2013)
Vaccine giúp bảo vệ thai phụ và thai nhi phát triển khỏe mạnh. Trước khi mang thai, phụ nữ trong độ tuổi sinh sản nên được tiêm đầy đủ các loại vaccine theo chương trình tiêm chủng. Điều này giúp bảo vệ bà mẹ và con của họ.
Những vaccine sống nên được tiêm trước khi có thai ít nhất 1 tháng. Những vaccine bất hoạt có thể tiêm trước hoặc trong thai kỳ nếu cần thiết. Một số vaccine được CDC khuyến cáo dùng trong thai kỳ: cúm, Tdap (27-36 tuần) và một số vaccin cho thai phụ khi đi du lịch.
Tiêm chủng cho sản phụ ngay sau sinh theo chương trình tiêm chủng được khuyến cáo là an toàn cho sản phụ và trẻ sơ sinh, ngay cả trong thời kỳ cho con bú. Sản phụ chưa được tiêm vaccine Tdap trong thai kỳ thì nên tiêm chủng ngay sau sinh, điều này cũng giúp bảo vệ bé. Nếu sản phụ chưa được chủng ngừa MMR thì nên tiêm vaccine này cho bà mẹ ngay trước khi xuất viện. Vaccine cúm bất hoạt chưa được tiêm trong thai kỳ thì cũng nên tiêm cho bà mẹ ngay sau khi sinh để bảo vệ con của họ. Ngoài ra, có thể dùng vaccine cúm sống giảm độc lực để tiêm cho bà mẹ.
.PNG)

ĐÁNH GIÁ SƠ LƯỢC MỘT SỐ TRƯỜNG HỢP TIÊM VACCINE SỞI - QUAI BỊ - RUBELLA TRONG VÒNG 3 THÁNG QUANH THỜI ĐIỂM THỤ THAI

Nhận xét:
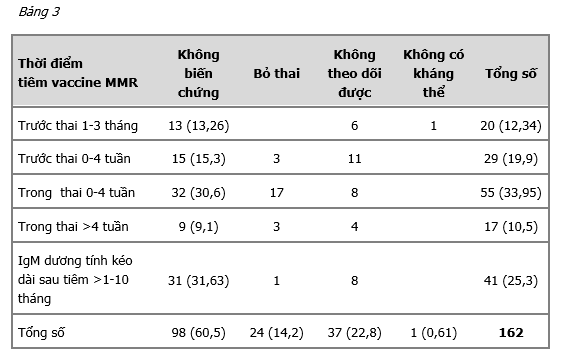
Trong tổng số 162 trường hợp đã tiêm MMR trong thời gian 3 tháng quanh thời điểm thụ thai, chúng tôi nhận thấy:
- 37 trường hợp không theo dõi được, chiếm tỉ lệ 22,8%.
- 24 trường hợp bỏ thai, chiếm tỉ lệ 14,2%.
- 1 trường hợp không có kháng thể, chiếm tỉ lệ 0,61%.
- 41 ca IgM dương tính kéo dài 1-10 tháng sau tiêm MMR (25,3%).
- 53,85% trường hợp tiêm MMR trong thời gian 1 tháng trước và sau thụ thai.
Trong khảo sát của chúng tôi, có 41 ca IgM dương tính kéo dài 1-10 tháng sau tiêm MMR. Tuy nhiên, chúng tôi chưa ghi nhận trường hợp nào bị hội chứng Rubella bẩm sinh. Đây là trường hợp cần theo dõi và tư vấn kỹ cho bệnh nhân về vấn đề IgM kéo dài sau tiêm, khả năng ảnh hưởng đến thai hầu như không có.
Khoảng 53,85% trường hợp tiêm MMR trong thời gian 1 tháng trước và sau thụ thai, tuy nhiên, chúng tôi chưa ghi nhận trường hợp nào bị biến chứng Rubella bẩm sinh.
PHÂN LOẠI VACCINE CỦA FDA
FDA đề ra bảng phân loại vaccine trong thai kỳ:
- Nhóm B: vaccine: HPV, cúm dạng bất hoạt (Fluarix), viêm não Nhật Bản (Ixiaro), viêm não mô cầu (Menveo), bạch hầu - ho gà - uốn ván (Boostrix).
- Nhóm C: vaccine: viêm gan A, viêm gan B, cúm sống giảm độc lực (Fluzone), MMR, viêm não mô cầu (Menactra, Menomune), Pneumococcal, bại liệt, uốn ván - bạch hầu (Td), thủy đậu, giời leo, lao, dại, thương hàn, sốt vàng da.
- Nhóm D: vaccine: bệnh than, đậu mùa.
Năm 1962, Parman và Weller phân lập được virus Rubella; đến năm 1969, vaccine Rubella ra đời. Meruvax, Rubelogen, Cendevax (1969), Meruvax – RA 27/3 (1979) là vaccine sống giảm độc lực, hiệu quả trong 95%, có tác dụng tạo miễn dịch suốt đời.
Tác dụng không mong muốn: sốt (5%), nổi ban (5%), đau khớp cấp (25%), giảm tiểu cầu (1/30.000), viêm tuyến mang tai, điếc rất hiếm, bệnh lý não (<1/1.000.000). Trước khi tiêm MMR, nên hỏi bệnh nhân xem có dự định có thai trong vòng 4 tuần sau tiêm không? Nếu trả lời có, không nên tiêm MMR hoặc giải thích nguy cơ lý thuyết CRS # 0-1,6% và tiêm MMR. Không có chỉ định tiêm MMR cho phụ nữ mang thai.
CDC khuyến cáo nên có thai tối thiểu 28 ngày sau khi tiêm. Tiêm MMR hay varicella vaccine trong thai kỳ không phải là lý do để CDTK.
Năm 1971-1989, CDC nghiên cứu trên 321 phụ nữ tiêm vaccine Rubella trước và sau thụ thai 3 tháng, kết quả 324 trẻ sinh sống và không có bằng chứng CRS. Mặc dù người ta xét nghiệm máu trẻ sơ sinh tìm thấy khoảng 1-2% trẻ sinh ra có virus Rubella trong máu. Độ tin cậy 95%. (CDC, 1989).
Nghiên cứu tại Hoa Kỳ, giai đoạn 1971-1981, trên 700 thai phụ đã vô tình tiêm vaccine Rubella RA 27/3 trong thời gian 3 tháng trước và trong thai kỳ, không một trẻ sơ sinh nào bị CRS.
Nghiên cứu cũng cho thấy nếu nhiễm quai bị trong tam cá nguyệt I có thể làm tăng nguy cơ sẩy thai tự nhiên. Không có bằng chứng vaccine quai bị gây dị tật bẩm sinh ở người (Rubella vaccination during pregnancy - United States, 1971-1981. MMWR 31(35):477-481, September 10,1982).
Nghiên cứu CDC năm 1971-1989 trên 226 phụ nữ tiêm RA 27/3 Rubella vaccine trước và sau thụ thai 3 tháng, kết quả không có bằng chứng nhiễm Rubella bẩm sinh sau sinh (CDC, 1998).
Nghiên cứu của ACIP năm 1989, nhiễm sởi trong thai kỳ làm tăng nguy cơ cho bào thai như làm tăng tỉ lệ sẩy thai, thai lưu, dị tật bẩm sinh, sinh non… Chưa có nghiên cứu thích hợp đối với tiêm vaccine sởi trong thai kỳ. Tuy nhiên, nên cẩn trọng khi thừa nhận những vaccine sống có thể tác hại lên bào thai (ACIP, 1989).
Một số nghiên cứu gần đây chỉ ra rằng khi tiêm MMR trong thời gian hậu sản thì virus Rubella có thể tiết ra trong sữa mẹ. Huyết thanh học của trẻ cho thấy có nhiễm virus Rubella, tuy nhiên, không có trường hợp mắc bệnh nghiêm trọng nào được báo cáo (Lerman, 1981).
Theo báo cáo của OTIS (organization of Teratology Information Specialists) năm 2010, nghiên cứu trên một số lượng lớn các thai phụ có tiêm MMR trong thai kỳ, người ta nhận thấy không có trường hợp nào bị hội chứng Rubella bẩm sinh và MMR không làm tăng tỉ lệ trẻ dị tật sau sinh (www.OTISpregnancy.org).
KẾT LUẬN
- Vaccine giúp bảo vệ thai phụ và thai nhi phát triển khỏe mạnh. Trước khi mang thai, phụ nữ trong độ tuổi sinh sản nên được tiêm đầy đủ các loại vaccine theo chương trình tiêm chủng. Điều này giúp bảo vệ bà mẹ và con của họ.
- Những vaccine sống nên được tiêm trước khi có thai ít nhất 1 tháng. Những vaccine bất hoạt có thể tiêm trước hoặc trong thai kỳ nếu cần thiết.
- Khảo sát của chúng tôi và một vài nghiên cứu trên thế giới chỉ ra rằng tiêm vaccine MMR trong thời gian 3 tháng trước và sau thời điểm thụ thai không ghi nhận trường hợp Rubella bẩm sinh nào và không làm tăng nguy cơ dị tật bẩm sinh. Tuy nhiên, cần có nhiều nghiên cứu hơn nữa về tác dụng phụ của MMR lên bào thai.
- Chúng ta cần tư vấn kỹ càng hơn về việc tiêm MMR quanh thời điểm thụ thai. Đây không phải là chỉ định chấm dứt thai kỳ. Nguy cơ lý thuyết ảnh hưởng lên thai là # 0-1,6%.
- Nếu chúng ta làm tốt công tác tư vấn sẽ giúp giảm lo lắng cho thai phụ, góp phần hạ thấp tỉ lệ bỏ thai đáng tiếc do vô tình tiêm MMR trong thai kỳ.
- ACIP cảnh báo rằng mặc dù nguy cơ của vaccine ảnh hưởng lên thai nhi rất thấp nhưng không phải vaccine nào cũng được tiêm thường qui trong thai kỳ.
Tiếng Việt
- Nguyễn Thị Hạnh Lê, Trịnh Hữu Tùng, Trương Công Hòa (2008). Đặc điểm hội chứng Rubella bẩm sinh tại Bệnh viện Nhi đồng 2 năm 2007. Hội nghị Việt-Pháp-Châu Á-Thái Bình Dương lần VIII.
1. CDC (1989). Rubella vaccination during pregnancy - United State, 1971-1988, MMWR; 38:289-293.
2. CDC (1994). Typhoid immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 43 (No.RR-14):7.
3. CDC (1997). Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 46 (No.RR-8):6.
4. CDC (1998). Measles, mumps, and rubella - vaccine use and strategies for elimination of measles, rubella, and congenital rubella syndrome and control of mumps: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1998; 47 (No.RR-8):18, 32-33.
5. CDC (2000). Poliomyelitis prevention in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 49 (No.RR-5):14.
6. CDC (2001). Control and Prevention of rubella: evaluation and management of suspected outbreaks, rubella in pregnant women, and surveillance for congenital rubella syndrome. MMWR; 50 (No.PR-12):1-30.
7. CDC (2001). Notice to readers: revised ACIP recommendation for avoiding pregnancy after receiving a rubella-containing vaccine. MMWR; 50 (No.49):1117.
8. CDC (2001). Vaccinia (smallpox) vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2001; 50 (No.RR-10):12 & 19.
9. CDC (2003). Recommendations for using smallpox vaccine in a pre-event vaccination program: supplemental recommendations of the Advisory Committee on Immunization Practices (ACIP) and the Healthcare Infection Control Practices Advisory Committee (HICPAC). MMWR; 52 (No.RR-7):9-11.
10. CDC (2006). A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 2: immunization of adults. MMWR; 55 (No.RR-16):13.
11. CDC (2007). Prevention of varicella: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 56 (No.RR-4):28,31.
12. CDC (2008). Human rabies prevention - United States, 2008: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 57 (No.RR-3):20-21.
13. CDC (2008). Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 57 (No.RR-5):21.
14. CDC (2008). Prevention of pertussis, tetanus, and diphtheria among pregnant and postpartum women and their infants: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 57 (No.RR-4):49.
15. CDC (2009). Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 54 (No.RR-7):15.
16. CDC (2010). FDA licensure of bivalent human papillomavirus vaccine (HPV2, Cervarix) for use in females and updated HPV vaccination recommendations from the Advisory Committee on Immunization Practices (ACIP). MMWR; 59 (No.20):629.
17. CDC (2010). Japanese encephalitis vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 49 (No.RR-1):12-15.
18. CDC (2010). Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010. MMWR; 59 (No. RR-8):39.
19. CDC (2010). Use of anthrax vaccine in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 59 (No.RR-6):19-21.
20. CDC (2010). Yellow fever vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 59 (No.RR-7):13 & 21.
21. CDC (2011). General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 60 (No.2):26-27.
22. CDC (2011). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine (Tdap) in pregnant women and persons who have or anticipate having close contact with an infant aged <12 months - Advisory Committee on Immunization Practices (ACIP), 2011. MMWR; 60 (No.41):1426.
23. CDC (2012). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis vaccine (Tdap) in pregnant women - Advisory Committee on Immunization Practices (ACIP), 2012. MMWR; 62 (No.7):131-35.
24. CDC (2013). Advisory Committee on Immunization Practices (ACIP) recommended immunization schedules for persons aged 0 through 18 years and adults aged 19 years and older - United States, 2013. MMWR; 62 (Suppl 1):11.
25. CDC (2013). Guidelines for vaccinating pregnant women: Abstracted from recommendations of the Advisory Committee on Immunization Practices (ACIP).
26. CDC (2013). Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR; 62 (No.RR-2):18.
27. CDC. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) part 1: immunization of infants, children, and adolescents. MMWR 2005; 54 (No. RR-16):14.
28. CDC. website http://www.cdc.gov/tb/publications/factsheets/vaccine/BCG.htm.
29. Eberhart-Phillips JE et al. (1993). Measles in pregnancy: a descriptive study of 58 cases. Obstetrics and Gynecology; 82(5):797-801.
30. Jespersen CS et al. (1977). Measles as a cause of fetal defects: a retrospective study of ten measles epidemics in Greenland. Acta Paediatr Scand; 66:367-372.
31. Landes RD, Bass JW, Millunchick EW, Oetgen WJ (1980). Neonatal rubella following postpartum maternal immunization. J Pediatr; 97:465-467.
32. Lerman SJ (1981). Neonatal rubella following postpartum maternal immunization. J Pediatr; 98: 668. (Letter).
33. Losonsky GA, Fishaut JM, Strussenber J, Ogra PL (1982). Effect of immunization against rubella on lactation products. II. Maternal-neonatal interactions. J Infect Dis; 145:661-666.
34. Recommendations of the Immunization Practices Advisory Committee (ACIP) (1989). Mumps Prevention, MMWR 38(22): 388-400, June 9, 1989.
35. Rubella vaccination during pregnancy - United States, 1971-1981 (1982). MMWR; 31(35): 477-481, September 10, 1982.
Các tin khác cùng chuyên mục:
TIN CẬP NHẬT
TIN CHUYÊN NGÀNH
LỊCH HỘI NGHỊ MỚI
Năm 2020
New World Saigon Hotel (Số 76 Lê Lai, Phường Bến Nghé, Quận 1, ...
Năm 2020
Caravelle Hotel Saigon, chiều thứ bảy 20.4 và chủ nhật 21.4.2024
Năm 2020
Khách sạn Caravelle Saigon, Chủ nhật 21.1.2024 (9:00 - 11:15)
GIỚI THIỆU SÁCH MỚI
Sách dự kiến phát hành đầu tháng 6.2024
Sách ra mắt ngày 9 . 3 . 2024 và gửi đến quý hội viên trước ...
Y học sinh sản số 68 ra mắt ngày 25 . 12 . 2023 và gửi đến quý ...
FACEBOOK






